PEDV、TGEV、PARV多重 RT-PCR檢測方法的建立及其應用
郭容利, 何孔旺, 倪艷秀, 茅愛華, 溫立斌, 李 彬, 王小敏, 俞正玉
(江蘇省農業科學院獸醫研究所,農業部獸用生物制品工程技術重點實驗室,國家獸用生物制品工程技術研究中心,江蘇 南京 210014)
豬流行性腹瀉病毒(Porcine epidemic diarrhea virus,PEDV)、豬傳染性胃腸炎病毒(Transmissible gastroenteritis of pigs virus,TGEV)和豬A群輪狀病毒(Porcine group A rotavirus,PARV)是引起仔豬腹瀉的主要腸道病毒[1]。三者有類似的傳染途徑和臨床癥狀,感染豬均表現為水樣腹瀉、嘔吐、脫水及新生仔豬的高死亡率,三者流行病學和病理剖檢也極其相似,但三種病原沒有共同的抗原性,不能交互免疫,而又有混合感染,也易繼發其他細菌性感染,導致仔豬死亡率升高或生長緩慢,尤其是近幾年,在中國病毒性腹瀉暴發嚴重,仔豬的死亡率上升[2-4],給養豬業帶來巨大經濟損失。PEDV、TGEV和PARV傳統的診斷方法主要有:病毒分離、組織培養及用免疫學方法診斷抗原[5-7]。常規的RT-PCR也廣泛應用于這三種病毒的檢測[8-10],而且RT-PCR因能快速檢測出微量核酸而更具優越性。本試驗旨在建立一種多重RT-PCR法,可快速直接地檢測臨床樣品,同時區分鑒別診斷PEDV、TGEV和PARV三種腹瀉病毒,為進行豬病毒性腹瀉的流行病學調查和防控奠定一定的基礎。
1 材料與方法
1.1 病毒與病料
豬流行性腹瀉病毒(PEDV)CV777毒株、豬傳染性胃腸炎(TGEV)JSXB2010毒株、豬A群輪狀病毒(PARV)Nan86毒株、豬瘟病毒(HCV)、豬圓環病毒2型(PCV2)、豬繁殖與呼吸綜合征病毒(PRRSV)、豬偽狂犬病毒(PRV)均由本實驗室保存。
病料來自2011年10月~2013年2月江蘇省及周邊地區豬場的疑患病毒性腹瀉仔豬的糞便或小腸組織共154份。
1.2 主要試劑
Trizol LS Reagent為美國Invitrogen公司產品;反轉錄試劑盒為美國Promega公司產品;AxyPrep TM plasmid miniprep kit、Agarose gel DNA purification kit購自Axygen公司;pMD18-T載體克隆試劑盒、各限制性內切酶、DNA marker DL 2000等均購自TaKaRa公司;2×HSTMmix購自東盛公司;大腸桿菌DH5α由本實驗室保存;氯仿、異丙醇、無水乙醇購自上海化學試劑有限公司。
1.3 引物設計合成
根據GenBank上公布的PEDV核蛋白N基因序列、TGEV糖膜蛋白M基因序列、PARV內衣殼蛋白VP6基因序列,分別在其保守區設計1對特異性引物(表1),由上海英駿技術有限公司合成。

表1 引物序列Table 1 Sequences of the primers
1.4 RNA 的提取
在被檢樣品 200 μl上清中加入 TRIzol 800 μl,振蕩混勻后,室溫放置5 min;加入氯仿200 μl,劇烈振蕩后,室溫放置10 min;4℃ 12 000 r/min離心10 min,取上清,加入等量異丙醇,混勻,-20℃放置2 h以上;4℃ 12 000 r/min離心15 min,去上清,沉淀用1 ml 75%的無RNA酶的乙醇洗滌;4℃ 7 500 r/min離心5 min去上清,室溫干燥RNA沉淀20 min,加入DEPC水20 μl,充分溶解,-20℃凍存備用。
1.5 單項RT-PCR擴增
參照Promega反轉錄試劑盒說明書。反應體系:樣品RNA 模板2.0 μl,10×RT buffe反轉錄緩沖液 2.0 μl,dNTP(10 mmol/L)2.0 μl ,MgCl2(25 mmol/L)3.0 μl,RNasin 0.5 μl,AMV 反轉錄酶 0.5 μl,隨機引物 1.0 μl,加 ddH2O 至終體積 20.0 μl。反轉錄程序:25℃反應15 min,42℃孵育60 min,95℃ 5 min,同時設立陰性、陽性對照。cDNA產物于-20℃保存備用。
單項PCR擴增cDNA PCR反應總體系為25.00 μl:2 ×HSTMMix 12.50 μl,上游引物和下游引物(20 pmol/μl)各 0.25 μl,cDNA 2.00 μl,加 ddH2O 至終體積25.00 μl。反應參數:95℃預變性4 min;94℃變性30 s,53℃退火30 s,72℃ 延伸30 s,共35個循環;最后72℃延伸7 min。反應結束后,用1%瓊脂糖凝膠電泳觀察。
1.6 單項PCR最佳退火溫度范圍的確定
將退火溫度設定為50.8℃、52.4℃、54.1℃、55.8℃、57.5℃、59.2℃ 6個梯度,上下游引物均取0.25 μl,采用不同的退火溫度進行PCR擴增,根據試驗結果,大致確定單項PCR最佳退火溫度的范圍。
1.7 PEDV、TGEV和PARV多重RT-PCR退火溫度和引物濃度的確定
根據方法1.6,在確定的退火溫度范圍內,改變3對引物(上游引物和下游引物濃度均為 20 pmol/μl)的體積(表2),在其他條件不變的情況下進行PCR擴增。
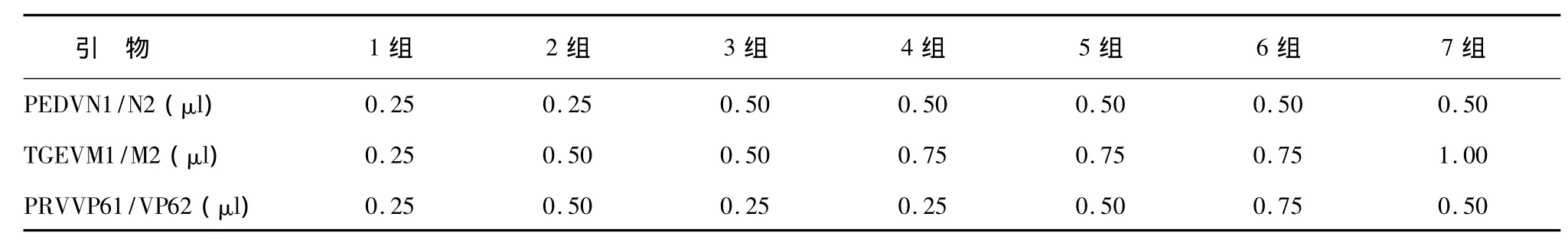
表2 RT-PCR引物體積分組Table 2 The grouping of the RT-PCR primer volume
1.8 多重RT-PCR的特異性試驗
分別取 PEDV、TGEV和 PARV混合 cDNA模板,PEDV,TGEV,PARV,HCV,PRRSV,VERO、ST、Marck145三種細胞混合物 cDNA模板,PCV2,PRV DNA模板,以H2O作為陰性對照,在方法1.7確定的退火溫度和引物濃度下進行PCR擴增。
1.9 多重RT-PCR的敏感性試驗
將3種病毒等量(各病毒含量107TCID50/ml)混合后提取的RNA全部反轉錄所得cDNA按10倍倍比(100~108)稀釋,各稀釋度樣品在確定的退火溫度和3對引物濃度的情況下,其他條件不變進行PCR擴增。
1.10 多重RT-PCR檢測方法的臨床應用
利用所建立的多重RT-PCR方法檢測來自2011年10月~2013年2月江蘇省及周邊地區豬場的疑患病毒性腹瀉仔豬的糞便或小腸組織共154份病料。
1.11 多重RT-PCR產物測序及序列比對
將4份PEDV、1份TGEV和1份PARV多重RT-PCR臨床檢驗的陽性產物回收、克隆、酶切鑒定后送上海英駿生物技術有限公司測序,利用NCBI中的BLAST軟件對測序結果進行序列比對。
2 結果
2.1 單項PCR退火溫度的確定
采用不同的退火溫度進行PCR擴增(圖1),退火溫度在52.4至55.8℃之間試驗效果相對較好。
2.2 PEDV、TGEV和PARV多重項RT-PCR退火溫度和引物濃度范圍的確定
在52.4℃、54.1℃、55.8℃ 3種退火溫度下,改變3對引物的濃度,在其他條件不變的情況下進行PCR擴增。根據擴增結果(圖2),確定PEDV、TGEV和PARV多重RT-PCR最佳的條件為:退火溫度54.1℃,引物體積組合為第3組(PEDVN1/N2:0.5 μl/0.5 μl;TGEVM1/M2:0.5 μl/0.5 μl;PARVVP61/VP62:0.25 μl/0.25 μl)。
2.3 多重RT-PCR的特異性
用建立的多重 RT-PCR對 PEDV、TGEV和PARV 混合 cDNA 模板,PEDV,TGEV,PARV,HCV,PRRSV,Vero、ST、Marck145 混合細胞 cDNA 模板,PCV2、PRV DNA模板,ddH2O空白對照進行擴增(圖3),只有PEDV、TGEV和 PARV混合 cDNA模板及PEDV、TGEV和PARV cDNA模板擴增出與目的片段大小一致的條帶。說明本試驗建立的多重RT-PCR具有很好的特異性。
2.4 多重RT-PCR的敏感性
將三種病毒混合后提取的RNA全部反轉錄所得cDNA按10倍倍比稀釋,在確定的退火溫度以及引物濃度下,其他條件不變,進行PCR擴增(圖4)。假定所提取的RNA無降解,全部反轉錄,此多重RT-PCR可檢測到約50 TCID50的混合病毒量。

圖1 PEDV、TGEV和PARV單項RT-PCR退火溫度范圍Fig.1 Annealing temperature of RT-PCR for PEDV,TGEV and PARV detection,respectively

圖2 多重RT-PCR引物濃度與退火溫度Fig.2 Primer concentration and annealing temperature of multiplex RT-PCR
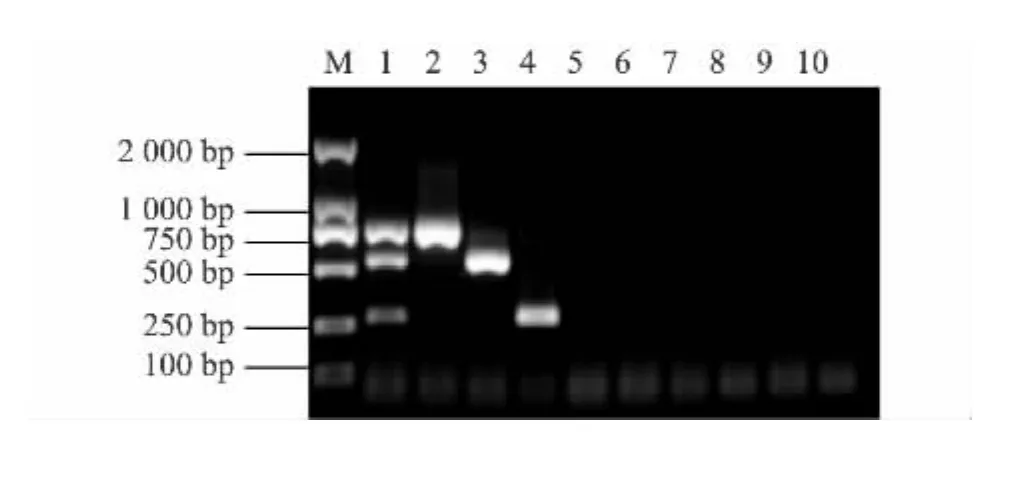
圖3 多重RT-PCR的特異性Fig.3 Specificity of the multiplex RT-PCR assay
2.5 多重RT-PCR的臨床應用
利用多重RT-PCR檢測了仔豬腹瀉的糞便或小腸組織共154份病料。PEDV、TGEV和PARV的陽性率分別為 53.2%,8.4% 和 5.2%。PEDV、TGEV共感染的概率為5.2%,PEDV與PARV共感染的概率為 4.5%。
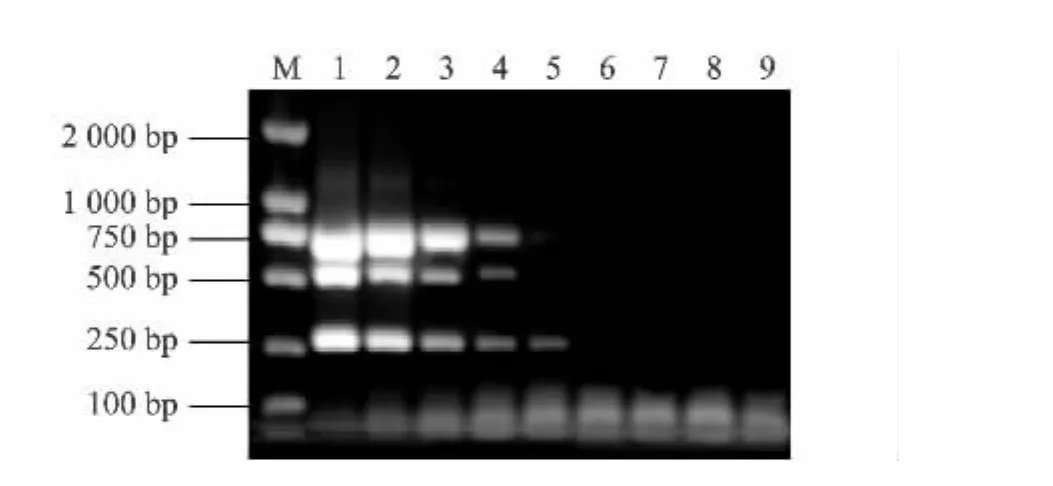
圖4 多重RT-PCR的敏感性Fig.4 Sensitivity of the mutiplex RT-PCR assay
2.6 多重RT-PCR產物的序列比對
將4株PEDV、1株TGEV、1株PARV陽性病料PCR產物回收克隆測序,利用NCBI中BLAST軟件對所測序列進行比對。結果顯示:4株PEDV的N基因序列與參考的CV777毒株(AF353511)同源性為分別為95.3%、97.6%、96%、95.7%;1株TGEV的M基因序列與參考的WH-1毒株(HQ462571.1)同源性為99%;1株PARV與Porcine rotavirus A strain CMP34/00(EU372782)VP6序列的同源性為95%。測序結果進一步證明了建立的多重RT-PCR檢測方法具有良好的特異性。
3 討論
常規的病毒診斷方法有病毒分離、熒光抗體檢測和免疫組織化學法等,但都有一些缺陷。目前,病毒分離相當困難,熒光抗體檢測和免疫組織化學法有非特異性,PCR方法因其具有快速、特異、靈敏、準確等優點現己經廣泛應用于畜禽傳染病的快速診斷,但是,目前單一的RT-PCR方法用于多種病毒感染的臨床鑒別診斷,不能一次達到目的。而多重RT-PCR方法與上述檢測方法相比,存在顯著優勢:能一次確診單一感染或混合感染,達到診斷和鑒別的雙重目的;比傳統檢測方法更方便快速。
本試驗通過設計分別針對 PEDV、TGEV和PARV的3對特異性引物,將 PEDV、TGEV、PARV做陽性對照,對多重RT-PCR反應條件進行了優化,并對其特異性與敏感性進行了試驗。試驗結果證明該方法的特異性強、敏感性高,PCR產物測序結果進一步證明了建立的多重RT-PCR檢測方法具有良好的特異性,可應用于臨床鑒別診斷。本試驗建立的多重RT-PCR檢測方法采用商品化的反轉錄試劑盒,保障了試劑的標準化,運用其中的隨機引物可一次性反轉錄多種RNA病毒,減少操作步驟,更有利于標準化臨床檢測,具有較高的實用價值。此方法的建立為這3種病毒性腹瀉的流行病學調查奠定了基礎。
在中國,近幾年來,豬群中由病毒感染引起的仔豬腹瀉非常嚴重,而PEDV感染尤其嚴重,其感染率明顯高于另外的2個豬病毒性腹瀉病原,即豬傳染性胃腸炎(TGEV)和豬A群輪狀病毒(PARV)[9,11-13]。在本研究中,應用建立的多重 RTPCR方法對來自2011年10月~2013年2月江蘇省及周邊地區豬場的疑患病毒性腹瀉仔豬的糞便或小腸組織共154份病料進行了檢測,結果表明,豬群中豬流行性腹瀉病毒感染率仍然較高,達到了53.2%,而TGEV、PARV的陽性率相對較低,分別是8.4%、5.2%,從檢測的結果來分析,豬群中也存在幾種病毒共感染的現象。當這三種病毒有混合感染時,發病豬的癥狀較嚴重,致使仔豬死亡率上升。因此,為了預防病毒性腹瀉的發生,加強飼養管理和有效的疫苗接種是很有必要的。
[1]殷 震,劉景華.動物病毒學[M].2版.北京:科學出版社,1997:681-690.
[2]JIANFEI CHEN,XIAOZHEN LIU,DA SHI,et al.Complete genome sequence of a porcine epidemic diarrhea virus variant[J].J Virol,2012,86(6):3408.
[3]YONGWEN LUO,JIE ZHANG,XIANBO DENG,et al.Complete genome sequence of a highly prevalent isolate of porcine epidemic diarrhea virus in South China.[J].J Virol,2012,86(17):9551.
[4]JING BI,SONGLIN ZENG,SHAOBO XIAO,et al.Complete genome sequence of porcine epidemic diarrhea virus strain AJ1102 isolated from a suckling piglet with acute diarrhea in China[J].J Virol,2012,86(19):10910-10911.
[5]CARVAJAL A,LANZA I,DIEGO R.Evaluation of a blocking ELISA using monoclonal an tibodies for the detection of porcine epidemic diarrhea virus and its antibodies[J].J Vet Diagn Invest,1995,7:60-64.
[6]RODAK L,SMID B,NEV0RANKOVA Z.Verification of sensitivity and specificity of group A rotavirus detection in piglets faeces with monoclonal blocking ELISA methods[J].J Vet Med B,2004,51:160-165.
[7]R0DAK L,VAI ICEK L,SMID B,An ELISA optimized for porcine epidemic diarrhoea virus detection in faeces[J].Vet Microbiol,2005,105:9-17.
[8]ELSCHNER M,PRUDLO J,H0TZEL H.Nested reverse transcriptase polymerase chain reaction for the detection of group A rotavirus[J].J Vet M ed,2002,49:77-81.
[9]楊 群,何孔旺,陸承平.應用多重RT-PCR方法檢測158例豬糞樣中的兩種冠狀病毒[J].中國預防獸醫學報,2006,28(4):431-435.
[10]倪艷秀,何孔旺,俞正玉,等.檢測豬流行性腹瀉病毒的RTPCR 方法的建立[J].畜牧與獸醫,2004,36(1):10-12.
[11]陳建飛,馮 力,時洪艷,等.豬流行性腹瀉病毒CH/S株N蛋白基因的遺傳變異及其原核表達[J].中國預防獸醫學報,2007,29(11):856-860.
[12]田小艷,孫 華,鄧雨修,等.3種致豬腹瀉病毒的多重RT-PCR檢測[J].動物醫學進展,2009,30(9):54-57.
[13]張 坤,何啟蓋.豬流行性腹瀉病毒、豬傳染性胃腸炎病毒和豬A群輪狀病毒多重RT-PCR檢測方法的建立及臨床應用[J].畜牧獸醫學報,2010,41(8):1001-1005.

