肺結核患者療程中外周血輔助性和調節性T細胞的動態研究
張影 陸堅 侯志平 張明霞 陳心春 張興樹 邱振綱
近年來,關于各種免疫細胞與肺結核的發生、發展與轉歸的研究越來越多,而目前研究較多的是CD4+CD25+CD127low調節性T細胞和輔助性T細胞17(helper T cells 17,Th17)。CD4+CD25+CD127low調節性T細胞是在胸腺內發育成熟的抑制自身免疫和移植排斥反應作用的一群細胞,約占CD4+T細胞總數的5%~10%,在免疫調節過程中主要發揮抑制作用[1-6]。Th17細胞屬于CD4+T細胞亞群,其通過分泌細胞因子白細胞介素(IL)-17A和IL-17F而發揮重要的促炎癥作用[7-12]。目前,其與結核病之間關系的研究已成為近年的熱點,有研究顯示,Th17細胞是IL-17的主要來源細胞,而且參與抗結核的保護性免疫反應過程[13-16]。CD4+CD25+CD127low調節性T細胞和Th17細胞作為兩組在結核性免疫過程中發揮重要作用的免疫細胞,各自在結核免疫反應中作用的研究均較多,但對于兩組細胞在抗結核治療過程中的相互作用及其相應動態變化的研究報道較少。為此,筆者就抗結核治療中兩組細胞的相互變化情況進行了研究,現報道如下。
材料和方法
一、患者來源和標本
分為肺結核患者組,健康對照組和結核潛伏感染組共3個組。肺結核患者組32例,均為來自深圳市羅湖區慢性病防治院2011年1月至2011年6月門診收治的痰抗酸桿菌(acid-fast bacilli,AFB)涂片陽性的新發肺結核患者,其中男20例,女12例,年齡16~59歲,平均年齡(33.5±10.3)歲,隨訪抗結核治療后3個月、6個月;所有肺結核患者均經臨床癥狀、體征、X線胸片、痰抗酸桿菌涂片、痰結核分枝桿菌培養結果確定,并且菌種鑒定均為結核分枝桿菌。門診收治患者一旦發現痰涂片結果顯示陽性,且無涉及排除標準中任何一條,即考慮入組,待患者痰分枝桿菌培養結果明確為結核分枝桿菌感染,即算是完全符合條件入組,如痰分枝桿菌培養陰性,或不是結核分枝桿菌感染則排除。
對照組包括健康對照組和結核潛伏感染組。納入標準為:健康對照組45例,男25例,女20例,年齡20~49歲,平均年齡(35.5±10.1)歲,健康對照組為廣東醫學院附屬深圳第三醫院2011年1月至2011年3月體檢科健康體檢者,所有健康者均無咳嗽、咯痰、發熱等相關癥狀,X線胸片無異常,經我院自行研制結核酶聯免疫斑點試驗檢測提示結核分枝桿菌陰性;結核潛伏感染組25例,男13例,女12例,年齡25~52歲,平均年齡(36.2±9.9)歲。結核潛伏感染者為廣東醫學院附屬深圳第三醫院2011年1月至2011年3月體檢科健康體檢者,所有潛伏感染者均無咳嗽、咯痰、發熱等相關癥狀,X線胸片無異常,但經我院自行研制的結核酶聯免疫斑點試驗檢測提示結核分枝桿菌陽性。
所有研究對象均排除乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、HIV等病毒感染;排除其他慢性疾病如糖尿病、高血壓、腎炎及類風濕性關節炎、系統性紅斑狼瘡等自身免疫性疾病;所有結核病患者在入組前均未接受過抗結核治療。所有研究對象均采集肝素鋰抗凝的靜脈血5ml。具體程序經深圳第三醫院倫理委員會批準通過,患者及志愿者均簽署知情同意書。
本實驗在入組結束后已對三組入組者的性別進行卡方檢驗、年齡進行方差分析,提示差異均無統計學意義(表1)。
二、檢測方法
(一)主要設備和試劑
1.設備:流式細胞儀為美國BD公司生產,型號為BD Canto流式細胞儀。CO2培養箱購自日本三洋電機公司。
2.試劑:單克隆抗體 CD3-PerCP-Cy5.5(產品編號555334)、CD4-PerCP-Cy5.5(產品編號555348)、CD25-FITC(產品編號347643)、CD127-APC(產品編號558598)均購自美國BD公司。單克隆抗體CD3-APC-Cy7(產品編號 344818)、CD8-APC-Cy7(產品編號301016)、IL-17-PE(產品編號512306)均購自美國BioLegend公司。RPMI 1640培養基[含100mg/L鏈霉素、1×105U/L盤尼西林、10%胎牛血清(澳大利亞Invitrogen公司)、5×10-5mol/L 2-巰基乙醇]購自美國GIBCO公司。刺激物佛波酯(propylene glycol monomethyl ether acetate,PMA)、離子霉素(ionomycin)、蛋白轉運抑制劑(brefeldin A,BFA)均購自美國 Sigma-Aldrich公司。溶 血 素 (FACS lysing solution)及 破 膜 劑(FACS permeabilizing solution)均購自 BD Biosciences公司。密度梯度分離液LymphoprepTM1.077購自挪威Axis-Shield公司。

表1 三組入組者的性別年齡的比較
(二)流式細胞術分析
1.Th17細胞檢測:分別取45名健康志愿者、25例潛伏感染者肝素鋰抗凝全血250μl,32例活動性肺結核患者治療前及其治療3個月、6個月肝素鋰抗凝全血250μl,與750μl含10%胎牛血清RPMI 1640培養基充分混勻,共1ml,此培養體系中加入刺激物PMA、離子霉素終濃度分別為(50ng/ml、1μg/ml),振蕩混勻后于CO2培養箱,37℃孵育。1h后,在培養體系中加入阻斷因子BFA(終濃度10μg/ml),繼續CO2培養箱37℃孵育5h。常規進行細胞表面 CD3-PerCP-Cy5.5、CD8-APC-Cy7、溶血素、破膜劑、細胞內IL-17-PE因子染色(IL-17為Th17細胞分泌的主要細胞因子,因此檢測IL-17分泌量即可反映Th17細胞量)。具體操作均參照各抗體說明書執行。采用流式細胞儀進行染色結果分析。在淋巴細胞設門分析CD3+CD8-細胞(即CD3+CD4+細胞)表達情況,然后在CD3+CD4+細胞設門分析IL-17細胞因子所占CD3+CD4+T細胞的百分率(圖1)。
2.CD4+CD25+CD127low調節性T細胞檢測:分別取45名健康志愿者、25例潛伏感染者肝素鋰抗凝血4ml,32例活動性肺結核患者治療前及其治療3個月、6個月肝素鋰抗凝血4ml,使用LymphoprepTM1.077密度梯度分離液經密度梯度離心法分離外周血單個核細胞(PBMC),取2×105個單個核細胞,加入 APC-Cy7 標記的 CD3、PerCPCy5.5標記的CD4、FITC標記的CD25、APC標記的CD127抗體進行細胞表面染色,具體操作均參照各抗體說明書執行。采用流式細胞儀進行染色結果分析。在淋巴細胞設門分析CD3、CD4細胞表達情況,然后在CD4細胞設門分析CD25+CD127low細胞所占CD3+CD4+T細胞的百分率(圖2)。
(三)統計學分析
結 果
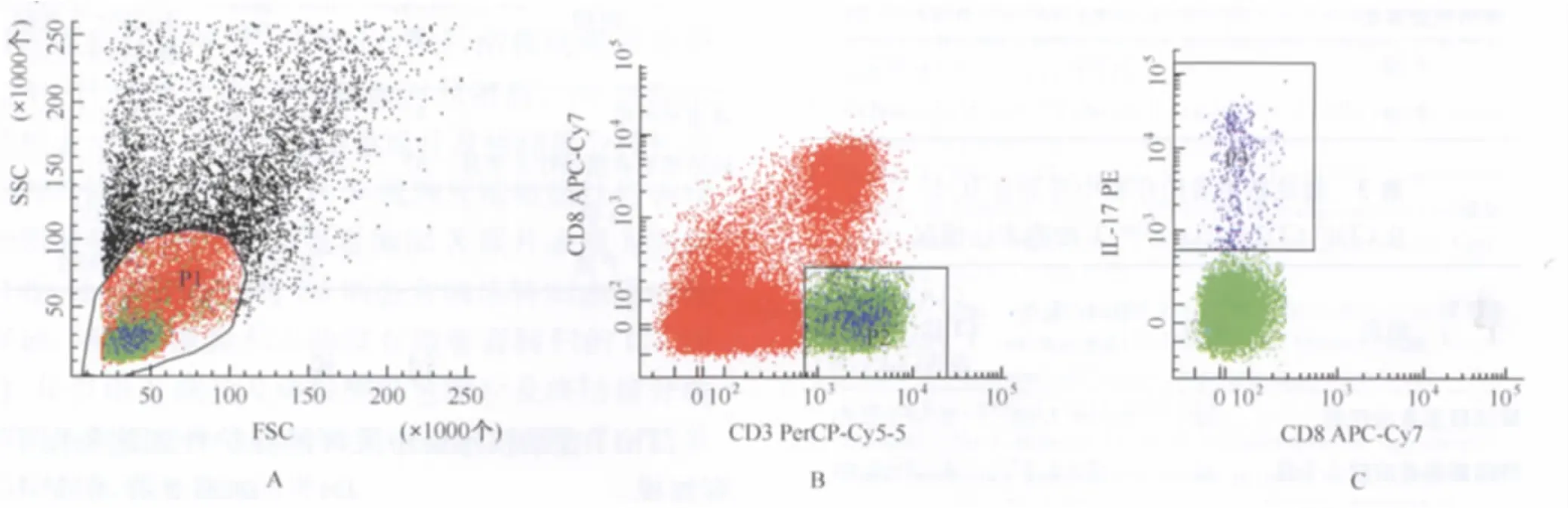
圖1 肺結核患者外周血IL-17表達散點圖

圖2 肺結核患者外周血CD4+CD25+CD127low T細胞表達散點圖
1.肺結核患者組外周血IL-17表達情況:肺結核患者組非特異性IL-17表達為(3.25±1.68)%,較健康對照組[(4.62±1.46)%]明顯較低(F=6.633,P<0.0001),與 潛 伏 感 染 者 [(4.12±1.82)%]比較,差異無統計學意義。肺結核患者隨治療時間的延長,IL-17逐漸增加,治療6個月[(5.58±1.66)%]較治療前[(3.25±1.68)%]及治療3個月[(4.17±2.27)%]明顯增加(F=12.244,P<0.0001和P=0.004)。治療3個月與治療前比較差異無統計學意義(F=12.244,P=0.057),治療6個月高于健康對照組(t=2.671,P=0.0093)(表2,3)。

表2 治療前各組外周血IL-17及CD4+CD25+CD127low T細胞表達情況
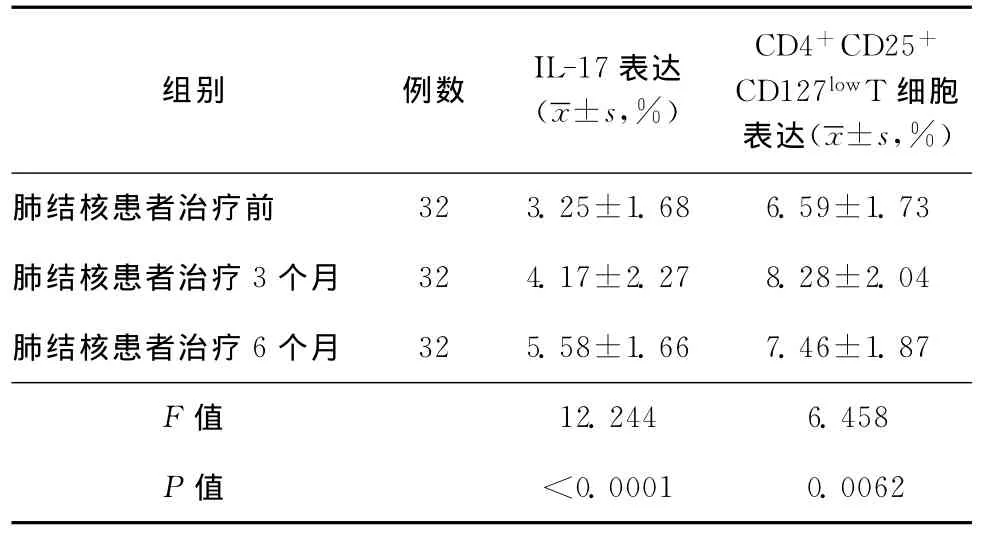
表3 肺結核患者組療程中外周血IL-17及CD4+CD25+CD127low T細胞表達情況
2.肺結核患者組外周血CD4+CD25+CD127low調節性T細胞表達情況:肺結核患者組外周血CD4+CD25+CD127low調節性T細胞表達為(6.59±1.73)%,較健康對照組[(4.97±1.60)%]及結核潛伏感染組[(5.00±1.08)%]明顯偏高(F=11.986,P值均<0.0001)。健康對照組與結核潛伏感染組的比較,差異無統計學意義(F=11.986,P=0.937)。肺結核患者組抗結核治療3個月CD4+CD25+CD127low調節性T細胞水平為(8.28±2.04)%,較治療前(6.59±1.73)%明顯增加(F=6.458,P=0.001);治療6個月CD4+CD25+CD127low調節性T細胞為(7.46±1.87)%,與治療前及治療3個月比較差異均無統計學意義(F=6.458,P=0.068和P=0.085),但仍較健康對照組高,差異有統計學意義(t=6.255,P<0.0001)(表2,4)。

表4 各組治療6個月外周血IL-17及CD4+CD25+CD127low T細胞表達情況
討 論
Th17在結核感染中發揮的保護性細胞免疫不容忽視。Th17細胞屬于CD4+T細胞亞群,但是不同于Th1和Th2細胞群。Th17細胞通過產生的IL-17與靶細胞的IL-17受體(IL-17R)結合而發揮相應的功能,可以有效地介導病變組織的炎癥反應[17-19]。研究表明,人體感染結核分枝桿菌后可以誘導抗原特異性Th17細胞反應,并發現與單純結核分枝桿菌暴露者相比,活動性肺結核患者體內Th17細胞減少。并有研究發現結核分枝桿菌非特異性Th17細胞免疫反應也被抑制,而且Th17細胞減少的數量與結核感染嚴重程度呈正比[17]。
同樣,CD4+CD25+調節性T細胞在結核免疫中的作用也很重要。研究發現CD4+CD25+調節性T細胞通過上調表達FoxP3(forkhead box P3)來發揮免疫抑制功能[20],但是FoxP3的檢測操作復雜,需要破細胞核核膜操作,不宜常規進行細胞功能的研究[21]。另有研究表明CD4+CD25+調節性T細胞中低表達CD127,CD4+CD25+CD127low被認為是一種更為理想的調節性T細胞表面分子標志[22]。機體對結核分枝桿菌的免疫主要是T淋巴細胞介導的細胞免疫。肺結核的發生、發展和預后不僅與結核分枝桿菌感染的數量和毒力有關,與宿主的細胞免疫功能也有著密切的關系。CD4+CD25+調節性T細胞能顯著抑制PBMC和CD4+CD25-T細胞對BCG的增殖反應和細胞因子的分泌[20],其通過抑制Th1細胞免疫反應,導致Th1細胞因子如IFN-γ、IL-2分泌的減少,削弱機體免疫系統對結核分枝桿菌的清除能力,使結核分枝桿菌感染慢性化。同時CD4+CD25+調節性T細胞也可抑制過強的Th1細胞免疫反應,從而避免機體的免疫病理損害[23]。
本研究通過對45名健康對照者、25例結核潛伏感染者、32例肺結核患者及其結核治療隨訪過程的外周血標本檢測發現,肺結核患者組外周血非特異性Th17細胞因子IL-17的表達較健康對照組及結核潛伏感染組明顯降低,說明結核分枝桿菌感染后,機體Th17細胞應答明顯受到抑制,不能產生有效的保護性免疫反應。經治療后,結核病患者外周血IL-17明顯升高,并較健康對照組高。32例肺結核患者治療3個月抗酸染色涂片及痰結核分枝桿菌培養均陰性,治療6個月X線胸片結核病灶均表現為明顯吸收,其中3例患者胸部X線片表現為完全吸收,IL-17的表達與32例患者臨床轉歸表現出良好地一致性(因為本實驗沒有做患者轉歸的CT評分,僅僅用X胸片及痰抗酸染色涂片及痰結核分枝桿菌培養結果來表達轉歸情況,所以就沒有在結果中用表格再次表達出來,僅在此處提及)。
本研究中,肺結核患者組CD4+CD25+CD127low調節性T細胞表達明顯高于健康對照組及結核潛伏感染組,雖然CD4+CD25+CD127low調節性T細胞在治療3個月仍有進一步升高,可能由于短期抗結核治療后大量結核分枝桿菌釋放而刺激機體免疫系統所產生免疫抑制現象,但隨著有效的抗結核治療的進行,機體免疫系統功能逐漸恢復,6個月后,CD4+CD25+CD127low調節性T細胞較治療3個月呈下降趨勢,雖然尚未下降至健康者水平,但通過對本研究入組結核病患者CD3、CD4、CD8細胞的隨訪發現,雖然結核病患者治療過程中CD3、CD4、CD8陽性細胞均有不同程度升高,但并未升至正常水平。CD4+CD25+CD127low調節性T細胞通過上調表達FoxP3來發揮免疫抑制功能,而Th17細胞通過分泌細胞因子IL-17A和IL-17F而發揮顯著促炎癥作用。關于Th17抑制與CD4+CD25+CD127low調節性T細胞之間的關系,目前認為兩者互為拮抗,在Th17及CD4+CD25+CD127low調節性T細胞的分化過程均要通過轉化生長因子-β(transforming growth factor-β,TGF-β),另 外 CD4+CD25+CD127low調節性T細胞表達的轉錄因子FoxP3通過直接與視黃酸相關的孤兒核受體(retinoic acid-related orphan receptor gamma t,RORγt)結合而抑制RORγt介導 IL-17AmRNA 的轉錄,從 而 影 響Th17細胞的功能[24]。筆者也通過隨訪也發現增高的CD4+CD25+調節性T細胞與Th17抑制相一致,符合目前文獻報道。
綜上所述,抗結核治療過程中Th17的升高伴CD4+CD25+CD127low調節性T細胞下降,說明兩者在結核免疫中均發揮重要作用,提示兩者可作為今后抗結核治療療效考核的依據。
[1]Sakaguchi S,Sakaguchi N,Asano M,et al.Immunologic selftolerance maintained by activated T cells expressing IL-2receptor alpha-chains(CD25).Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases.J Immunol,1995,155(3):1151-1164.
[2]Belkaid Y,Rouse BT.Natural regulatory T cells in infectious disease.Nat Immunol,2005,6(4):353-360.
[3]Sasada T,Kimura M,Yoshida Y,et al.CD4+CD25+regulatory T cells in patients with gastrointestinal malignancies:possible involvement of regulatory T cells in disease progression.Cancer,2003,98(5):1089-1099.
[4]Wolf D,Wolf AM,Rumpold H,et al.The expression of the regulatory T cell-specific forkhead box transcription factor FoxP3is associated with poor prognosis in ovarian cancer.Clin Cancer Ras,2005,11(23):8326-8331.
[5]Dannull J,Su Z,Rizzieri D,et al.Enhancement of vaccine-mediated antitumor immunity in cancer patients after depletion of regulatory T cells.J Clin Invest,2005,115(12):3623-3633.
[6]陳心春,周伯平,鄧群益,等.CD4+CD25+調節性T細胞對肺結核患者特異細胞免疫的調節作用.中國防癆雜志,2008,30(3):165-169.
[7]Dong C.Differentiation and function of pro-inflammatory Th17 cells.Microbes Infect,2009,11(5):584-588.
[8]Kotake S,Udagawa N,Takahashi N,et al.IL-17in synovial fluids from patients with rheumatoid arthritis is a potent stimulator of osteoclastogenesis.J Clin Invest,1999,103(9):1345-1352.
[9]Fujimoto M,Serada S,Mihara M,et al.Interleukin-6blockade suppresses autoimmune arthritis in mice by the inhibition of inflammatory Th17responses.Arthritis Rheum,2008,58(12):3710-3719.
[10]Wilson NJ,Boniface K,Chan JR,et al.Development,cytokine profile and function of human interleukin 17-producing helper T cells.Nat Immunol,2007,8(9):950-957.
[11]Pitta MG,Romano A,Cabantous S,et al.IL-17and IL-22are associated with protection against human kala azar caused by Leishmania donovani.J Clin Invest,2009,119(8):2379-2387.
[12]Acosta-Rodriguez EV,Rivino L,Geginat J,et al.Surface phenotype and antigenic specificity of human interleukin 17-producing T helper memory cells.Nat Immunol,2007,8(6):639-646.
[13]Khader SA,Bell GK,Pearl JE,et al.IL-23and IL-17in the establishment of protective pulmonary CD4+T cell responses after vaccination and duringMycobacterium tuberculosischallenge.Nat Immunol,2007,8(4):369-377.
[14]Chen X,Zhang M,Zhu X,et al.Engagement of Toll-like receptor 2on CD4+T cells facilitates local immune responses in patients with tuberculous pleurisy.J Infect Dis,2009,200(3):399-408.
[15]Paidipally P,Periasamy S,Barnes PF,et al.NKG2D-dependent IL-17production by human T cells in response to an intracellular pathogen.J Immunol,2009,183(3):1940-1945.
[16]Scriba TJ,Kalsdorf B,Abrahams DA,et al.Distinct,specific IL-17and IL-22producing CD4+T cell subsets contribute to the human anti-mycobacterial immune response.J Immunol,2008,180(3):1962-1970.
[17]Chen X,Zhang M,Liao M,et al.Reduced Th17response in patients with tuberculosis correlates with IL-6Rexpression on CD4+T Cells.Am J Respir Crit Care Med,2010,181(7):734-742.
[18]Wang T,Lv M,Qian Q,et al.Increased frequencies of T helper type 17cells in tuberculous pleural effusion.Tuberculosis(Edinb),2011,91(3):231-237.
[19]Bettelli E,Korn T,Kuchroo VK.Th17:the third member of the effector T cell trilogy.Curr Opin Irnmtmol,2007,19(6):652-657.
[20]Chen X,Zhou B,Li M.CD4(+)CD25(+)FoxP3(+)regulatory T cells suppressMycobacterium tuberculosisimmunity in patients with active disease.Clin Immunol,2007,123(1):50-59.
[21]孫晨鳴,馬海霞,劉光偉,等.CD127與T淋巴細胞.中國生物工程雜志,2007,27(5):113-119.
[22]Liu W,Putnam AL,Xu-Yu Z,et al.CD127expression inversely correlates with FoxP3and suppressive function of human CD4+Treg cells.J Exp Med,2006,203(7):1701-1711.
[23]Guyot-Revol V,Innes JA,Hackforth S,et al.Regulatory T cells are expanded in blood and disease sites in patients with tuberculosis.Am J Respir Crit Care Med,2006,173(7):803-810.
[24]Ichiyama K,Yoshida H,Wakabayashi Y,et al.Foxp3inhibits RORgammat-mediated IL-17AmRNA transcription through direct interaction with RORgammat.J Biol Chem,2008,283(25):17003-17008.

