梓醇對異丙腎上腺素誘導的大鼠心肌損傷的保護作用及機制研究
畢方杰,張虎,胡健
(1.山東省淄博市中心醫院心血管內科,山東 淄博 255000;2.佳木斯大學,黑龍江 佳木斯 154000;3.中國醫科大學附屬第一醫院心血管內科,沈陽 110001)
近年來,心血管疾病的發病率和致殘致死率在全世界范圍內呈明顯上升趨勢,雖然藥物治療與介入治療是目前主要治療手段,但均存在一定不足。因此篩選新的抗心肌缺血藥物和探索抗心肌缺血機制仍是一項重要的研究課題。梓醇作為地黃中的主要有效成份,屬于環烯醚萜單糖類。研究表明梓醇具有多種生物學活性,如抗炎、抗氧化、抗凋亡等多種生物學效應。目前研究主要集中在梓醇抗腦細胞凋亡,改善氧化應激對神經系統損傷。本課題組的前期研究發現,梓醇在細胞水平對臍靜脈內皮細胞及心肌細胞也有保護作用[1],另有研究表明梓醇可明顯改善心功能不全。因此我們有理由進一步研究梓醇的心肌保護作用,從而為進一步研發新的有效治療心血管疾病的天然藥物提供實驗基礎和理論依據。
1 材料與方法
1.1 動物模型:
健康SPF級雄性Wistar大鼠48只,體質量180~200 g。適應性飼養1周后,參照文獻提供方法制作心肌損傷模型[1],采用異丙腎上腺素(每次85 mg/kg)連續皮下注射2次(間隔24 h)的方法成功建立心肌損傷模型。
1.2 材料及試劑
梓醇及丹參酮ⅡA均購自中國藥品生物制品檢定所,異丙腎上腺素購于Sigma公司,CK-MB及LDH試劑盒購于南京建成生物制品公司,所有一抗及二抗均購于Santa Cruz公司。
1.3 實驗分組
將48只Wistar大鼠分為6組,每組8只,分別是:(1)正常對照組(Control組);(2)模型組(Model組);(3)陽性對照組(TanshinoneⅡA 組);(4)低劑量梓醇組(Catalpol-L 組 2.5 mg/kg);(5)中劑量梓醇組(Catalpol-M 組 5 mg/kg);(6) 高 劑 量 梓 醇 組(Catalpol-H 組 10mg/kg),梓醇劑量參照相關文獻[2]。所有治療組均用藥10 d,第9 d,10 d連續在用藥0.5 h后皮下給予異丙腎上腺素(每次85 mg/kg)。
1.4 心肌組織標本的留取及檢測
最后1次用藥結束24 h后,麻醉后頸動脈取血,分離血清后,保存于冰箱內,24 h內用自動生化分析儀檢測CK-MB及LDH的含量。取血后立即處死大鼠取出心臟,沿冠狀溝走行分離左心室心肌,每組取4個標本置于10%中性甲醛中固定24 h,石蠟包埋行HE染色,損傷分級及免疫組化檢測。
1.5 HE染色
將固定好的心肌組織常規石蠟包埋,Leica石蠟切片機連續切片,厚度約5 μm,HE程序染色,Olympus顯微鏡觀察病理改變。
1.6 免疫組化
按博士德公司SABC免疫組化染色試劑盒使用說明書進行操作,用0.01mol/L枸櫞酸鹽緩沖液進行熱抗原修復,DAB顯色液顯色,陰性對照以PBS代替一抗。TNF-α和IL-1β陽性細胞表現為細胞漿內有黃色或棕黃顆粒沉積,陰性對照沒有黃色顆粒沉積。在400倍高倍視野下,每張切片隨機選取5個無重疊圖像,應用NIS Elements F2.30圖像采集軟件進行圖像采集,Image pro-plus圖像分析軟件計算平均光密度(mean optical density,MOD)。
1.7 統計學分析
采用SPSS 10.0統計軟件對數據進行分析,各組實驗數據以±s表示,多組間比較采用方差分析,以P<0.05為有統計學意義,以P<0.01為有顯著性統計學意義。
2 結果
2.1 梓醇對各組大鼠生化指標的影響
我們首先檢測反映心肌損傷的血清CK-MB及LDH變化,結果顯示:Model組明顯高于Control組(P<0.01)。不同劑量梓醇[(2.5~10)mg/kg]預處理后,血清LDH及CK-MB的活性下降(P<0.01),提示catalpol對ISO誘導的心肌損傷有保護作用。見表1。
表1 各組大鼠血清CK-MB和LDH的表達(±s)Tab.1 ExpressionsofserumCK-MBandLDHinallgroups(±s)
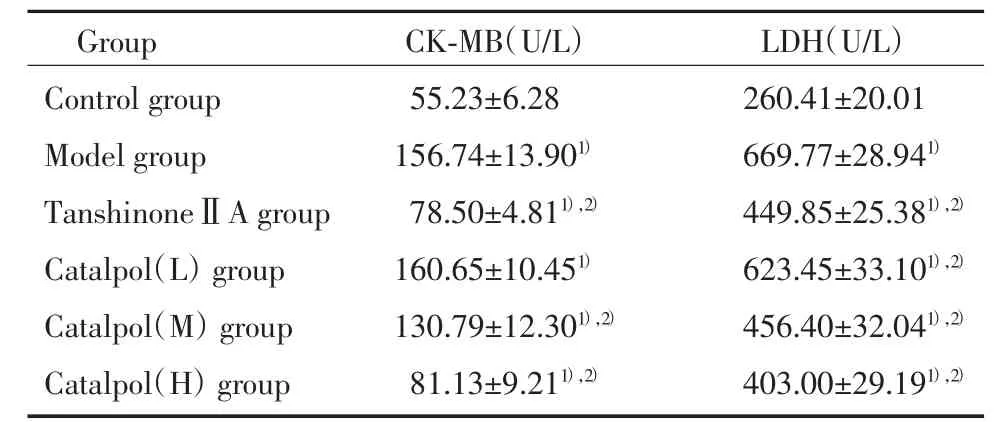
表1 各組大鼠血清CK-MB和LDH的表達(±s)Tab.1 ExpressionsofserumCK-MBandLDHinallgroups(±s)
1)P<0.01 vs control group;2)P<0.01 vs model group.
Group CK-MB(U/L) LDH(U/L)Control group 55.23±6.28 260.41±20.01 Model group 156.74±13.901) 669.77±28.941)TanshinoneⅡA group 78.50±4.811),2) 449.85±25.381),2)Catalpol(L)group160.65±10.451)623.45±33.101),2)Catalpol(M)group130.79±12.301),2)456.40±32.041),2)Catalpol(H)group81.13±9.211),2)403.00±29.191),2)
2.2 梓醇對各組大鼠心肌病理改變的影響
結果顯示:Control組:心肌細胞形態正常,未見明顯變性、壞死及炎性細胞浸潤。心肌細胞核呈圓形或橢圓形,居細胞中央,心肌間質結構正常,無壞死灶。Model組:有明顯的心肌缺血壞死變化,心肌細胞出現片狀、局灶性壞死,部分心肌保持正常。心肌細胞核變形、聚集、排列紊亂,心肌間質增寬并部分出現炎性細胞浸潤,心肌纖維多處腫脹斷裂,肌橫紋消失,局部可見空泡樣變性。TanshinoneⅡA組及3種劑量Catalpol組:部分心肌缺血壞死變化,壞死灶呈點狀,小片狀分布,心肌間質部分仍有炎性細胞浸潤,心肌病理改變程度和面積較模型組要小,炎癥細胞浸潤程度減輕,見圖1。
2.3 各組大鼠心肌損傷分級
根據Rona提供的心肌損傷分級標準將各組大鼠心肌分為Grade 0-GradeⅣ5個級別。結果顯示:Catalpol(L)組及Catalpol(M)組心肌損傷程度均較Model組減輕,但是Catalpol(H)組心肌損傷程度減輕最為顯著,差異有統計學意義。見表2。
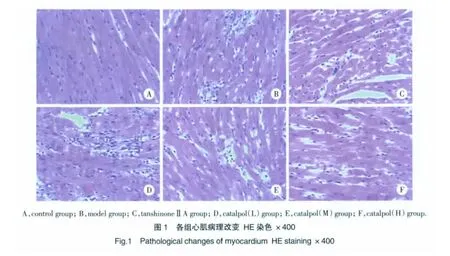
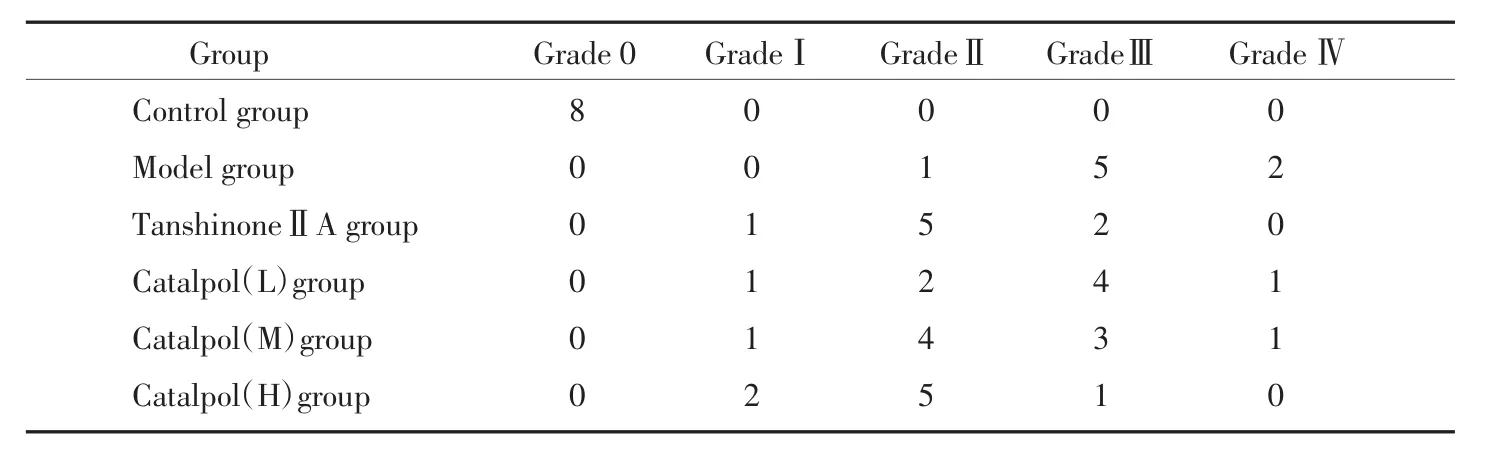
表2 各組心肌病理損傷分級Tab.2 The pathological grades of myocardium
2.4 免疫組化檢測各組大鼠心肌TNF-α蛋白的表達
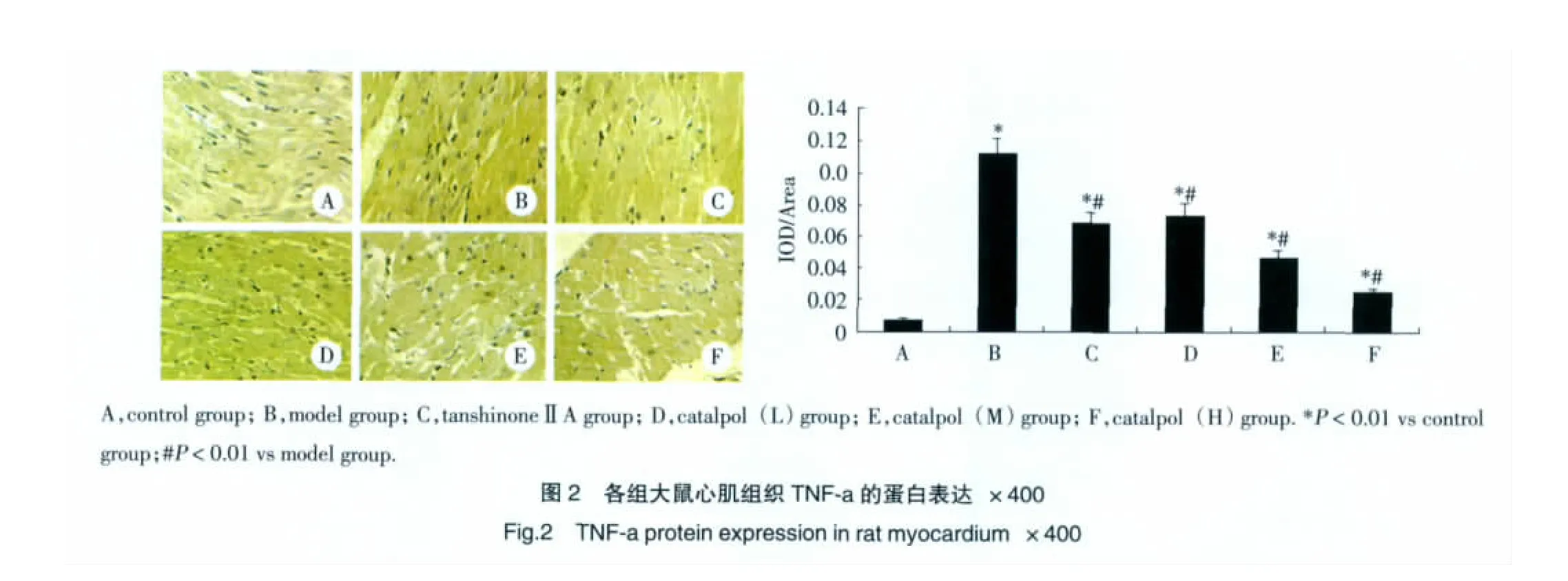
免疫組化結果顯示TNF-α蛋白陽性染色信號呈黃色,主要位于心肌細胞胞漿,Control組有少量表達,Model組較Control組明顯增多(P<0.01)。與Model組比較,TanshinoneⅡA 組、Catalpol(L) 組、Catalpol(M)組和Catalpol(H)組TNF-α蛋白表達減少(P<0.01)。見圖 2。
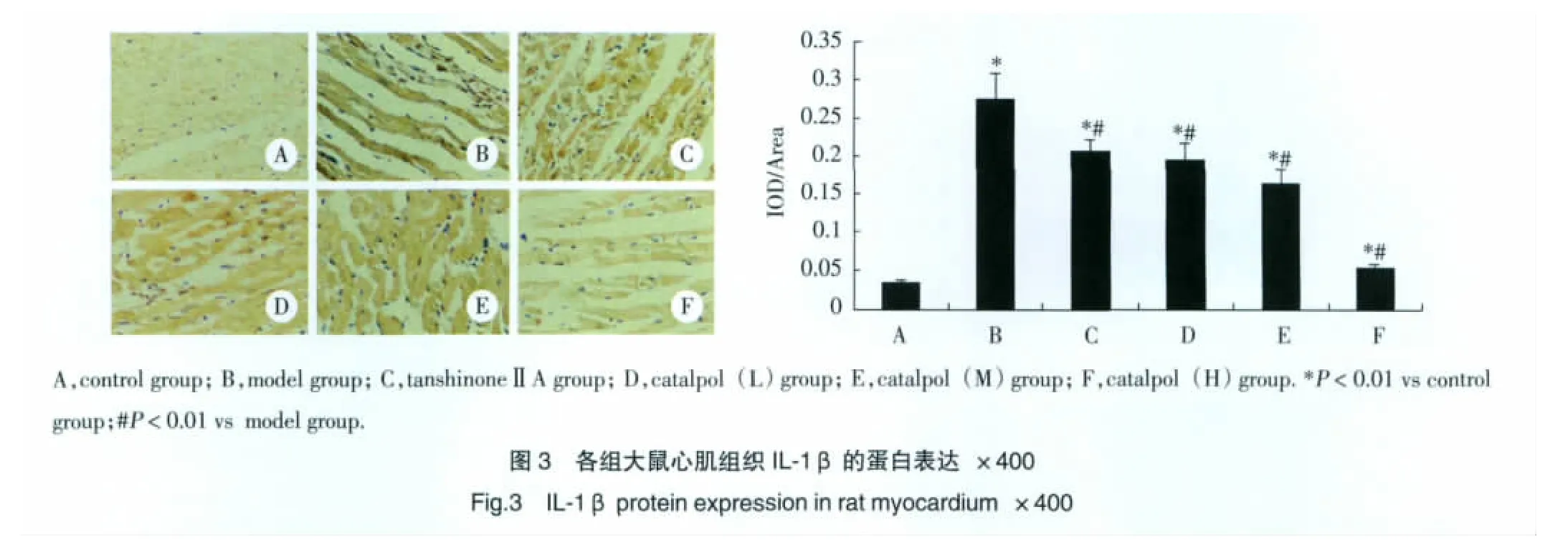
2.5 免疫組化檢測各組大鼠心肌IL-1β蛋白的表達
免疫組化結果顯示IL-1β蛋白陽性染色信號呈棕黃色,主要位于心肌細胞胞漿,與Control組比較,Model組表達明顯增多(P<0.01),見圖 3。經catalpol預干預后,IL-1β蛋白表達減少(P<0.01),差異有統計學意義,以Catalpol(H)組最顯著。
3 討論
梓醇屬于環烯醚萜單糖類,是地黃中起主要藥理作用的單體。相關研究已發現梓醇具有抗凋亡[3,4]、降糖[5]、抗炎[6,7]、抗氧化應激[8,9]等多種生物學活性,其中梓醇對神經系統的保護作用研究最為廣泛。目前梓醇對于心血管系統的保護作用的研究處于起步階段,本課題組的前期研究發現:梓醇通過抗氧化對阿霉素誘導的心肌細胞損害有明顯的保護作用[1]。在本實驗中我們進一步研究梓醇的心肌保護作用,并探討相關作用機制。
異丙腎上腺素是一種β受體激動劑,大劑量皮下注射可引起明顯的心肌損傷[1,2],目前已經廣泛應用于心肌損傷的藥物試驗中。雖然其致心肌損傷的作用機制尚未完全明了,但是相關研究提示:氧化應激[10]、炎癥反應[11]及細胞凋亡[12]可能是主要原因。LDH是一種糖酵解酶,在全身各器官均有分布,LDH質與量的改變,直接影響機體的能量代謝,在心肌細胞中分布尤其豐富,正常情況下,此酶不會從細胞中釋放,但是當心肌細胞受損時,LDH大量釋放入血,因此血液中LDH的變化是反應心肌受損的一項重要指標。CK-MB是CK的一種同工酶,主要存在于心肌細胞的胞漿和線粒體中,它能催化肌酸和ATP之間高能磷酸鍵轉換生成磷酸肌酸和ADP的可逆反應,為肌肉收縮提供能量。由于CK-MB特異性較高,故其活性增加被認為是心肌細胞損傷最敏感的指標之一,與心肌壞死程度呈正相關。在本研究中發現,當用異丙腎上腺素作用于大鼠機體后,血清CK-MB和LDH都明顯升高,表明皮下注射異丙腎上腺素可成功誘導心肌損傷動物模型。不同劑量梓醇預干預可明顯降低血清CK-MB和LDH的活性(P<0.01),提示梓醇對ISO誘導的心肌損傷有明顯的保護作用。
各組大鼠心肌HE染色結果顯示:在異丙腎上腺素作用下的大鼠中,心肌損傷明顯,心肌細胞核變形、聚集、排列紊亂,心肌間質增寬并部分出現炎性細胞浸潤,心肌纖維多處腫脹斷裂,肌橫紋消失,進一步證明異丙腎上腺素誘導的心肌損傷模型是成功的。應用梓醇后,尤其是中劑量和大劑量梓醇可以使壞死面積明顯減少,炎性細胞浸潤程度明顯減輕,這一變化趨勢也在各組大鼠損傷分級比較中得到體現,上述結果均提示:梓醇對異丙腎上腺素誘導的心肌損傷有保護作用。
炎性細胞因子是機體出現炎癥反應的標志,可進一步引起中性粒細胞與血管內皮細胞的粘附、遷移以及最終在心肌組織的積聚,釋放溶酶體酶,損傷心肌細胞。在本實驗中我們發現異丙腎上腺素作用于大鼠后,大鼠心肌有明顯的炎性細胞的滲出和間質水腫,提示我們炎癥在異丙腎上腺素的心肌損傷中發揮重要作用TNF-α和IL-1β是誘導炎性細胞滲出的重要因子,他們可以在多種細胞因子的刺激下由多種細胞分泌[13],有相關研究表明,在人體心臟損傷時,上述兩種炎癥因子明顯升高[14]。另有實驗發現[15,16]阻止 TNF-α 和 IL-1β 的表達可以明顯改善梗死心肌的心功能,因此抑制炎癥反應是保護心肌損傷的一種有效方法。以往的研究發現,梓醇可以抑制脂多糖(LPS)引起的小膠質細胞的激活,限制小膠質細胞產生反應性氧自由基(ROS)和一氧化氮(NO),降低誘導型一氧化氮合成酶(iNOS)的表達[17],表明梓醇在LPS介導的炎癥損傷中起到抑制小膠質細胞的活化和炎癥因子產生的作用。在Aβ1-42損傷的小鼠大腦皮層神經-膠質混合細胞培養體系中,梓醇一方面直接保護神經元免受神經毒性損傷,另一方面通過抑制小膠質和星型膠質細胞活化及炎癥因子TNF-α的過量表達,間接保護神經元,通過抗炎發揮神經保護作用[18]。因此為了進一步探討梓醇對心肌損傷的保護機制,我們從炎癥角度檢測了心肌組織TNF-α和IL-1β蛋白的表達。結果發現:在異丙腎上腺素處理組的大鼠心肌上述兩種因子表達明顯升高,而梓醇預處理后,尤其在中劑量和高劑量梓醇組,上述兩種因子的表達明顯減少,提示梓醇通過抑制炎癥因子的表達實現保護心肌的作用。
總之,本實驗表明梓醇可以阻止異丙腎上腺素誘導的心肌損傷,這種保護作用可能是通過抑制炎癥反應來實現的,此結果將為篩選具有心肌保護作用的中藥單體提供更多實驗依據及理論依據。
[1]Xing W,Yanbin M.Effect of catalpol on doxorubicin-induced cytotoxicity in H9c2 cells[J].J Med Plants Res,2012,6(5):849-854.
[2]XiuliZ,WeidongL,XinhuaN,etal.Systemicadministrationofcatalpol prevents d-galactose induced mitochondrial dysfunction in mice[J].Neurosci Lett,2010,473(3):224-228.
[3]Dan L,Yong B,Yang L,et al.Catalpol modulates the expressions of Bcl-2 and Bax and attenuates apoptosis in gerbils after ischemic injury[J].Brain Res,2006,1115(1):179-185.
[4]Lingai H,Yukun S,Jian H.Catalpol inhibits apoptosis in hydrogen peroxide-induced endothelium by activating the PI3K/Akt signaling pathway and modulating expression of Bcl-2 and Bax[J].Eur J Pharmacol,2010,628(1-3):155-163.
[5]趙素容,盧兗偉,陳金龍,等.地黃梓醇降糖作用的實驗研究[J].時珍國醫國藥雜志,2009,20(1):171-172.
[6]YuanY T,Li JA,Lan J,et al.Catalpol protects dopaminergic neurons from LPS-induced neurotoxicity in mesencephalic neuron-glia cultures[J].Life Sci,2006,80(3):193-199.
[7]Aihong Z,Shuang H,Jing B,et al,Effects of catalpol on mitochondrial function and working memory in miceafter lipopolysaccharide-induced acute systemic inflammation[J].Exp Toxicol Pathol,2009,61(5):461-469.
[8]Yu R M,Lan J,Yan LD,et al,Efficacy of catalpol as protectant against oxidative stress and mitochondrial dysfunction on rotenone-induced toxicity in mice brain[J].Exp Toxicol Pathol,2007,23(3):314-318.
[9]Xiu LZ,Bo J,Zhi BL,et al.Catalpol ameliorates cognition deficits and attenuates oxidative damage in the brain of senescent mice induced by D-galactose[J].Pharmacol Biochem Be,2007,88(1):64-72.
[10]Zhang GX,Kimura S,Nishiyama A,et al.Cardiac oxidative stress in acuteandchronicisoproterenol-infusedrats[J].CardiovascRes,2005,65(1):230-238.
[11] Murray DR,Prabhu SD,Chandrasekar B.Chronicβ-Adrenergic stimulation induces myocardial proinflammatory cytokine expression[J].Circulation,2000,101(20):2338-2341.
[12]Shizukuda Y,Buttrick PM,Greenen DL,et al.β-Adrenergic stimulation causes cardiocyte apoptosis:influence of tachycardia and hypertrophy[J].Am J Physiol Heart Circ Physiol,1998,275(3Pt2):961-968.
[13]FanH,WilliamsDL,ZingarelliB.Differentialregulationof lipopolysaccharide and Gram-positive bacteria induced cytokine and chemokine production in macrophages by Galpha (i)proteins[J].Immunology,2007,122(1):116-123.
[14]Ono K,Matsumori A,Shioi T.Cytokine gene expression after myocardial infarction in rat hearts.Possible implication in left ventricular remodeling[J].Circulation,1998,98(2):149-156.
[15]Turner NA,Mughal RS,Warburton P.Mechanism of TNF alpha-induced IL-1alpha,IL-1beta and IL-6 expression in human cardiac fibroblasts:effectsofstatinsandthiazolidinediones[J].CardiovascRes,2007,76:81-90.
[16]SuzukiJ,OgawaM,MaejimaY,etal.Tea catechins attenuate chronic ventricular remodeling after myocardial ischemia in rats[J].J Mol Cell Cardiol,2007,42(2):432-440.
[17]Tian YY,An LJ,Jiang L,et al.Catalpol protects ddopaminergic neurons from LPS-induced neurotoxicity in mesencephalic nuron-glia cultures[J].Life Sci,2006,80(3):193-199.
[18]Jiang B,Du J,Liu JH,et al.Catalpol attenuates the neurotoxicity induced by β-amyloid1-42 in cortical neuron-glia cultures[J].Brain Res,2008,1188:139-147.

