一線化療前后血紅蛋白水平變化對晚期胃癌患者的生存及化療療效的預測意義
王妍,劉云鵬,曲秀娟,趙明芳,金波,鄭爽,羅旭,王瑾,陳穎,李馨
(1.中國醫科大學附屬第一醫院腫瘤內科,沈陽 110001;2.遼寧省人民醫院腫瘤內科,沈陽 110016;3.鞍山市第四醫院腫瘤內科,遼寧鞍山 114036)
盡管胃癌的發病率逐年下降,但胃癌導致的死亡率仍居我國腫瘤相關死亡第二位,居消化系統惡性腫瘤首位[1]。多數胃癌確診時已為晚期,難以切除,5年總生存率低于30%。目前,氟尿嘧啶、紫杉類和順鉑等藥物對晚期胃癌有確定的療效,但以氟尿嘧啶為基礎的聯合化療方案的反應率僅為30%~50%,而紫杉醇的反應率為 40%~60%[2,3]。大部分患者不僅不能從上述藥物治療中獲益,反而承受了諸多的藥物不良反應,生活質量降低。近年來研究證實,有效的療效預測指標將會使患者避免不必要的治療。但是晚期胃癌的治療尚無有效的療效預測指標,亟需開展深入的研究。貧血在晚期胃癌患者中較常見,諸多因素可導致晚期胃癌患者貧血,包括腫瘤出血、攝入不足、食欲減退、長時間患病消耗等。有研究表明,宮頸癌和頭頸部癌患者貧血可能導致患者對治療的反應率和生存率下降[4]。但是晚期胃癌患者貧血狀態是否能夠預測化療的療效,尚未有明確報道。因此,本研究擬深入探討一線化療前后血紅蛋白水平的變化與晚期胃癌患者生存及化療療效之間的關系。
1 材料與方法
1.1 患者
選擇2005年1月至2011年12月于我院住院的晚期胃癌患者84例。滿足以下條件的患者納入評價:(1)經病理確診為胃癌;(2)腫瘤無法切除或術后復發轉移的晚期胃癌患者;(3)既往未接受過化療或術后輔助化療結束后復發轉移,距末次化療超過6 個月;(4)接受至少 2 個周期的化療;(5)化療前及化療2個周期后接受了血紅蛋白的檢測;(6)美國東部腫瘤協作組(eastern cooperative oncology group,ECOG)評分為 0 或 1;(7)肝、腎功能基本正常,無嚴重、不能控制的內科疾病或急性感染者;(8)無急慢性血液系統疾病、慢性肝臟疾病、慢性腎功能不全。
所有患者接受以氟尿嘧啶為基礎的化療方案。采用RECIST(實體瘤的療效評價標準)1.1版標準評估腫瘤治療反應。化療療效被分為:完全緩解(complete response,CR)、部分緩解(partial response,PR)、穩定(stable disease,SD)和疾病進展(progressive disease,PD)。CR、PR和SD被定義為疾病控制率(disease control rate,DCR)。所有患者均進行了隨訪觀察。
1.2 隨訪
每6周隨訪1次,直至患者死亡。中位隨訪時間為280(58~1 992)d,截至隨訪結束65名患者死亡,14名患者尚存,5名失訪。
1.3 方法
通過病理、CT或骨掃描確診復發或轉移。所有患者接受以氟尿嘧啶為基礎的方案化療2~6個周期,每3周1次。2個周期化療結束后評價療效。化療前1周內及化療2個周期后采集患者晨起空腹血。根據世界衛生組織標準,血紅蛋白值正常范圍女性為(12.0~16.0)g/dL,男性為(13.0~17.0)g/dL。對患者的年齡、性別、分期、病理類型、ECOG評分、患者總生存期(overallsurvival,OS)及血紅蛋白進行回顧分析。OS定義為確診日期至死亡或隨訪結束日期。
1.4 統計學分析
用SPSS 20.0統計軟件包進行統計學分析。連續數據用±s表示。血紅蛋白與臨床病理及療效的關系應用t檢驗,應用Kaplan-Meier對血紅蛋白與生存的關系進行分析。P<0.05為差異有統計學意義。
2 結果
2.1 血紅蛋白與臨床參數的關系
84名患者中,男61人,女23人,平均年齡為57.61(28~79)歲。84名患者化療前血紅蛋白水平為(112.92±21.25)g/L,化療前血紅蛋白值男女比較差異有統計學意義(P<0.05)。化療前血紅蛋白值與其他臨床參數未見相關關系。化療后的血紅蛋白值與臨床參數也無相關性。見表1。對化療前后血紅蛋白值的變化進行分層分析,發現男性患者化療前后血紅蛋白均值分別為(116.77±21.31)g/L 和(110.25±18.01)g/L(P=0.011)、有內臟轉移患者化療前后血紅蛋白均值分別為(115.66±19.05)g/L 和(109.11±17.73)g/L(P=0.012),以及肝轉移的患者化療后血紅蛋白均值分別為(116.40±17.57)g/L 和(110.13±17.64)g/L(P=0.015),差異均有統計學意義,但是化療前后的血紅蛋白變化與其他臨床參數如年齡、ECOG、病理分型、病灶位置和有無腹膜轉移等因素之間無相關性。
2.2 化療前后血紅蛋白變化與化療療效的關系
84名患者中化療前血紅蛋白水平與化療療效不相關。DCR患者71例(84.5%),CR、PR、SD和PD患者分別為0例(0%)、14例(16.9%)、57例(68.7%)和12例(14.4%)。DCR組化療前后血紅蛋白值分別為(111.69±20.94)g/L 和(110.11±16.89)g/L(P=0.432),而PD組化療前后血紅蛋白均值分別為(111.69±20.94)g/L 和(120.17±22.54)g/L(P=0.017),差異有統計學意思。上述結果提示化療前后血紅蛋白變化與療效密切相關(表2)。
2.3 血紅蛋白與預后的關系
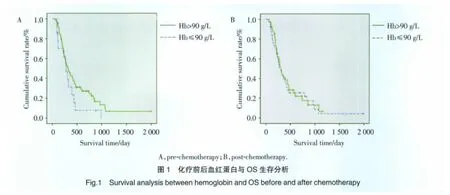
為了評價血紅蛋白是否是預后影響因素,我們分析了血紅蛋白與OS的關系。我們將HB<90 g/L定義為嚴重貧血。以90 g/L作為分界值,患者被分為2組:血紅蛋白≥90 g/L組和血紅蛋白<90 g/L組。結果顯示化療前血紅蛋白大于等于90 g/L組平均生存時間為516 d,而血紅蛋白<90 g/L組的平均生存時間為316 d,血紅蛋白大于90 g/L組有較長的生存趨勢,但2組生存時間的差異沒有統計學意義(P=0.119)。見圖 1。
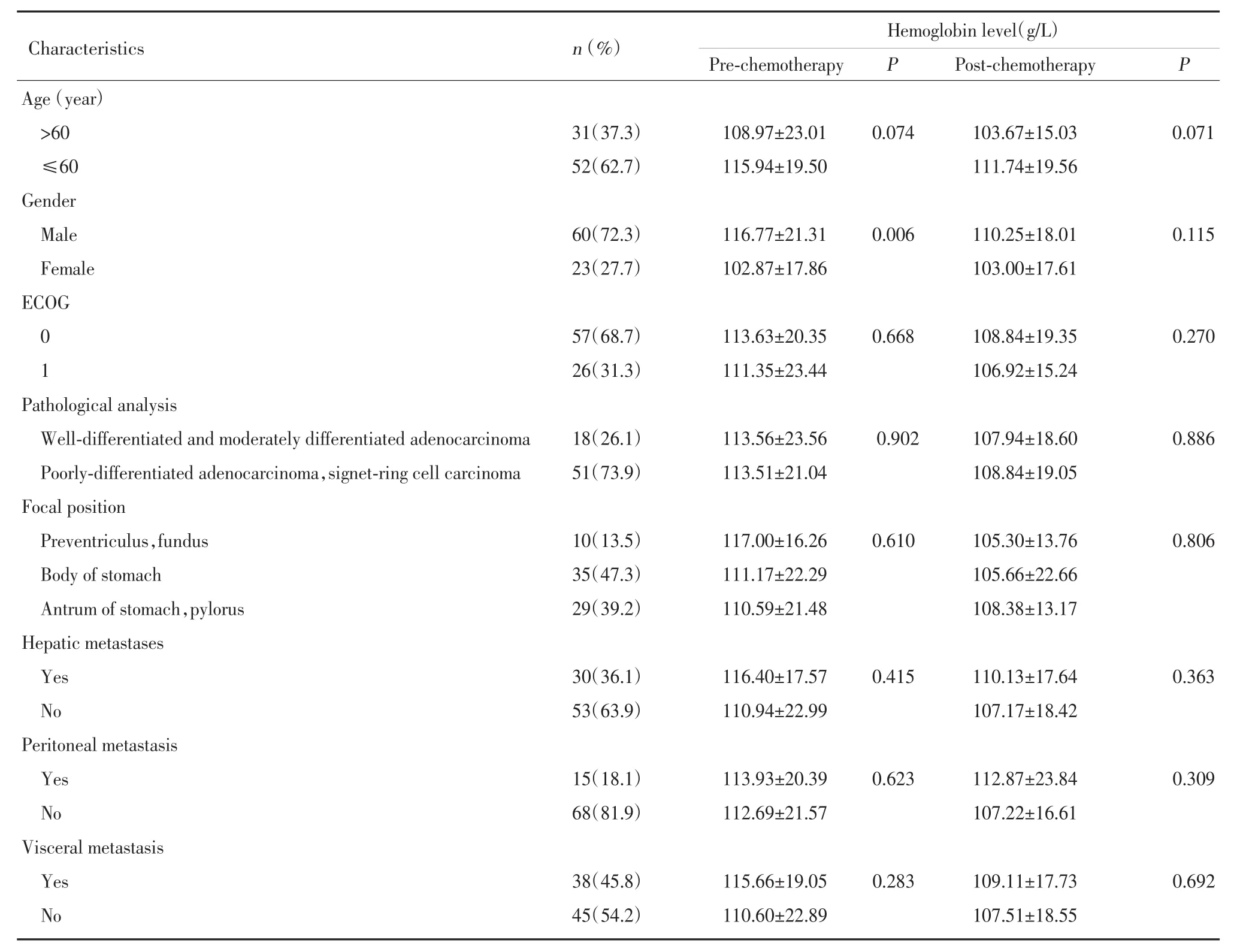
表1 血紅蛋白與臨床參數的關系Tab.1 The relationship between hemoglobin and patients characteristics
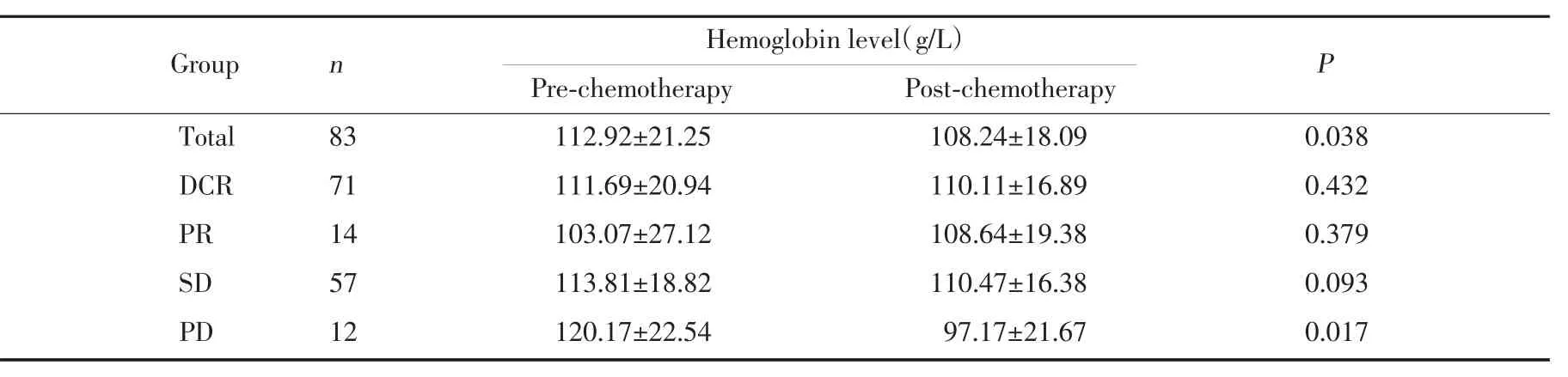
表2 化療前后血紅蛋白變化與化療療效的關系Tab.2 The correlation between chemotherapy-induced alterations of hemoglobin levels and chemotherapy response
3 討論
關于轉移性胃癌的預后因素已經多有報道。一項英國的多中心研究中分析了1 090名既往未接受過化療的一線治療進展期胃癌患者,肝轉移、腹膜轉移以及堿性磷酸酶≥100 U/L被認為是預后不良因素[5]。還有多項研究表明,PS評分降低與患者不良預后有關[5,7,12]。近年來有人證實同源異型框轉錄因子2(CDX)和E鈣黏附素(E-cadherin)在胃癌組織中的表達可能是預測胃癌患者臨床預后的有用標志物[8]。此外,血液細胞的異常也與胃癌的預后密切相關。一項韓國的研究[7]發現,手術前胃癌患者血小板增多是胃癌腫瘤負荷的標志,與疾病進展及復發明顯相關,是預后不良因素。Mohri等[9]發現,中性粒細胞/淋巴細胞的比值升高是胃癌獨立預后不良因素。貧血也是晚期胃癌的常見并發癥,但其是否為預后不良因素目前尚存在分歧。有報道顯示,貧血不是晚期胃癌患者一線化療的預后不良因素[5,6,10],也有實驗證實貧血是胃癌預后的不良因素[11~13]。我們的實驗分析了84名晚期胃癌一線化療患者,化療前貧血的胃癌患者顯示出較差的預后,但無統計學差異,需要進一步擴大樣本量進行分析。關于胃癌患者化療前后的血紅蛋白水平變化與療效之間的關系尚未見報道。我們的結果顯示,化療后PD組血紅蛋白值較化療前明顯降低,差異有統計學意義,提示化療前后血紅蛋白的變化可以預測化療療效。化療后出現貧血的原因可能有出血、化療相關骨髓抑制、免疫性溶血、營養不良以及腫瘤骨髓浸潤。癌細胞可分泌細胞因子導致血清中鐵功能障礙,降低紅細胞生成,同時亦縮短紅細胞壽命。癌細胞可直接導致血紅蛋白降低,進而出現乏力及日常活動減少。
總之,我們的研究發現,晚期胃癌患者血紅蛋白變化與化療療效有關,化療后血紅蛋白降低提示較差的療效。化療前無貧血的胃癌患者顯示出較好的預后。這個結果在今后的臨床研究中有待進一步擴大樣本量進行證實。
[1]張俊玲,王寶玲,李顏玲,等.北京天壇地區惡性腫瘤死亡原因分析[J].首都醫科大學學報,2003,24(3):272-274.
[2]A jani JA,Fodor MB,Tjulandin SA,et al.PhaseⅡ multi-institutional randomized trial of docetaxel plus cisplatin with or without fluorouracil in patients with untreated,advanced gastric,or gastroesophageal adenocarcinoma[J].J Clin Oncol,2005,23(24):5660-5667.
[3]Shah MA,Schwartz GK.Treatment of metastatic esophagus and gastric cancer[J].Semin Oncol,2004,31(4):574-587.
[4]Qiu MZ,Xu RH,Ruan DY,et al.Incidence of anemia,leukocytosis,and thrombocytosis in patients with solid tumors in China [J].Tumour Biol,2010,31(6):633-641.
[5]Chau I,Norman A R,Cunningham D,et al.Multivariate prognostic factor analysis in locally advanced and metastatic esophagogastric cancer-pooled analysis from three multicenter,randomized,controlled trials using individual patient data[J].J Clin Oncol,2004,22(12):2395-2403.
[6]Lee J,Li T,Uhm JE,et al.Prognostic model to predict survival following first-line chemotherapy in patients with metastatic gastric adenocarcinoma[J].A nn Oncol,2007,18(5):886-891.
[7]Hwang SG,Kim KM,Cheong JH,et al.Impact of pretreatment thrombocytosis on blood-borne metastasis and prognosis of gastric cancer[J].Eur J Surg Oncol,2012,38(7):562-567.
[8]葛杰,陳子華,陳志康,等.CDX2和E-鈣粘附素在胃癌組織中的表達及臨床意義[J].南方醫科大學學報,2008,28(2):279-281.
[9]Mohri Y,Tanaka K,Ohi M,et al.Prognostic significance of host-and tumor-related factors in patients with gastric cancer[J].World J Surg,2010,34(2):285-290.
[10]Yoshida M,Ohtsu A,Boku N,et al.Long-term survival and prognostic factors in patients with metastatic gastric cancers treated with chemotherapy in the Japan Clinical Oncology Group(JCOG)study[J].Jpn J Clin Oncol,2004,34(11):654-659.
[11]Kanagavel D,Pokataev IA,Fedyanin MY.Aprognostic model in patients treated for metastatic gastric cancer with second-line chemotherapy[J].A nn Oncol,2010,21(9):1779-1785.
[12]Ji SH,Limdo H,Yi SY.Aretrospective analysis of second-line chemotherapy in patients with advanced gastric cancer[J].BMC Cancer,2009,4(9):110-116.
[13]Park SH,Lee J,Lee SH,et al.A nemia is the strongest prognostic factor for outcomes of 5-fluorouracil-based first-line chemotherapy in patients with advanced gastric cancer[J].Cancer Chemother Pharmacol,2006,57(1):91-96.

