原花青素對高脂血癥模型大鼠脂肪因子及免疫調節的影響
鄒金發 齊鳳杰 董新茜 劉曉光 (遼寧醫學院病理生理學教研室,遼寧 沈陽 121000)
高脂血癥(HLP)是胰島素抵抗(IR)、肥胖癥、糖尿病、心腦血管病等疾病主要的危險因素〔1〕。脂肪組織不僅是體內主要的能量儲存器官,而且是重要的內分泌器官,分泌多種細胞因子和炎癥因子,如瘦素、脂聯素(APN)、抵抗素以及腫瘤壞死因子-α(TNF-α)、白細胞介素-6(IL-6)等,其中 TNF-α 和 IL6 也是重要的免疫調節因子。這些因子均可以影響機體的代謝狀態,從而影響IR的發生發展,而IR與肥胖、2型糖尿病、脂質代謝異常、心血管疾病的發生有密切的關系。原花青素(procyanidin)是一大類多酚類化合物的總稱,具有廣泛的藥理活性,主要表現為抗氧化清除自由基、保護心血管和抗高血壓、抗腫瘤、抗炎癥〔2〕等作用。有研究報道,原花青素具有改善 IR的作用〔3〕。本課題擬探討原花青素對HLP所致肥胖及IR作用的可能機制。
1 材料與方法
1.1 試劑材料及儀器 甘油三酯(TG)、總膽固醇(TC)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)試劑盒購自南京建成生物制品研究所。大鼠血清胰島素、瘦素、APN、抵抗素、TNF-α、IL-6放免試劑盒購自北京博奧森生物制品公司。SD雄性大鼠,SPF級,體重(250±10)g,由醫學實驗動物中心提供。全自動生化分析儀。
1.2 大鼠HLP模型的建立 40只SD雄性大鼠按照隨機數字表法隨機分為對照組(C)、HLP模型組(H)、原花青素高劑量組(HD)、原花青素低劑量組(LD),每組10只。常規飼養1 w后,除對照組給予基礎飼料喂養外,其余三組給予高脂飼料(基礎飼料87.8%,豬油15%,膽固醇2%,膽酸鈉0.2%)。動物室溫度為20℃ ~23℃,相對濕度為40% ~60%,動物置正負壓獨立通風籠具(IVC)喂養,自由飲水與進食,每周稱量體重并記錄進食量。實驗期為6 w。
1.3 給藥方法 大鼠造模的同時,各組分別給予相應藥物灌胃。根據預試結果確定原花青素高、低劑量組的給藥劑量為200、100 mg·kg-1·b-1,對照組給予相應體積的生理鹽水,連續6 w。
1.4 標本處理 大鼠灌藥6 w后,禁食12 h,用10%水合氯醛0.1 ml/100 g麻醉,從腹主動脈取血,裝入抗凝和不抗凝試管中,將不抗凝試管在4℃下3 000 r/min離心10 min,分離血清,待測相應指標。
1.5 指標的測定 采用酶法測定血清 TC、TG、LDL-C和HDL-C水平。血清胰島素、瘦素、APN、抵抗素以及 TNF-α、IL-6水平測定按試劑盒說明書操作。
1.6 統計學方法 應用SPSS18.0統計軟件進行分析,實驗數據以±s表示,多組比較采用單因素方差分析,組間兩兩比較采用SNK法。
2 結果
2.1 原花青素對HLP大鼠體重的影響 實驗期間(灌胃6 w),大鼠的平均體重增長。1~4 w體重無明顯變化,6 w后HLP各組大鼠的體重較對照組明顯增加(P<0.01),而在使用高劑量的原花青素后,大鼠體重較H組減輕(P<0.01)。見表1。
表1 各組大鼠不同時間體重變化(±s,g,n=10)
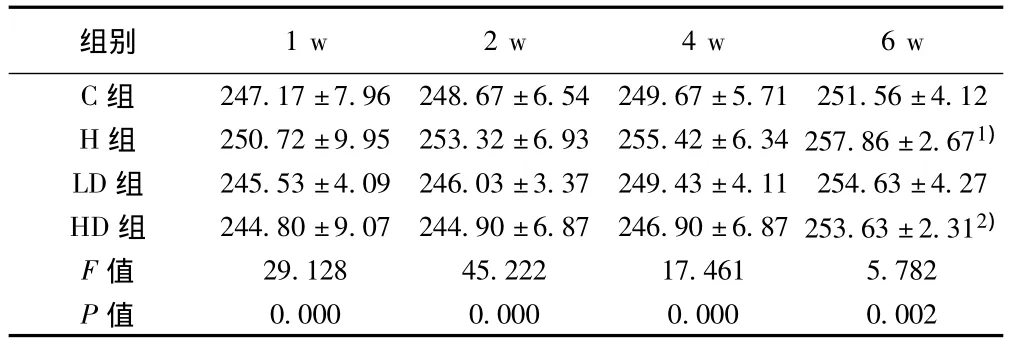
表1 各組大鼠不同時間體重變化(±s,g,n=10)
與C組比較:1)P<0.01;與H組比較:2)P<0.01
組別1 w 2 w 4 w 6 w C組 247.17±7.96 248.67±6.54 249.67±5.71 251.56 0.000 0.000 0.000 0.002±4.12 H組 250.72±9.95 253.32±6.93 255.42±6.34 257.86±2.671)LD組 245.53±4.09 246.03±3.37 249.43±4.11 254.63±4.27 HD組 244.80±9.07 244.90±6.87 246.90±6.87 253.63±2.312)F值 29.128 45.222 17.461 5.782 P值
2.2 原花青素對HLP大鼠血脂的影響 原花青素干預6 w后H組大鼠的血清TC、TG、LDL-C均較C組增高(P<0.01或P<0.05),而HDL-C較對照組降低(P<0.01);原花青素低劑量組、高劑量組 TG、TC、LDL-C水平較 H癥組顯著降低(P<0.01);而低、高劑量組 HDL-C水平較 H組顯著增高(P<0.01)。見表2。
表2 各組大鼠血脂含量(±s,mmol/L,n=10)
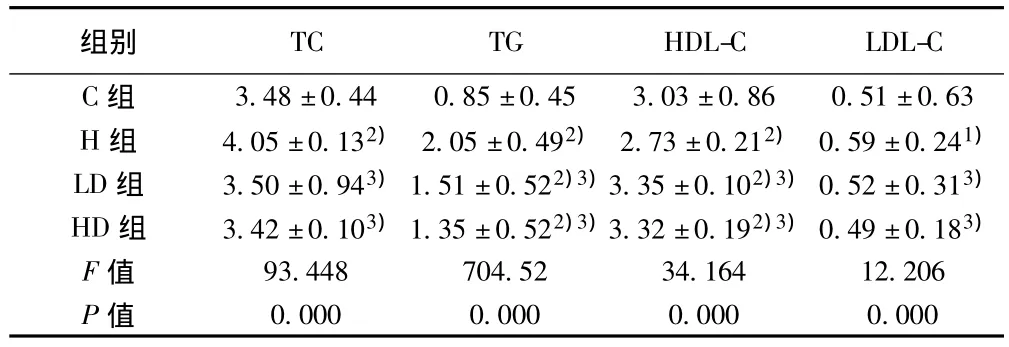
表2 各組大鼠血脂含量(±s,mmol/L,n=10)
與C組比較:1)P<0.05,2)P<0.01;與H組比較:3)P<0.01
組別0.000 0.000 0.000 0.000 3.48±0.44 0.85±0.45 3.03±0.86 0.51±0.63 H組 4.05±0.132) 2.05±0.492) 2.73±0.212) 0.59±0.241)LD組 3.50±0.943)1.51±0.522)3)3.35±0.102)3)0.52±0.313)HD組 3.42±0.103)1.35±0.522)3)3.32±0.192)3)0.49±0.183)F值 93.448 704.52 34.164 12.206 P值TC TG HDL-C LDL-C C組
2.3 原花青素對HLP大鼠血清瘦素、抵抗素、APN及TNF-α、IL-6水平的影響 H組大鼠血胰島素、Leptin、抵抗素水平均較C組顯著增高,而APN水平較C組顯著降低(P<0.01);原花青素干預后,低劑量組、高劑量組的胰島素、Leptin水平較H組降低(P<0.01,P<0.05);低劑量組的抵抗素水平較H組降低,但無統計學意義,高劑量組的抵抗素水平較H組降低(P<0.05);高劑量組的APN水平明顯增高(P<0.01)。H組的血清 TNF-α、IL-6水平均較 C 組顯著增高(P <0.01);給予干預后,低劑量組、高劑量組的血清TNF-α、IL-6水平均較H組顯著降低(P<0.01)。見表3,表4。
表3 各組血清胰島素、瘦素、抵抗素、脂聯素水平(±s,n=10)

表3 各組血清胰島素、瘦素、抵抗素、脂聯素水平(±s,n=10)
與C組比較:1)P<0.01;與H組比較:2)P<0.01,3)P<0.05
組別 胰島素Leptin(ng/ml)抵抗素(μg/L)APN(ng/L)42.13±1.81 0.64±0.33 8.99±0.97 6.00±0.24 H組 93.00±1.751) 1.11±0.601) 12.68±2.191) 5.52±0.301)LD組90.80±1.511)2) 0.81±0.541)3) 10.46±0.151) 5.94±0.51 HD組87.05±1.541)3) 0.76±0.371)3) 10.03±1.072) 6.15±0.223)F值 2 131.052 58.056 837.405 7.908 P值C組0.000 0.000 0.000 0.000
表4 各組血清TNF-α、IL-6水平比較(±s,n=10)

表4 各組血清TNF-α、IL-6水平比較(±s,n=10)
與C組比較:1)P<0.01;與H組比較:2)P<0.01
組別 TNF-α(ng/ml) IL-6(pg/ml)對照組207.448/0.000 23.553/0.000 0.65±0.58 15.02±0.32高脂血癥組 0.91±0.591) 22.06±0.521)低劑量組 0.75±0.461)2) 19.02±0.361)2)高劑量組 0.64±0.502) 17.04±0.361)F/P值
3 討論
HLP是由于脂肪代謝或運轉障礙使TC、TG和(或)LDL-C過高和(或)HDL-C過低而引發的一種病癥。HLP也是肥胖癥和IR等疾病的主要的危險因素。高脂飲食可以使血脂含量增加,誘導HLP的發生。研究表明富含有脂肪的食物使動物飽腹感較差,并且高脂飲食使鼠肌肉解偶聯蛋白3(UCP3)mRNA表達下調,使線粒體氧耗量減少,產熱減少,脂肪量增加,最后導致肥胖〔4〕。
原花青素具有極強的抗氧化活性,是一種很好的自由基清除劑和脂質過氧化抑制劑。本文觀察到原花青素可顯著降低高脂大鼠體重、血清TG、TC和LDL-C水平,并且高劑量組可以顯著提高血清HDL-C水平,與一些研究報道〔5〕相符;并且原花青素干預后,HLP大鼠血清胰島素水平降低。因此,推斷原花青素的降脂作用對肥胖和IR有一定的預防和治療作用。
高脂飲食可以引起脂肪組織增多,促進脂肪組織細胞因子分泌,如瘦素、抵抗素、APN,而后者又調節脂代謝及作用于胰島素信號轉錄及的多個環節而導致IR〔6〕。瘦素來源于脂肪組織〔7〕,是調節脂肪和能量平衡重要的內分泌激素,研究發現大多數肥胖者體內瘦素水平增加,并且與BMI呈正相關〔8〕。瘦素能夠抑制胰島B細胞合成和胰島素的分泌。高脂飲食引起脂肪堆積而使瘦素分泌增加,一方面,在長期高濃度瘦素的刺激下,胰島B細胞的瘦素受體對瘦素不敏感,使瘦素對胰島素合成、分泌的抑制作用下降,導致高胰島素血癥及IR;另一方面,高濃度瘦素可以下調葡萄糖轉運子-4 mRNA和蛋白的表達,抑制葡萄糖攝取,減弱周圍組織對葡萄糖敏感性,從而加重IR〔9〕。因此高水平的瘦素可能導致IR。本實驗觀察原花青素干預后,使HLP大鼠血瘦素水平明顯降低,有利于瘦素正常生理功能的發揮,抑制食欲、減少能量攝入、增加能量消耗和降低體質量,并且調節糖代謝的平衡、促進脂肪分解和抑制脂肪合成、還調節免疫功能。
抵抗素也是由脂肪組織分泌的細胞因子,在機體生理代謝與調節中起重要作用,其在鼠和人類個體中廣泛分布,具有誘導IR及調節炎性反應的作用。研究認為,抵抗素主要作用于脂肪細胞、肝臟、肌肉等胰島素靶器官,抑制靶器官在胰島素刺激下葡萄糖代謝,使周圍組織對胰島素的敏感性降低〔10〕。
APN是目前最明確和重要的一個具有抗IR作用的脂肪細胞因子,參與糖脂的代謝。實驗證明,APN缺乏或APN基因破壞后,介導的胰島素信號轉導減弱,顯示嚴重的IR;當APN分泌恢復正常后,上述現象及IR都可得到逆轉。表明APN能增加胰島素的敏感性〔11〕。本實驗結果表明高脂飲食誘導6 w后大鼠血APN水平明顯降低。進一步的研究表明〔12〕,APN刺激的葡萄糖利用和脂肪酸氧化可能是通過絲裂原活化蛋白激酶(MAPK)信號途徑介導完成而達到抗IR的作用。
TNF-α、IL-6是由多種細胞分泌的一種細胞因子,可介導腫瘤細胞分解、細胞凋亡等,是重要的免疫調節因子,也是炎癥免疫反應的重要介質。有研究顯示,超重和肥胖者血清中IL-6水平增高〔13〕。本實驗顯示TNF-α與其他細胞因子在不同組織中直接或間接的作用引起IR:直接抑制葡萄轉運蛋白4(GLUT4)蛋白的表達〔14〕;抑制脂蛋白脂酶活性,使血清FFA水平升高;誘導β細胞內一氧化氮合酶(NOS)的表達,使β細胞內NOS及一氧化氮(NO)增多(NO增多可抑制胰島素信號和β細胞的功能);促進脂肪組織瘦素的產生及釋放〔15〕。IL-6增加可抑制肝臟產生葡萄糖的能力,導致IR〔16〕;還可與leptin競爭相同的信號傳導通路,導致leptin抵抗,使leptin對胰島素分泌的抑制作用減弱,造成高胰島素血癥及 IR〔17〕;還有研究發現,IL-6增高會引起VLDL、TG增高〔18〕。故IL-6在肥胖和IR的發生發展中具有一定的作用。
本實驗結果顯示原花青素通過直接調節胰島素水平及間接調節血清瘦素、抵抗素、APN、TNF-α和 IL-6水平的作用,在防治高脂血癥誘導肥胖及IR的發生發展中發揮重要作用。
1 Beller GA.Coronary heart disease in the first 30 years of the 21st century:challenges and opportunities:〔J〕.Circulation,2001;103(20):2428-35.
2 袁 敏,韓 莉,裴俊俊.葡萄籽提取物原花青素藥理作用研究進展〔J〕.中藥材,2005;28(7):632-4.
3 沈 琳,高海青,邱 潔,等.葡萄籽原花青素對實驗性動脈粥樣硬化兔基質金屬蛋白酶和氧化低密度脂蛋白的影響〔J〕.中國心血管雜志,2006;11(5):331-3.
4 劉亞莉,劉 莉.高脂飲食誘導的肥胖及肥胖抵抗大鼠血漿抵抗素水平的研究〔J〕.醫學研究雜志,2012;41(5):171-2.
5 張國霞.葡萄籽原花青素對2型糖尿病大鼠血脂的影響〔J〕.中國醫療前沿,2010;5(9):24-5.
6 李 伶,楊剛毅.脂代謝紊亂和脂肪細胞因子與胰島素抵抗〔J〕.中國糖尿病雜志,2007;15(3):129-31.
7 Morris DL,Rui L.Recent advances in understanding leptin signaling and leptin resistance〔J〕.Am J Physiol Endocrinol Metab,2009;297(6):1247-59.
8 Król E,Speakman JR.Regulation of body mass and adiposity in the field vole,Microtus agrestis:a model of leptin resistance〔J〕.J Endocrinol,2007;192(2):271-8.
9 Benomar Y,Naour N,Aubourg A,et al.Insulin and leptin induce Glut4 plasma membrane translocation and glucose uptake in a human neuronal cell line by a phosphatidylinositol 3-kinase-dependent mechanism〔J〕.Endocrinology,2006;147(5):2550-6.
10 劉 曄,王育璠,彭永德.脂肪因子與胰島素抵抗研究進展〔J〕.世界臨床藥物,2011;32(5):266-70.
11 林漢華,盧慧玲.脂肪細胞因子在免疫調節及炎性反應中的作用〔J〕.實用兒科臨床雜志,2009;24(20):1545-8.
12 Rajala MW,Obicis S,Scherer PE,et al.Adipose derived resistin and gut derived resistin-like molecule-beta selectively impair insulin action on glucose production〔J〕.J Clin Invest,2003;111(2):225-30.
13 羅 勇,李小平.超重及肥胖者血清TNF-a、IL-6、CRP水平變化及意義的研究〔J〕.四川醫學,2008;29(6):658-60.
14 Gupta A,Ten S,Anhalt H.Serum levels of soluble tumor necrosis factoralpha receptor 2 are linked to insulin resistance and glucose intolerance in children〔J〕.J Pediatr Endocrinol Metab,2005;18(1):75-82.
15 Trujillo ME,Lee MJ,Sullivan S,et al.Tumor necrosis factor alpha and glucocorticoid synergistically increase leptin production in human adipose tissue:role for p38 mitogen-activated protein kinase〔J〕.J Clin Endocrinol Metab,2006;91(4):1484-90.
16 Kim HJ,Higashimori T,Park SY,et al.Differential effects of interleukin-6 and-10 on skeletal muscle and liver insulin action in vivo〔J〕.Diabetes,2004;53(4):1060-7.
17 Rotter V,Nagaev I,Smith U.Interleukin-6(IL-6)induces insulin resistance in 3T3-L1 adipocytes and is,like IL-8 and tumor necrosis factor-alpha,overexpressed in human fat cells from insulin resistant subjects〔J〕.J Biol Chem,2003;278(46):77-84.
18 Fernández-Real JM,Broch M,Vendrell J,et al.Interleukin-6 gene polymorphism and lipid abnormalities in healthy subjects〔J〕.J Clin Endocrinol Metab,2000;85(3):1334-9.

