小麥黃花葉病毒外殼蛋白基因RNAi表達載體的構建及遺傳轉化
趙曉娟, 劉 艷, 王錫鋒
(中國農業科學院植物保護研究所,植物病蟲害生物學國家重點實驗室,北京 100193)
小麥黃花葉病毒(Wheat yellow mosaic virus ,WYMV)是馬鈴薯Y病毒科(Potyviridae)大麥黃花葉病毒屬(Bymovirus)的成員。小麥黃花葉病最早于1927年由Sawada在日本發現并描述[1],病株上產生褪綠條紋、花葉、矮化、分蘗減少等癥狀[2],由根腫菌綱的禾谷多黏菌(Polymyxa graminis)以持久性方式傳播。此病害自20世紀70年代開始大發生至90年代以來,每年發生面積都超過66萬hm2;2005年僅江蘇省發病面積就高達4.636萬hm2,危害日趨嚴重,已成為危害中國小麥生產的一種重要病毒病害[3]。
RNA沉默這種現象在生物界中普遍存在[4-6]。外源基因隨機整合到宿主細胞產生dsRNA,隨后被酶Dicer-1(CG64792,DCRI)切割生成siRNA[7],siRNA作用于同源mRNA分子發生特異性的降解作用,引起轉錄后水平的基因沉默。siRNA可結合在靶mRNA上,作為引物在依賴RNA的RNA聚合酶(RNA-dependent RNA polymerase,RdRP)的作用下合成新的dsRNA,重復上述過程,使RNAi的作用級聯放大[8-9]。RNAi具有高效性、快速性、特異性、依 賴 ATP 參 與 反 應[10]、傳 播 性[11]、遺 傳性[12-13]等特點。
目前對于WYMV還沒有有效的化學防治藥劑,主要的防治措施是種植抗病品種,但是常規的抗病育種由于抗源材料少和育種周期長而效果欠佳。本研究依照RNAi原理設計了有 WYMV CP介導的RNA干涉的dsRNA前體,構建發夾結構,連接到適合禾本科植物轉化的載體pWMB006上。與含有選擇標記bar基因的載體pAHC20,利用基因槍方法共轉化小麥幼胚愈傷組織,希望獲得剔除共轉化標記基因的抗WYMV小麥植株。
1 材料與方法
1.1 材料
WYMV南京分離物由本實驗室2009年3月采集自江蘇省農業科學院試驗農場,采集的樣品帶回后進行RT-PCR和ELISA檢測確認為WYMV病株。大腸桿菌:JM110;轉基因小麥的受體品種為江蘇里下河農科所的品種‘揚麥12號’。質粒載體:pWMB006、pAHC20,由中國農業科學院作物研究所惠贈。
Taq E、dNTPs、pMD18-T simple vector試劑盒都購自TaKaRa生物技術公司。DNA限制性內切酶、T4DNA連接酶、高保真DNA聚合酶都購自NEB(北京)生物技術有限公司。無內毒素質粒大提試劑盒購自天根生化科技(北京)有限公司。植物凝膠購自Sigma公司。試驗所用的pGEM T-easy載體,購自Promega生物技術公司,感受態細胞DH 5α購自北京全式金生物公司。DNA凝膠回收試劑盒和質粒DNA小量提取試劑盒購自Axygen試劑公司。可裂膜、金粉、阻擋網、載體膜均購自BIORAD(伯樂)公司。
1.2 方法
1.2.1 引物設計
WYMV CP基因序列保守,GC含量較高,適宜作為干擾片段。
依據WYMV的基因組序列(GenBank登錄號:AJ130983),設計擴增CP基因的引物,SEQ No.1:5′GCA GCT GAC ACA CAA AC 3′、SEQ No.2:5′GGT TAG TTC TGG GTG TCC 3′。擴增出的全長CP基因片段預計大小為879bp。
根據pWMB006載體上存在的多克隆位點分析,利用XhoI、NheI可以將目的基因的正向片段連接到載體;而利用SpeI、SacI可以將目的基因的反向片段連接到載體。依照RNAi的機制,設計帶有酶切位點部分CP基因的RNAi引物,正義鏈(酶切位點XhoI、NheI):SEQ No.3:5′CCG CTC GAG ATG CCC TCA TTC CC 3′;SEQ No.4:5′CTA GCT AGC GCA GCT GAC ACA CAA AC 3′。反義鏈(酶切位點SpeI、SacI):SEQ No.5:5′CGA GCT CAT GCC CTC ATT CCC 3′、SEQ No.6:5′GAC TAG TGG TTA GTT CTG GGT GTC C 3′。
1.2.2 干擾載體的構建
首先將pWMB006載體用XhoI、NheI內切酶切成線性片斷,與同樣經XhoI、NheI酶切割目標片段得到正向片斷,用T4連接酶連接到pWMB006載體的正義鏈位點,即形成正義鏈載體pWMB006sCP。然后在正義鏈載體的基礎上繼續構建反義鏈載體,即用SpeI、SacI內切酶分別酶切反向片斷和正義鏈載體,再用T4連接酶兩個線性片段連接到一起,最終構建成干擾載體pWMB006DsCP。同樣的原理,用SpeI、SacI內切酶分別酶切反向片斷和pWMB006載體,用T4連接酶兩個線性片段連接,得到反義鏈載體pWMB006asCP(圖1)。
1.2.3 基因槍法介導的遺傳轉化
采集授粉14d左右的‘揚麥12’小麥幼穗,將其幼胚接種于SD2固體培養基上。26℃恒溫培養箱內,黑暗培養誘導愈傷組織,7d后轉移到0.4mol/L滲透壓培養基(SD2+甘露醇0.2mol/L+山梨醇0.2mol/L)正中央,滲透處理4~6h,以備基因槍轟擊之用。
質粒DNA與共轉化載體pAHC20(圖2)以1∶1的比例混合均勻,制成微彈,用基因槍進行轟擊(射擊參數:距離為6cm,氣壓7584.5kPa)。轟擊后的愈傷組織在原培養基上培養16~18h,轉移到SD2培養基上,恢復培養2周。將愈傷組織轉移到篩選分化培養基(1/2MS+1mg/L NAA+1mg/L KT+2mg/L Bialaphos)上誘導分化。待愈傷組織出現綠芽分化后,將其轉到無激素的1/2MS培養基上。待苗高1~2cm時轉移到移壯苗培養基(1/2MS+0.5mg/L IAA+5mg/L Bialaphos)上壯苗。苗高6~8cm的植株,且根系生長較好時,移入花盆置于溫室培養。
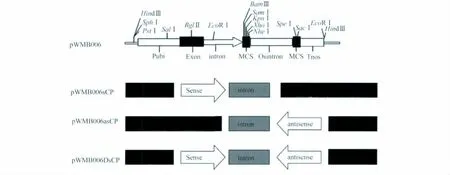
圖1 試驗設計中的4個載體結構示意圖Fig.1 Schematic diagram of the structures of the four vectors designed in this study

圖2 含有選擇標記基因(bar)的共轉化載體pAHC20結構示意圖Fig.2 Schematic diagram of the structure of the cotransformation vector pAHC20with selective marker gene(bar)
1.2.4 T0代轉基因小麥的PCR檢測
基因槍轉化后,經組織培養得到4個載體的轉化植株,每株分別采樣,提取葉片的DNA進行PCR檢測。PCR擴增體系如下:r Taq 0.2μL;10×PCR Buffer 2.5μL;dNTP Mixture(各 2.5mmol/L)2μL;上游引物和下游引物(10μmol/L)各1μL;DNA(10ng/μL)1μL,加ddH2O補足25μL。PCR擴增程序:94 ℃ 3min;(94 ℃ 30s,60 ℃ 30s,72℃45s),35個循環;72℃10min。1.5%瓊脂糖凝膠電泳檢測。
2 結果與分析
2.1 WYMV CP基因正向與反向片段的獲得
從WYMV南京分離物中擴增CP基因,得到的陽性克隆,測序結果與GenBank登錄號為AJ130983的浦江分離物序列相同。以SEQ No.3、SEQ No.4為引物擴增帶有酶切位點的正向片段,以SEQ No.5、SEQ No.6為引物擴增反向片段(圖3)。得到879bp的目標片段,目的片段回收后連到pMD-18T simple載體中。

圖3 RT-PCR擴增得到的CP基因Fig.3 CP gene amplified by RT-PCR
2.2 干擾載體的構建及酶切驗證
將含目的片段的T載體用XhoI、NheI雙酶切,回收得到含XhoI、NheI酶切位點的目的片段,與同樣經XhoI、NheI雙酶切的空載體pWMB006用T4連接酶連接,轉化大腸桿菌中,挑取單克隆進行測序和酶切驗證。得到的陽性克隆經SpeI、SacI雙酶切,用T4連接酶將其與SpeI、SacI酶切的反向片段連接,最終構建成干擾載體pWMB006DsCP。并對干擾載體進行酶切驗證,確認得到了含正反義片段的植物干涉表達載體。
2.3 轉基因再生植株的獲得
以‘揚麥12’的幼胚為受體,進行基因槍轉化。轉化后的愈傷組織進行誘導分化(圖4)、篩選、壯苗得到長勢旺盛的植株(圖5)。待苗高6~8cm,根系生長較好時,移入花盆中,置于溫室培養。

2.4 轉化植株T0代的PCR檢測
本研究獲得了4個載體的轉基因小麥pWMB 006DsCP、pWMB006asCP、pWMB006sCP和 pWMB006的再生植株。PCR鑒定轉基因小麥的T0代結果為:4個載體的T0代轉基因陽性小麥株數分別是15、8、3、5株,相應的轉化率分別是1.00%、0.68%、0.27%、1.46%(表1)。
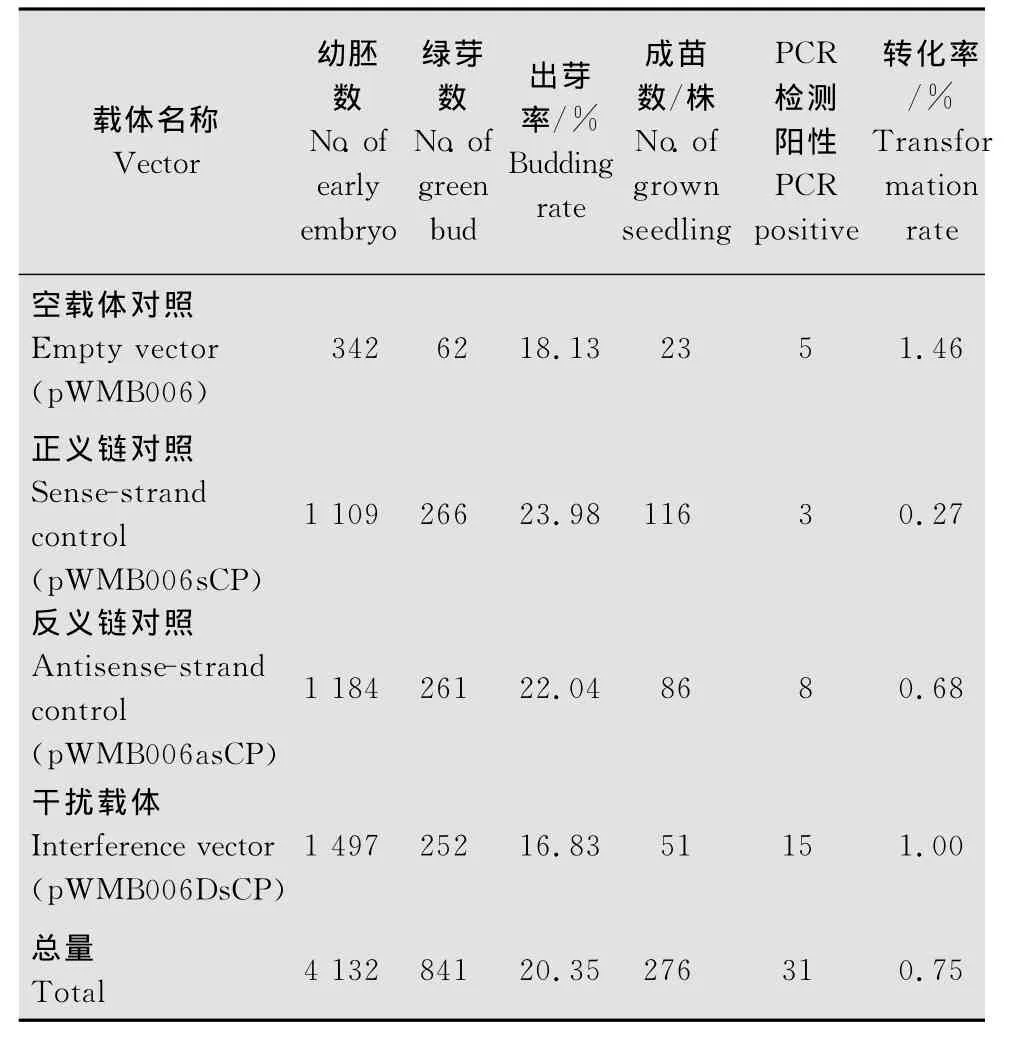
表1 T0代植株轉化試驗結果Table 1 Experimental results of T0transgenic plants
3 討論
利用RNA干擾機制進行植物抗病基因工程研究,是目前植物抗病毒研究領域的熱點。將病毒基因序列設計成反向重復結構,使其在轉基因寄主細胞內轉錄形成具有雙鏈結構的“發夾RNA”(hairpin RNA,hpRNA),即莖環結構,可強烈誘導寄主的RNA沉默并顯著增強植物抵抗同源病毒的能力[14-15]。在利用發夾結構載體轉化已經獲得多例單種病毒高效抗性的成功經驗的基礎上[16-17],科學家們又嘗試利用多種病毒的保守序列串聯構建發夾結構載體,以達到獲得兼抗多種病毒的轉基因植株的目的[18-19]。一般來說,CP基因在各自的病毒中都具有高度的保守性,因此成為抗病毒基因工程的首選策略。自1986年報道首例轉TMV CP基因獲得抗病性植株以后[20],已有10多個屬30余種病毒進行了轉CP基因研究,涉及煙草、番茄、南瓜等多達幾十種受體植物,其中大多數轉入CP基因的植株對病毒或同屬病毒具有一定程度的抗性[21-22]。
由禾谷多黏菌以持久性方式傳播的小麥黃花葉病毒在世界許多國家和地區大、小麥區均有發生,是一種全球性的病毒病害,造成大、小麥生產的嚴重危害并且尚無有效的防治措施。培育抗病品種是科學家長期以來的研究目標。本研究以WYMV的CP基因為沉默的靶標基因,根據病毒CP基因序列設計引物,構建適合單子葉植物轉化的RNAi植物表達載體,通過基因槍介導法導入小麥愈傷組織,通過誘導轉基因小麥植株產生RNA干擾作用,最終獲得抗WYMV的小麥基因工程植株。
為避免轉基因后代的生物安全問題,本研究采用的是目的基因和標記基因質粒共轉化策略。基因槍轉化后兩個轉化載體在減數分裂過程中,標記基因和目的基因發生分離,從而可以剔除選擇標記基因,通過PCR檢測可以篩選到只含功能基因而不含標記基因的轉基因小麥。另外,小麥基因組是異源六倍體,基因組非常復雜。基因槍的轉化方法隨機性較大,轉基因后代拷貝數目不等、插入位點也會存在偶然性。目的基因整合到小麥基因組后,還存在著基因沉默、后代分離等現象。因此,通常需要對得到的轉基因植株后代從轉錄、翻譯不同水平進行驗證,以確定目的基因是否穩定表達。本試驗得到了轉WYWV-CP的T0代陽性植株,取得了階段性的結果,T1代的轉基因植株的分子檢測和抗性鑒定正在開展之中。
[1] Sawada E.Wheat yellow mosaic prevention[J].Journal of Plant Protection,1927,14:444-449.
[2] 陳劍平,阮義理,董瑪佳.我國一些地區發生的小麥土傳病毒病原研究[J].病毒學雜志,1989(2):176-181.
[3] 王錫鋒,劉艷,韓成貴,等.我國小麥病毒病害發生現狀與趨勢分析[J].植物保護,2010,36(3):13-19.
[4] Hammond S M,Bernstein E,Beach D,et al.An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophilacells[J].Nature,2000,404:293-296.
[5] Plasterk R H,Ketting R F.The silence of the genes[J].Current opinion in Genetics and Development,2000(10):562-567.
[6] Matzke M,Matzke A J M,Kooter J M.RNA:Guiding gene silencing[J].Science,2001,293:1080-1083.
[7] Zamore P D,Tuschl T,Sharp P A,et al.RNAi:Double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21to 23 nucleotide intervals[J].Cell,2000,101(1):25-33.
[8] Winston W M,Molodowitch C,Hunter C P.Systemic RNAi in Caenorhabditis elegans requires the putative transmembrane protein SID-1[J].Science,2002,295:2456-2459.
[9] Verdel A,Jia S,Gerber S,et al.RNAi-mediated targeting of eterochromatin by the RITS complex[J].Science,2004,303:672-676.
[10]Nykanen A,Haley B,Zamore P D.ATP requirements and small interfering RNA structure in the RNA interference pathway[J].Cell,2001,107:309-321.
[11]Jorgensen R A,Atkinson R G,Forster R L S,et al.An RNA-based information superhighway in plants[J].Science,1998,279:1486-1487.
[12]Fire A,Xu S,Montgomery M K,et al.Potent and specific genetic interference by double stranded RNA in Caenorhabdits elegans[J].Nature,1998,391:806-811.
[13]Travella S,Klimm T E,Keller B.RNA Interference-based gene silencing as an efficient tool for functional genomics in hexaploid bread wheat[J].Plant Physiology,2006,142:6-20.
[14]Smith N,Singh S,Wang MB,et al.Total silencing by intronspliced hairpin RNAs[J].Nature,2000,407:319-320.
[15]Wesley S V,Helliwell C A,Smith N A,et al.Construct design for efficient,effective and high-throughput gene silencing in plants[J].The Plant Journal,2001,27:581-590.
[16]Wang M B,Abbott D C,Waterhouse P M.A single copy of a virus-derived transgene encoding hairpin RNA gives immunity to barley yellow dwarf virus[J].Molecular Plant Pathology,2000,1(6):347-356.
[17]Fahim M,Ayala-Navarrete L,Miller A A,et al.Hairpin RNA derived from viral NIagene confers immunity to wheat streak mosaic virus infection in transgenic wheat plants[J].Plant Biotechnology Journal,2010,8(7):821-834.
[18]Bucher E,Lohuis D,van Poppel P M,et al.Multiple virus resistance at a high frequency using a single transgene construct[J].Journal of General Virology,2006,87:3697-3701.
[19]Lin C Y,Ku H M,Chiang Y H,et al.resistance to a DNA and a RNA virus in transgenic plants by using a single chimeric transgene construct[J].Transgenic Research,2011,20(2):261-270.
[20]Beachy R N,Abel P P,Nelson R S,et al.Expression of genes encoding the TMV coat protein and 30-Kd protein in transformed Plants[J].Journal of Cell Biochemistry,1986:38-38.
[21]Baulcombe D C.Mechanisms of pathogen-derived resistance to viruses in transgenic plants[J].The Plant Cell,1996,8(10):1833.
[22]Chen X.Small RNAs-secrets and surprises of the genome[J].The Plant Journal,2010,61:941-958.

