甘薯病毒病害(SPVD)的多重RT-PCR檢測方法及其應用
張 盼, 蘭新芝, 喬 奇, 張德勝,秦艷紅, 田雨婷, 王 爽, 張振臣*
(1.河南省農業科學院植物保護研究所,鄭州 450002;2.河南省農作物病蟲害防治重點實驗室,鄭州 450002;3.河南省新縣農業局植保站,新縣 465500)
甘 薯 病 毒 病 害 (sweet potato virus diseases,SPVD)是由甘薯褪綠矮化病毒(Sweet potato chlorotic stunt virus,SPCSV)和甘薯羽狀斑駁病毒(Sweet potato feathery mottle virus,SPFMV)協生共侵染甘薯引起的病毒病害[1]。感染SPVD的甘薯表現植株矮化,葉片褪綠、畸形等癥狀。SPVD對甘薯產量影響極大,嚴重時可造成90%以上的產量損失,甚至絕收,是甘薯上的毀滅性病害[2-3]。張振臣等[4]利用血清學、分子生物學和嫁接傳染試驗等方法首先發現了SPVD在我國的發生,目前主要分布在廣東、江蘇、四川、安徽和福建等地。為了加強對SPVD的預警和控制,防止該病的進一步蔓延危害,有必要建立快速、高效的檢測技術。
用于甘薯病毒檢測的常用方法是酶聯免疫吸附技術(ELISA)和PCR技術,ELISA檢測技術耗時長、靈敏度較低,而且需要分別檢測SPCSV和SPFMV才能確定SPVD是否存在。另外,SPCSV在中國存在2個株系(EA和 WA),SPFMV存在4個株系(O、RC、EA和C),其中 O、RC和EA 3個株系的關系相對較近,將它們歸為一類,稱之為SPFMV CH 株系類型(SPFMV-CH);C株系與其他3個株系的關系較遠,稱之為SPFMV CH2株系類型(SPFMV-CH2)。目前已有人建議將C株系劃分為一個新種[5]。由于SPCSV與SPFMV不同株系的互作可能引起不同的產量損失[6],目前利用ELISA方法還不能有效區分SPFMV的不同株系。而利用單一的RT-PCR進行檢測時,需要進行多次PCR反應,工作量大,效率低。多重RT-PCR技術是近年發展起來的一種可用于多種病原體檢測的技術,具有特異性強、靈敏性高的特點,能在較短時間內同時完成多種病原的檢測,尤其適合于甘薯上一些容易混淆又常常混合侵染的病毒的檢測[6-7]。本研究建立了在一次PCR反應中即可檢測SPVD是否存在的方法,并且該方法可有效區分SPFMV的兩個株系類型,可為SPVD的快速檢測以及對該病的監測預警提供技術手段。
1 材料和方法
1.1 病毒材料及質粒
分別在廣東惠州、四川南充、江蘇徐州等地采集具有典型SPVD癥狀的甘薯莖蔓栽種于防蟲溫室中,分別利用血清學方法和普通RT-PCR方法檢測SPCSV和SPFMV,以確定感染SPVD的甘薯植株,并通過測定SPFMV外殼蛋白(CP)基因的核苷酸序列來確定SPFMV的株系類型,最后選定若干個SPVD感病植株備用。含SPFMV-CH、SPFMVCH2、甘 薯 潛 隱 病 毒 (Sweet potato latent virus,SPLV)、甘薯脈花葉病毒(Sweet potato vein mosaic virus,SPVMV)CP 基因以及SPCSV Hsp70基因的重組質粒由本實驗室構建并保存[8-9]。將經過NCM-ELISA和 RT-PCR檢測SPCSV 和SPFMV為陰性的甘薯脫毒試管苗作為陰性對照。從洛陽農林科學院試驗田分別采集感染SPVD的甘薯葉片和薯塊用于所建立的多重RT-PCR方法的驗證。
1.2 酶及試劑(盒)
UNIQ-10柱式總RNA抽提試劑盒為上海生工生物工程公司產品;UNIQ-10柱式DNA膠回收試劑盒購自北京百泰克生物技術公司;RNase抑制劑、AMV反轉錄酶、Taq DNA聚合酶、pMD19-T載體、T7RNA Polymerase購自TaKaRa公司。其他常用試劑為國產分析純。
1.3 引物的設計與合成
根據NCBI GenBank中登錄的SPCSV Hsp70基因和SPFMVCP基因的核苷酸序列設計了4對特異性引物(表1),引物由上海生工生物工程公司合成。
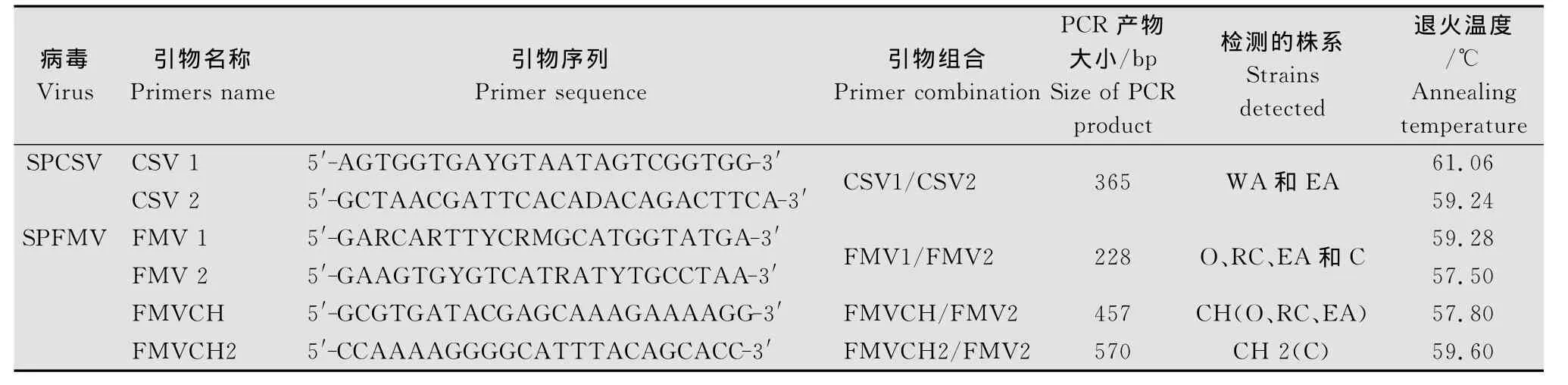
表1 多重RT-PCR擴增的特異性引物Table 1 Specific primers for multiplex RT-PCR amplification
1.4 核酸提取
利用上海生工生物工程公司的Flash UNIQ柱式總RNA抽提試劑盒提取感病甘薯葉片的總RNA。甘薯薯塊總RNA的提取參照楊元軍等[10]方法進行。
1.5 單一RT-PCR
以提取的感病甘薯葉片總RNA為模板,反轉錄反應體系為10μL,包括2μL 5×RT buffer,1μL MgCl2(25mmol/L),1 μL dNTP 混 合 物 (各10mmol/L),0.5μL CSV2引物或0.5μL FMV 2引物,0.25μL RNase抑制劑(40U/μL),0.5μL反轉錄 酶 (AMV Reverse Transcriptase)(5U/μL),4.25μL樣品RNA,DEPC-H2O 0.5μL。反應程序為:42℃反轉錄40min,99℃5min,5℃5min。
PCR反應體系為25μL,包括2.5μL 10×PCR buffer(Mg2+-),0.2μL Taq 酶(5U/μL),0.5μL上游引物(CSV 1、FMV 1、FMVCH 或 FMVCH2)(10 μmol/L),0.5μL下游引物(CSV 2或 FMV 2)(10 μmol/L),1μL dNTP混合物(各10mmol/L),1μL MgCl2(25mmol/L);以2μL反轉錄產物為模板,用dd H2O補足至25μL。反應程序為:94℃預變性3min;94℃變性30s,56℃退火30s,72℃延伸40s,35個循環;最后72℃延伸10min。擴增產物經1.0%瓊脂糖凝膠電泳、UVP凝膠成像系統觀察和照相。
1.6 多重RT-PCR反應條件的篩選
以單一RT-PCR反應體系為基礎,對影響多重RT-PCR的主要反應條件進行優化,在優化某一條件時,其他條件不變。退火溫度分別設50.0、51.9、53.7、55.3、57.6 ℃和60.0 ℃ 6個處理;dNTP 混合物(各2.5mmol/L)分別設0、0.5、1.0、1.5、2.0、2.5μL 6個處理;MgCl2濃度(25mmol/L)分別設0、0.5、1、1.5、2、2.5μL 6個處理,Taq 酶(5U/μL)分別設0、0.1、0.2、0.3、0.4、0.5μL 6個處理;引物濃度(10μmol/L)設4個處理,引物FMV1∶FMVCH∶FMVCH2∶FMV2∶CSV1∶CSV2的加入量分別為(1)0.2μL∶0.2μL∶0.4μL∶0.8μL∶0.4μL∶0.4μL;(2)0.2μL∶0.4μL∶0.4μL∶1.0μL∶0.4μL∶0.4μL;(3)0.2μL∶0.4μL∶0.6μL∶1.2μL∶0.6μL∶0.6μL;(4)0.2μL∶0.3μL∶0.5μL∶1.3μL∶0.5μL∶0.5μL。
1.7 多重RT-PCR的特異性試驗
1.7.1 幾種甘薯病毒RNA體外轉錄產物的制備
按照T7RNA Polymerase說明書進行RNA體外轉錄。在上游引物的5′端引入T7啟動子序列,分別以SPFMV-CH、SPFMV-CH2、SPLV、SPVMV的CP基因和SPCSV Hsp70基因的重組質粒為模板,進行PCR擴增,擴增的雙鏈DNA片段在T7 RNA聚合酶的作用下經體外轉錄形成單鏈RNA(cRNA),純化后用核酸測定儀測定cRNA濃度,根據阿伏伽德羅常數將濃度換算為拷貝數。
1.7.2 多重RT-PCR的特異性試驗
利用甘薯上常見的兩種Potyvirus病毒SPLV和SPVMV測試特異性。分別以濃度為106拷貝/μL的 SPCSV、SPFMV-CH、SPFMV-CH2、SPLV、SPVMV的體外轉錄RNA為核酸模板,進行多重RT-PCR擴增,檢測多重RT-PCR的特異性。
1.8 多重RT-PCR的靈敏性試驗
分別將SPCSV、SPFMV-CH、SPFMV-CH2的體外轉錄RNA,進行10倍梯度稀釋,分別取濃度為108~101拷貝/μL的8個濃度梯度的RNA作為核酸模板,進行多重RT-PCR擴增,以檢測其靈敏性。
1.9 多重RT-PCR產物的克隆和序列測定
將純化后的多重RT-PCR產物分別與pMD19-T載體連接,連接產物轉化大腸桿菌TG1,經藍白斑篩選和PCR鑒定后獲得陽性克隆。核苷酸序列測定由TaKaRa公司完成。利用DNAMAN和BLAST對所測序列進行比較分析[9]。
1.10 多重RT-PCR的初步應用
從田間分別采集了10份感染SPVD的甘薯葉片樣品和7份薯塊樣品,按照1.4中的方法提取總RNA,利用建立的多重RT-PCR方法對樣品進行檢測。
2 結果與分析
2.1 多重RT-PCR反應條件的篩選
試驗結果表明,退火溫度在50~55.3℃之間的擴增效果都比較好;dNTPs加入量在1μL以上時均能很好地擴增出全部目的條帶;當Mg2+加入量達到0.5μL時就能夠擴增出全部目的條帶,并且隨濃度的增加條帶越來越亮,但當 Mg2+加入量為2.5μL時,各目的條帶的亮度反而變弱;Taq DNA聚合酶加入量為0.2μL時,能清晰地擴增出全部目的條帶,隨著酶量的增加,沒有很大的變化;4種引物濃度組合的擴增效果都比較好,不同組合對擴增效果影響不大(圖略)。
根據不同條件對試驗結果的影響,綜合考慮擴增效果和試驗成本,最終優化的多重RT-PCR反應體系為:多重RT反應體系為10μL:2μL 5×RT buffer,1μL MgCl2(25mmol/L),1μL dNTP 混合物(各10mmol/L),0.5μL CSV2引物,0.5μL FMV2引物,0.25μL RNase抑制劑(40U/μL),0.5μL 反 轉錄酶 (AMV Reverse Transcriptase)(5U/μL),4.25μL樣品 RNA。反應程序為:42℃反轉錄40min,99℃5min,5℃5min。多重PCR反應體系為25μL:2.5μL 10×PCR buffer(Mg2+-),0.3μL Taq 酶(5U/μL),1.5μL dNTP Mixture(各2.5mmol/L),1.5μL MgCl2(25mmol/L),0.5μL引物CSV1,0.5μL引物CSV2,0.2μL引物FMV1,1.3μL引物FMV2,0.3μL引物FMVCH,0.5μL引物FMVCH2,2μL反轉錄產物,ddH2O補足25μL。反應程序為:94℃ 預變性3min;94℃變性30s,53℃退火30s,72℃延伸40s,35個循環;最后72℃ 延伸10min。
2.2 多重 RT-PCR與單一 RT-PCR擴增效果的比較
以同時感染SPCSV以及SPFMV 2個株系類型的SPVD甘薯植株葉片總RNA為模板,利用建立的多重RT-PCR反應體系對樣品進行擴增,結果表明,多重RT-PCR擴增結果與單一RT-PCR的擴增結果一致(圖1)。

圖1 多重和單一RT-PCR檢測結果比較Fig.1 Comparison of the test results between multiplex RT-PCR and single RT-PCR
2.3 多重RT-PCR的特異性分析
體外轉錄的RNA經純化后測定RNA的濃度,各目的cRNA的濃度與拷貝數見表2。利用建立的多重RT-PCR方法對濃度為106拷貝/μL的SPFMVCH2、SPFMV-CH、SPCSV、SPLV和SPVMV幾種病毒的cRNA進行擴增。結果顯示,從SPFMV-CH、SPFMV-CH2和SPCSV的cRNA以及兩兩混合的cRNA和3種混合的cRNA中均能擴增出相應的目的條帶,而從SPLV和SPVMV中均未擴增出條帶。說明建立的多重RT-PCR特異性較好(圖2)。

表2 各目的基因體外轉錄合成RNA的濃度與拷貝數Table 2 Concentrations and copies of RNA synthesized from the objective gene in vitro

圖2 多重RT-PCR的特異性檢測Fig.2 Specific detection by multiplex RT-PCR
2.4 多重RT-PCR的靈敏性分析
靈敏性試驗結果表明,建立的多重RT-PCR方法對SPFMV-CH2、SPFMV-CH 和SPCSV 的最低檢測濃度分別為1.42×104拷貝/μL、1.32×104拷貝/μL和2.47×104拷貝/μL(圖3)。說明該方法可實現對2種甘薯病毒RNA104拷貝水平的檢測。
2.5 多重RT-PCR擴增產物的鑒定
為了進一步驗證多重RT-PCR擴增出的片段為目的病毒的核酸序列,對部分多重RT-PCR的擴增產物進行了克隆和序列測定。結果表明,所擴增出的4個片段的核苷酸序列與GenBank中SPFMV和SPCSV核苷酸序列的一致性最高分別達92%、96%、98%和97%左右,說明擴增出的片段均為目的病毒的特異性片段。
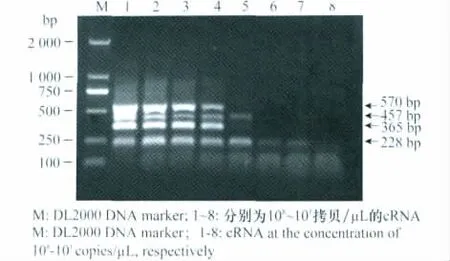
圖3 多重RT-PCR的靈敏性Fig.3 Sensitivity of multiplex RT-PCR assay
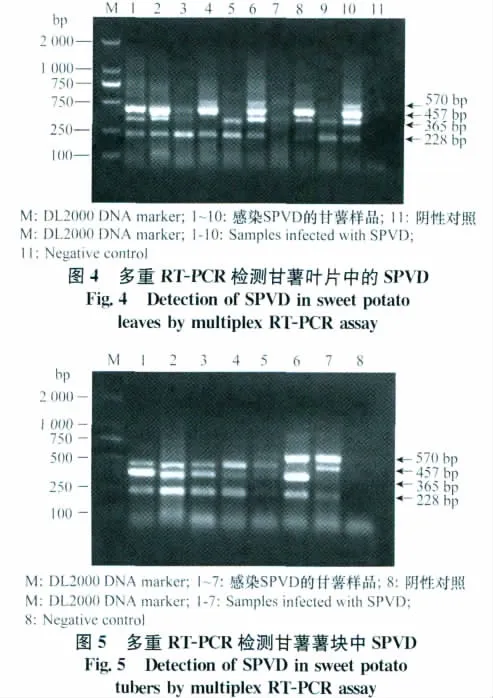
2.6 多重RT-PCR檢測方法的初步應用
分別對10份感染SPVD的甘薯葉片樣品和7份薯塊樣品進行了檢測,結果表明,本研究所建立的多重RT-PCR方法能從葉片和薯塊中檢測出SPVD的兩種病原,并且能夠區分SPFMV的兩個主要株系類型。例如,對甘薯葉片的檢測中,樣品1含有SPFMV-CH株系和SPCSV 2種病毒,樣品6含有SPFMV-CH、SPFMV-CH2和SPCSV 3種病毒;對甘薯薯塊的檢測中,樣品2含有SPFMV-CH株系和SPCSV 2種病毒,樣品6含有SPFMV-CH2株系和SPCSV 2種病毒(圖4、圖5)。
3 結論與討論
本文設計了針對SPFMV和SPCSV所有株系的通用引物,同時還設計了能區分SPFMV 2個主要株系類型(CH和CH2)的特異性引物。通過優化反應條件,初步建立了在一次PCR反應中即可檢測SPVD是否存在的方法,該方法可用于甘薯植株和薯塊中病毒的檢測。SPVD是甘薯上的毀滅性病害,建立SPVD快速高效的檢測技術,對于該病的預警和控制具有重要意義。
影響多重RT-PCR擴增效果的因素很多。例如,擴增的目的片段應盡量選擇小片段,各片段大小的差距要適中,以減小擴增效率不均衡對擴增效果的影響[11]。本研究設計的擴增片段均小于600bp,有效減小了擴增效率不均衡的影響。在引物設計方面,不同引物之間互補的堿基不能太多,避免引物之間形成二聚體等。Tm值相近的引物更有利于多重RT-PCR擴增[12]。另外,在一個PCR反應體系中同時加入多個引物,引物之間的競爭也會影響擴增效果。由于當SPCSV和SPFMV共同侵染甘薯時,SPCSV的含量變化不明顯,而SPFMV的含量會比其單獨侵染時增加600倍[13],因此本研究適當提高了SPCSV引物的濃度,達到了比較好的擴增效果。
[1] Gibson R W,Mpembe I,Alicai T,et al.Symptoms,aetiology and serological analysis of sweet potato virus disease in Uganda[J].Plant Pathology,1998,47:95-102.
[2] Gutiérrez D L,Fuentes S,Salazar L F.Sweet potato virus disease(SPVD):distribution,incidence,and effect on sweet potato yield in Peru[J].Plant Disease,2003,87:297-302.
[3] Njeru R W,Mburu M W K,Cheramgoi E,et al.Studies on the physiological effects of viruses on sweet potato yield in Kenya[J].Annals of Applied Biology,2004,145:71-76.
[4] 張振臣,喬奇,秦艷紅,等.我國發現由甘薯褪綠矮化病毒和甘薯羽狀斑駁病毒協生共侵染引起的甘薯病毒病害[J].植物病理學報,2012,42(3):328-333.
[5] Yamasaki S J,Sakai S,Fuji S,et al.Comparisons among isolates of Sweet potato feathery mottle virus using complete genomic RNA sequences[J].Archives of Virology,2010,155:795-800.
[6] Kokkinos C D,Clark C A.Interactions among Sweet potato chlorotic stunt virus and different potyviruses and potyvirus strains infecting sweet potato in the United States[J].Plant Disease,2006,90:1347-1352.
[7] Mukasa S B,Rubaihayo P R,Valkonen J P T.Interactions between a crinivirus,an ipomovirus and a potyvirus in coinfected sweet potato plants[J].Plant Pathology,2006,55:458-467.
[8] 黃玉娜,張振臣.甘薯潛隱病毒外殼蛋白基因的克隆、表達及其抗血清的制備[J].植物病理學報,2007,37(3):255-259.
[9] 張業輝,秦艷紅,喬奇,等.甘薯脈花葉病毒外殼蛋白基因在大腸桿菌中的表達及其抗血清的制備[J].植物病理學報,2011,41(1):57-63.
[10]楊元軍,王玉萍,翟紅,等.甘薯塊根總RNA的高效快速提取方法[J].分子植物育種,2008,6(1):196-197.
[11]張顯勇,蔡文偉,楊本鵬,等.甘蔗花葉病和宿根矮化病多重PCR檢測方法的建立[J].中國農業科學,2008,41(12):4321-4327.
[12]范旭東,董雅鳳,張尊平.3種蘋果潛隱病毒多重RT-PCR檢測體系的建立[J].園藝學報,2009,36(12):1821-1826.
[13]Karyeija R F,Kreuze J F,Gibson R W,et al.Synergistic interactions of a potyvirus and a phloem-limited crinivirus in sweet potato plants[J].Virology,2000,269:26-36.

