γδT細胞在感染免疫中作用機制的研究進展①
楊 波 藍 程 周旭春 (重慶醫科大學附屬第一醫院消化內科,重慶400016)
γδT細胞是1986年發現的一個重要T淋巴細胞亞型,主要分布在黏膜相關淋巴組織,其中腸道的γδT細胞是分布在該組織中的主要T細胞亞型。大量研究表明在機體受到細菌、病毒和寄生蟲感染后,γδT細胞能快速增殖并通過誘導凋亡、ADCC、抗原呈遞和免疫調節等途徑發揮免疫功能。
1 γδT細胞的結構與分布特點
構成TCR的肽鏈有α、β、γ和δ四種類型,根據肽鏈的不同,TCR分為TCRαβ和TCRγδ,據此,T細胞分為αβT細胞和γδT細胞。TCR的γ鏈和δ鏈基因由V、D、J、C四個區組成,其中V區是TCR識別抗原肽一MHC復合物的功能區。按照表達TCR可變區基因產物的不同將γδT細胞分成許多亞型,由于T細胞亞群往往只取用受體庫中有限的一部分,即只取用特定的VγVδ和連接區序列的組合,導致了TCRγδ結構較為單調,但因連接區(J區)的重組,TCRγδ又具多樣性潛能,如外周血表達 Vγ9δ2,消化道粘膜表達Vγ7Vδ4/6。不同部位不同亞類的γδT 細胞分泌的細胞因子和功能不完全相同[1,2]。
2 γδT細胞識別抗原特點
γδT細胞既具有αβT細胞的部分功能又能發揮免疫球蛋白的作用,它是非特異性免疫的關鍵成分。γδT細胞的抗原識別具有如下特點:(1)γδT細胞的分子結構及抗原結合特性同免疫球蛋白更為相似,可直接識別抗原;(2)γδT細胞能識別的抗原大多數是小分子量的非蛋白類分子和脂質成分,也能識別非典型的MHC-Ⅰ類分子、病毒表面蛋白以及HSP60;(3)γδT細胞識別抗原無MHC限制性,且多肽無需被處理為小分子肽段,可以以完整的形式被識別,故能對抗原作出快速免疫應答;(4)分布在不同組織中的γδT細胞可以表達不同的TCR識別不同性質的抗原,在同一組織中的γδT細胞則表達相同的 TCR 識別相同性質的抗原[3,4]。
3 γδT細胞與感染免疫
3.1 主要生物學功能 γδT細胞既具有來源于髓系的細胞如單核細胞、巨噬細胞、中性粒細胞和髓系樹突狀細胞的非特異性免疫特征,又具有來源于淋巴細胞系的B細胞和αβT細胞的特異性免疫特征,γδT細胞在抗感染免疫過程中的主要生物學功能有:(1)直接溶解靶細胞:激活的γδT細胞能通過顆粒酶-穿孔素途徑直接裂解靶細胞,也可經由Fas-FasL、IFN-γ 誘導靶細胞凋亡[5,6];(2)抗體依賴的細胞毒作用:經某些膜表面受體如FcγR,發揮ADCC作用,并通過分泌IL-2增強其細胞毒效應[7];(3)通過激活、抑制或募集其它免疫細胞發揮免疫作用:如樹突狀細胞、粒細胞、巨噬細胞、朗格漢斯細胞、αβT細胞和B細胞都與γδT細胞抗感染功能密切相關[8-10];(4)抗原呈遞作用:部分激活的γδT細胞可以分化為 APC,表面高表達 MHC-Ⅱ類分子及 CD80、CD86和CCR7等,加工處理抗原,交叉呈遞給αβT細胞激發特異性免疫應答[11,12];(5)γδT 細胞的免疫調節功能:激活的γδT細胞可以抑制Foxp3(+)Tregs增殖[13],也可以產生 IL-10、TGF-β 發揮免疫調節作用[14];(6)免疫監視作用:記憶性 γδT 細胞表面通過高表達CCR7,CD161等可以防止病毒擴散、抵抗機會性感染、發揮免疫監視作用[15,16]。
3.2 γδT細胞與細菌感染
3.2.1 結核分枝桿菌 結核分枝桿菌可侵犯全身各器官,以肺部最為多見。先前的大量研究已經發現在感染早期,γδT細胞分泌毒性的IFN-γ殺死感染的巨噬細胞并促進肉芽腫形成。最近,Kubota等[6]發現在感染時Vδ2T細胞能產生顆粒溶解酶和穿孔素降低細胞內外結核分枝桿菌的活性,并能產生IFN-γ誘發巨噬細胞對其初始殺傷,同時激活感染部位樹突狀細胞的抗原呈遞能力,引發特異性免疫。Gong等[13]研究結核分枝桿菌感染時還發現γδT細胞有免疫調節能力,他們用磷酸化抗原激活的Vγ2Vδ2T細胞能與Tregs相互作用;短療程的IL-2治療后,誘導增加CD4(+)CD25(+)Foxp3(+)T細胞能抑制因結核分枝桿菌感染而增加的Vγ2Vδ2T細胞的數量,在加用磷酸化抗原激活的Vγ2Vδ2T細胞后能下調因IL-2引起CD4(+)CD25(+)Foxp3(+)T細胞的擴增。由此可見γδT細胞是從多時間點、多途徑參與對結核桿菌的殺傷。
3.2.2 傷寒桿菌 傷寒桿菌感染時主要累及全身單核吞噬細胞系統,病變突出表現在腸道淋巴組織,腸系膜淋巴結、肝、脾和骨髓等處。Pieper[17]在研究感染沙門氏菌的雛鳥時發現,感染沙門氏菌后血液和脾臟內表達CD8αα的γδT細胞會快速增殖,并能提高 Fas、IL-2Rα 和 IFN-γ 的轉錄。Li等[18]用鼠傷寒沙門氏菌腸道感染模型研究表明腸上皮淋巴組織的 γδT細胞亞型通過表達 NKG2D、CD8αα、FasL和IFN-γ發揮免疫監視和清除感染上皮細胞的功能,還與上皮細胞分泌角化細胞生長因子相關,促進上皮細胞的再生進而限制病原菌的進一步入侵[18]。可見,γδT細胞的作用較局限,主要體現在早期防御階段,但傷寒桿菌感染時有吞噬功能的吞噬細胞與γδT細胞之間的相互作用卻不能清除傷寒桿菌,是否有吞噬細胞內環境的破壞?這些值得我們探討。
3.2.3 大腸桿菌 大腸桿菌是腸道中最主要且數量最多的細菌。研究發現大腸桿菌感染后激活的γδT細胞通過產生IFN-γ去進一步激活巨噬細胞并釋放IL-15,分泌的IL-15促使γδT細胞在感染部位集聚參與局部抗炎,還通過自身釋放的IL-17募集中性粒細胞發揮抗感染功能;最近,Wu等[11]用共聚焦顯微鏡、透射電鏡和功能性抗原呈遞法分析發現,人類外周血的γδT細胞能通過抗體調理素和CD16分子的介導識別并捕獲大腸桿菌,然后經過表達的MHC-Ⅱ類分子發揮抗原呈遞功能。因此,γδT細胞和APC一樣作為非特異性和特異性免疫應答連接的紐帶,一方面作為效應細胞直接參與對病原體的殺傷,另一方面發揮調節細胞功能引發特異性免疫加入感染免疫過程。
3.2.4 單核細胞增生性李斯特菌 李斯特菌是一種人畜共患病的病原菌,感染后主要表現為敗血癥、腦膜炎和單核細胞增多。感染時,活化的巨噬細胞可以激活γδT細胞,使其具有細胞毒性,并殺傷活化的巨噬細胞,維持正常巨噬細胞內環境的穩定,從而控制慢性炎癥的發生。Rhodes等[19]用李斯特菌感染γδT細胞缺陷小鼠后,小鼠肝細胞在能分泌TNF-α的CD8+T細胞的介導下出現嚴重和廣泛的肝細胞壞死,而激活的巨噬細胞和CD8+T細胞與Vγ4T細胞接觸后分泌IL-10可以減輕肝損傷,Vγ4T細胞還能控制CD8+T細胞的擴增并通過IL-10調節和減少TNF-α的分泌。Meeks等[20]發現,李斯特菌感染的早期,有大量IL-17的產生,而γδT細胞是IL-17的主要來源,研究者推測γδT細胞可能通過分泌IL-17募集中性粒細胞而加速細菌的清除。可見,γδT細胞可以通過多種途徑參與免疫過程,其中以產生各種細胞因子調節其他免疫細胞的作用尤為突出。
3.2.5 其它 布魯氏菌感染時,Vδ2T細胞能直接溶解吞噬有布氏菌的巨噬細胞,并通過Fas-Fas配體降低細菌數量、限制感染的擴散,在感染的早期還能通過巨噬細胞分泌的IFN-γ發揮快速抗感染能力[21]。幽門螺桿菌存在時外周血的γδT細胞數量會明顯增加,并與胃竇的炎癥程度密切相關,清除HP后,γδT細胞數量會明顯下降[22],這種現象是否與γδT細胞分泌的抗炎因子或者表面的Toll樣受體相關還值得更深入的研究。
3.3 γδT細胞與病毒感染
3.3.1 輪狀病毒 輪狀病毒主要感染小腸上皮細胞引起腹瀉。Wen等用豬研究輪狀病毒感染時γδT細胞的功能,發現 CD2+CD4-和 CD4-CD8-γδT 細胞能通過直接分泌IFN-γ或者促進CD4+αβT細胞增殖并分泌IFN-γ促進炎癥反應。而CD2+CD4+γδT細胞主要是通過直接分泌IL-10、TGF-β或者促進CD4+αβT細胞增殖并分泌 IL-10、TGF-β 以及表達FoxP3(+)來調節T細胞表達。γδT細胞通過增加TLR2、TLR4和 TLR9的表達以及釋放 IFN-γ、TGF-β 來對抗輪狀病毒感染[23]。可見 γδT細胞可以通過改變自身受體的表達和對其它免疫細胞的調節共同參與免疫應答過程。
3.3.2 流感病毒 流感病毒是一種造成人類及動物患流行性感冒的RNA病毒。γδT細胞在流感病毒感染后期能識別由病毒感染引起表達的HSP,產生調節性免疫應答,通過分泌調節性細胞因子來減弱免疫應答的強度[4]。在體外利用IPP活化健康人的Vγ9Vδ2T細胞能通過NKG2D、細胞間的直接接觸、Fas-FasL和穿孔素一顆粒酶等途徑殺傷感染流感病毒的巨噬細胞,抑制病毒復制[5],Vγ9Vδ2T 細胞還可以作為APC發揮交叉呈遞作用,將流感病毒感染細胞或病毒顆粒本身抗原處理呈遞給CD4+或CD8+T細胞,可誘導其產生特異性免疫應答[24]。在流感病毒感染過程中,記憶性Vγ9Vδ2 T細胞的亞型可快速產生IFN-γ,介導對感染了流感病毒細胞的細胞毒作用。深入研究證實,部分亞型的這種超級細胞毒作用是依賴CD16途徑的脫顆粒而不是ADCC途徑[25]。這些都提示 γδT細胞貫穿整個流感病毒的免疫過程,有利于流感病毒疫苗的研究。
3.3.3 單純皰疹病毒 HSV能引起人類多種疾病,如齦口炎、角膜結膜炎、腦炎以及生殖系統感染和新生兒的感染。Nishimura等[3]認為,γδT 細胞可通過識別HSV感染細胞產生的應激分子如HSP或磷酸化抗原而快速活化并高表達IFN-γ、TNF-α、IL-8、MIP-Iα和 CCL5等Th2型細胞因子,發揮細胞毒作用而清除病毒。在皮膚感染HSV時,γδT細胞還能通過誘導細胞凋亡和阻礙E-鈣粘蛋白下調來抑制已被感染朗格漢斯細胞的移動,從而抑制感染擴散[8]。可見,γδT細胞在生命的早期就能依靠非特異性免疫發揮抵抗病毒感染的功能。
3.3.4 人類免疫缺陷病毒 HIV是能引起獲得性免疫缺陷綜合征和相關疾病的RNA病毒,病毒主要侵犯CD4 T細胞、CD4單核細胞和B淋巴細胞。先前大量研究已經證明了γδT細胞在HIV感染過程中會發生表型和功能的變化,從感染早期就參與其發病過程。如HIV感染后因外周血Vγ9Vδ2T細胞丟失會出現Vδ1T細胞和Vδ2T細胞比例倒置,殘存的Vγ9Vδ2T細胞功能也不能被激活;HIV誘導產生的MICA/B會刺激產生缺失CDR3的Vδ2T細胞,不能有效識別抗原。最近研究發現,HIV感染病人血液中增殖的Vδ1T細胞表達的NKG2C可以和感染了HIV的CD4T細胞表面表達的HLA-E結合介導細胞毒性作用。Hudspeth等[26]用 HIV-1感染CD4+/CCR5+的PM1細胞株揭示出激活后的Vδ1T細胞表達的天然細胞毒受體亞型NKp30能激發CCL3/MIP-1α、CCL4/MIP-1β 和 CCL5/RANTES 的產生,進而抑制CCR5對HIV的應答,間接發揮抗病毒功能。Poonia等[7]也發現用唑來磷酸/IL-2可刺激HIV病人外周血,γδT細胞能增殖成ADCC的效應細胞。可見,γδT細胞受到HIV的作用,導致其功能抑制、失能或數量減少而產生免疫逃逸現象。因此,如果活化γδT細胞殘存的細胞毒性和ADCC作用,利用過繼治療的手段可能有助于清除病毒,這值得深入研究。
3.3.5 其它 對γδT細胞在巨細胞病毒感染中作用研究時發現,γδT細胞能通過TCR/CD3通路識別HSP65和其它抗原、激活并表達高水平的 IFN-γ、TNF-α、TGF-β、自然殺傷細胞受體和細胞毒調節因子來清除被感染細胞[27]。
3.4 γδT細胞與寄生蟲感染 目前對γδT細胞與寄生蟲感染的研究相對較少。在弓形蟲感染時,γδT細胞通過清除外周組織感染的巨噬細胞而達到抑制病原體增殖和控制炎癥的目的;在腸道也可以通過局部的γδT細胞維持細胞間的緊密連接、上皮的屏障功能和調節上皮細胞的滲透性來發揮抗感染的作用。人體受到惡性瘧原蟲感染時,γδT細胞會比其它免疫細胞更快速的通過NKG2D受體的信號通路產生IFN-γ發揮抗感染作用。Costa等人在體外分別用紅細胞內外的惡性瘧原蟲裂殖子激活Vγ9δ2T 細胞,激活的 Vγ9δ2T 細胞可分別殺傷紅細胞內外的裂殖子,而γδT細胞直接介導的抗寄生蟲功能只能作用于紅細胞外的裂殖子。體內研究發現,γδT細胞能通過穿孔素間接作用于紅細胞內的裂殖子,從而發揮抗寄生蟲作用[28]。在研究鉤端螺旋體感染時,Wang等[29]用RNA干擾技術發現干擾γδT細胞表面的清道夫受體可明顯減少鉤端螺旋體刺激γδT細胞的增殖和分泌IFN-γ的能力,但這是否與Toll受體相關還需進一步的研究。γδT細胞在感染免疫中的作用機制可總結如表1。
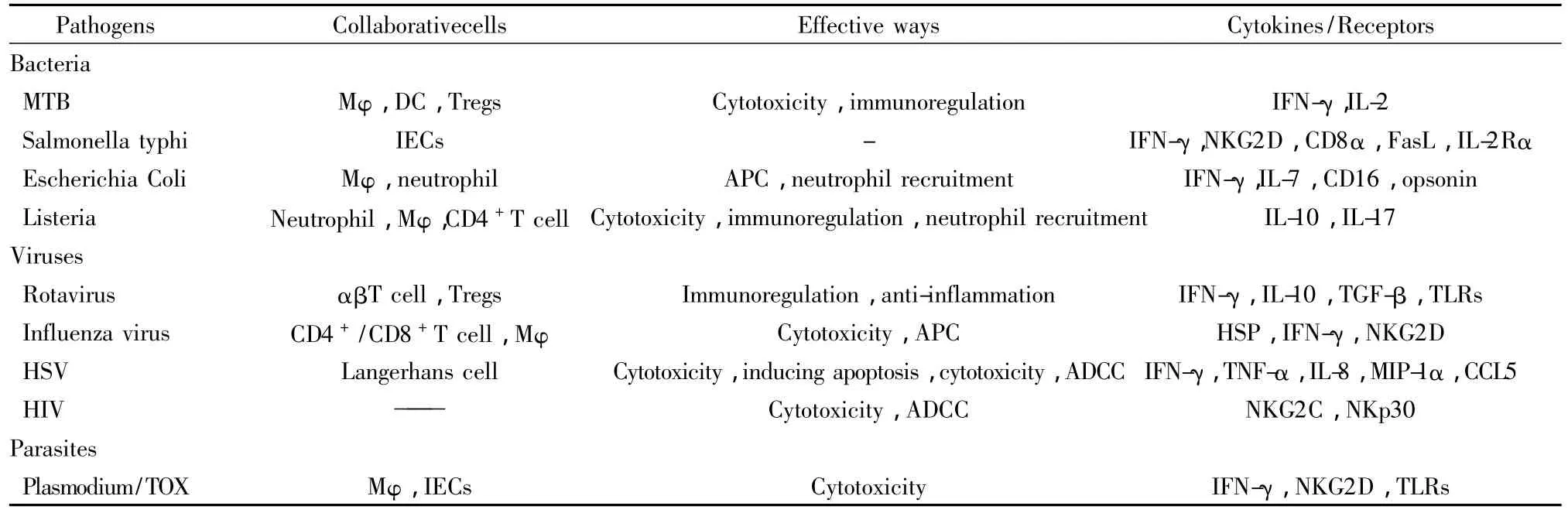
表1 γδT細胞在感染免疫中的作用機制Tab.1 The mechanism of γδT cells in infection immunity
4 結束語
近年來γδT細胞在感染免疫中的作用機制一直是研究的熱點,但γδT細胞介導的感染免疫機制仍不完全清楚。目前的研究重點主要集中在抗原識別、溶細胞作用、ADCC、免疫調節以及免疫監視等方面。各種免疫作用機制之間的相互關系以及能否作為過繼治療的手段治療部分免疫缺陷疾病也需要更深入的研究。
1 Toulon A,Breton L,Taylor K R et al.A role for human skin-resident T cells in wound healing[J].J Exp Med,2009;206:743-750.
2 Jin N,Roark C L,Miyahara N et al.Allergic airway hyperresponsiveness-enhancing γδ T cells develop in normal untreated mice and fail to produce IL-4/13,unlike Th2 and NKT cells[J].J Immunol,2009;182:2002-2010.
3 張晉渝,石 云,鄒全明.γδT細胞在感染性疾病中的研究進展[J].細胞與分子免疫學雜志,2011;27(8):825-827.
4 Khatri M,Dwivedi V,Krakowka S et al.Swine influenza H1N1 virus induces acute inflammatory immune responses in pig lungs:a potential animal model for human H1N1 influenza virus[J].J Virol,2010;84:11210-11218.
5 Qin G,Mao H,Zheng J et al.Phosphoantigen-expanded human γδ T cells display potent cytotoxicity against monocyte-derived macrophages infected with human and avian influenza viruses[J].J Infect Dis,2009;200:858-865.
6 Kubota K.Innate IFN-γ production by subsets of natural killer cells,natural killer T cells and γδ T cells in response to dying bacterial-infected macrophages[J].Scand J Immunol,2010;71:199-209.
7 Poonia B,Pauza C D.Gamma delta T cells from HIV+donors can be expanded in vitro by zoledronate/interleukin-2 to become cytotoxic effectors for antibody-dependent cellular cytotoxicity[J].Cytotherapy,2011:1-9.
8 Puttur F K,Fernandez M A,White R et al.Herpes simplex virus infects skin gamma delta T cells before Langerhans cells and impedes migration of infected Langerhans cells by inducing apoptosis and blocking E-cadherin downregulation [J].J Immunol,2010;185:477-487.
9 Cua C M T.Innate IL-17-producing cells:the sentinels of the immune system[J].Nat Immunol,2010;10:479-489.
10 Agrati C,Cimini E,Sacchi A et al.Activated V gamma 9V delta 2 T cells trigger granulocyte functions via MCP-2 release[J].J Immunol,2009;182:522-529.
11 Wu Y,Wu W,Wong W M et al.Human gamma delta T cells:a lymphoid lineage cell capable of professional phagocytosis[J].J Immunol,2009;183:5622-5629.
12 Brandes M,Willimann K,Bioley G et al.Cross-presenting human γδ T cells induce robust CD8+αβ T cell responses[J].Natl Acad Sci USA,2009;106:2307-2312.
13 Gong G,Shao L,Wang Y et al.Phosphoantigen-activated V gamma 2V delta 2 T cells antagonize IL-2-induced CD4+CD25+Foxp3+T regulatory cells in mycobacterial infection[J].Blood,2009;113:837-845.
14 Kühl A A,Pawlowski N N,Grollich K et al.Human peripheral γδ T cells possess regulatory potential[J].Immunology,2009;128:580-588.
15 Fenoglio D,Poggi A,Catellani S et al.Vδ1 T lymphocytes producing IFN-γ and IL-17 are expanded in HIV-1-infected patients and respond to Candida albicans[J].Blood,2009;113:6611-6618.
16 Chodaczek G,Papanna V,Zal M A et al.Body-barrier surveillance by epidermal[gamma][delta]TCRs[J].Nat Immunol,2012;13:272-282.
17 Pieper J,Methner U,Berndt A.Characterization of avian γδ T-cell subsets after salmonella enterica serovar typhimurium infection of chicks[J].Infect Immun,2011;79:822-829.
18 Li Z,Zhang C,Zhou Z et al.Small intestinal intraepithelial lymphocytes expressing CD8 and T cell receptor γδ are Involved in bacterial clearance during salmonella enterica serovar typhimurium infection[J].Infect Immun,2012;80:565-574.
19 Rhodes K A,Andrew E M,Newton D J et al.A subset of IL-10-producing γδT cells protect the liver from Listeria-elicited,CD8+T cell-mediated injury[J].Eur J Immunol,2008;38:2274-2283.
20 Meeks K D,Sieve A N,Kolls J K et al.IL-23 is required for protection against systemic infection with Listeria monocytogenes[J].J Immunol,2009;183:8026-8034.
21 Skyberg J A,Thornburg T,Rollins M et al.Murine and Bovine γδ T Cells Enhance Innate Immunity against<italic>Brucella abortus< /italic> Infections[J].PLoS One,2011;6:e21978.
22 Hayday A C.γδ T cells and the lymphoid stress-surveillance response[J].Immunity,2009;31:184-196.
23 Wen K,Bui T,Li G et al.Characterization of immune modulating functions of γδ T cell subsets in a gnotobiotic pig model of human rotavirus infection[J].Comp Immunol Microb,2012;35:289-301.
24 Meuter S,Eberl M,Moser B.Prolonged antigen survival and cytosolic export in cross-presenting human γδ T cells[J].Natl Acad Sci USA,2010;107:8730.
25 Qin G,Liu Y,Zheng J et al.Phenotypic and functional characterization of human γδ T-cell subsets in response to influenza A viruses[J].J Infect Dis,2012;205:1646-1653.
26 Hudspeth K,Fogli M,Correia D,V et al.Engagement of NKp30 on Vδ1 T cells induces the production of CCL3,CCL4,and CCL5 and suppresses HIV-1 replication[J].Blood,2012;119:4013-4016.
27 Couzi L,Lafarge X,Pitard V et al.Gamma-delta T cell expansion is closely associated with cytomegalovirus infection in all solid organ transplant recipients[J].Transpl Int,2011;24:e40-2.
28 Costa G,Loizon S,Guenot M et al.Control of Plasmodium falciparum erythrocytic cycle:γδ T cells target the red blood cell-invasive merozoites[J].Blood,2011;118:6952-6962.
29 Wang F,Herzig C T A,Chen C et al.Scavenger receptor WC1 contributes to the γδ T cell response to Leptospira[J].Mol Immunol,2011;48:801-809.