丙戊酸鈉在γδT細胞對肺癌A549細胞免疫中的作用
杜發旺 李瓊雅 王 娟 杜先智 (重慶醫科大學附屬第二醫院呼吸內科,重慶400010)
根據T細胞表面抗原受體αβTCR和γδTCR的不同,將外周血T細胞分為αβT細胞和γδT細胞。γδT細胞大量分布于黏膜淋巴組織,不表達CD4+及CD8+分子,是 CD4+、CD8+雙陰性細胞,因此其抗原的處理和提呈不受MHC限制,作用介于固有免疫和適應性免疫之間[1],具有獨特的結構和功能,在腫瘤免疫中發揮著重要作用。γδT細胞主要通過表面受體NKG2D識別表達于肺癌等腫瘤細胞上的MHC-Ⅰ相關分子A(MICA),通過NKG2D-MICA途徑,產生腫瘤免疫[2]。組蛋白脫乙酰酶抑制劑可通過增加細胞內組蛋白的乙酰化程度,調節多種基因的表達水平,并上調相關蛋白的表達,并且觀察到組蛋白脫乙酰酶抑制劑丙戊酸鈉可上調肝癌等腫瘤中MICA蛋白的表達[3,4]。為調控MICA的表達,增強γδT細胞對肺癌細胞的殺傷作用,本文使用組蛋白脫乙酰酶抑制劑丙戊酸鈉(Histone deacetylase inhibitor valproate sodium,HDACI-VPA)為調控劑,研究其對肺癌A549細胞MICA表達的影響,探討其在人外周血 γδT細胞對肺癌 A549細胞免疫中的作用。
1 材料與方法
1.1 材料 肺癌A549細胞株購自美國ATCC公司,RPMI1640干粉及胎牛血清購自美國Gibco公司,唑來磷酸(ZA)及丙戊酸鈉(VPA)購自于美國Sigma公司,Trizon RNA提取試劑、Taq DNA聚合酶、dNTP、markerDL1000等 PCR試劑購自 TaKaRa公司,PCR引物由大連寶生物公司合成,Western blot配膠試劑盒購自碧云天生物技術研究所,IP蛋白裂解液購自南京凱基生物科技發展有限公司,IL-2購自Peprotech公司,淋巴細胞分離液購自中國生科院,LDH毒性檢測試劑盒購自于美國abcam公司(Cat:ab65393),Anti-human gamma delta TCR-FITC(Cat:11-9955)、Mouse IgG1 K Isotype Control FITC(Cat:11-4714)購自美國eBioscience公司,抗-MICA抗體購自美國EPITOMICS公司(Cat:T3305),流式細胞儀(FCM)購自美國Beckman Coulter公司。
1.2 方法
1.2.1 外周血單個核細胞(PBMC)的制備取健康成人外周血40 ml,肝素抗凝。加入等體積的 DHanks液混勻。取2只50 ml離心管,每只加入20 ml淋巴細胞分離液,將與D-Hanks液混勻的外周血沿離心管管壁緩慢加入,在加入過程中保持分界面清晰,2 000 r/min離心20分鐘,小心吸取 DHanks液與血清之間的白色層于10 ml離心管中,離心洗滌3次,每次10分鐘,即得外周血單個核細胞(Peripheral blood mononuclear cell,PBMC)。
1.2.2 γδT細胞的分離純化及刺激擴增 將離心所得的PBMC細胞加入50 ml培養瓶中,再加入含10%胎牛血清的RPMI1640培養基3 ml,在5%CO2、37℃恒溫培養箱中培養3天,然后離心,轉入EP管中,加入 Anti-human gamma-delta TCR-FITC抗體標記γδT細胞、以 Mouse IgG1 K Isotype Control FITC為同型空白對照,37℃培養箱孵育30分鐘后離心,加入適量PBS,經流式細胞儀分離純化γδT細胞,并檢測γδT細胞的純度。將分離純化的γδT細胞加入50 ml培養瓶中,加入3 ml含10%血清、100 U/ml雙抗的RPMI1640培養基中,再加入唑來磷酸(終濃度為300 pg/ml)、IL-2(終濃度為200 U/ml),置于5%CO2、37℃恒溫培養箱中培養,每3天換一次液,培養9~12天,調整細胞濃度為 106ml-1備用。
1.2.3 肺癌A549細胞的培養 將復蘇的肺癌A549細胞株培養于50 ml的玻璃培養瓶中,加入3 ml的含10%胎牛血清、100 U/ml雙抗的RPMI1640培養基,置于5%CO2、37℃恒溫培養箱中,每隔1天換一次液,細胞長到85%左右傳代培養,培養細胞狀態到對數期,備用。
1.2.4 不同濃度的VPA處理A549細胞將對數生長期的A549細胞用RPMI1640調整細胞濃度到105ml-1,六孔板每孔取含有細胞的溶液1ml以及1ml的RPMI1640,并在六孔板中分別加入 VPA 0.5、1.0、2.0、4.0 mmol,使 VPA 終濃度分別為 0.25、0.5、1.0、2.0 mmol/L。在 5%CO2、37℃恒溫培養箱中培養24小時。
1.2.5 PCR技術檢測肺癌A549細胞MICA的轉錄將1.2.4步驟處理的肺癌A549細胞用Trizol法提取總 RNA,紫外分光光度儀測得 OD260 nm/OD280nm值為1.92。再參照TaKaRa逆轉錄試劑盒步驟制取cDNA,并按照下列條件擴增:5×Prime-STAR?Buffer(Mg2+plus)10 μl、dNTP Mixture(各2.5 mmol/L)4 μl、Primer 1(10 μmol/L)1 μl、Primer 2(10 μmol/L)1 μl、模板 DNA 2 μl、DEPC 水調整總量至50 μl。然后設置94℃預變性3分鐘、94℃變性30秒、58℃退火(內參59℃退火)30秒、72℃延伸30秒(內參延伸50秒)、35個循環(內參28個循環)后再72℃延伸5分鐘,即得PCR擴增產物,再用3%的瓊脂糖、以Golden view為顯色劑、TAE為電泳液,100 V恒壓水平電泳,再用凝膠成像儀掃描成像。PCR引物序列見表1。
1.2.6 Western檢測MICA蛋白的變化 將1.2.4處理的肺癌A549細胞提取總蛋白后,用BSA法檢測蛋白濃度,加入上樣 buffer,調整蛋白濃度至4 μg/μl,并在沸水中加熱5分鐘。配制10%的分離膠及濃縮膠,每孔加入60 μg蛋白樣品,電泳、切膠、并用PVDF膜轉膜,用PBST配制的5%脫脂奶粉封閉1小時,再用5%脫脂奶粉按照1∶1 000稀釋一抗(β-actin 內參1∶3 000),4℃過夜封閉,用 PBST 于搖床上洗滌3次,每次10分鐘,用5%脫脂奶粉按照1∶5 000稀釋加辣根過氧化物酶標記的山羊抗兔二抗,37℃孵育1小時,用PBST于搖床上洗滌3次,每次10分鐘;再用ECL作為發光試劑顯影成像并拍照。
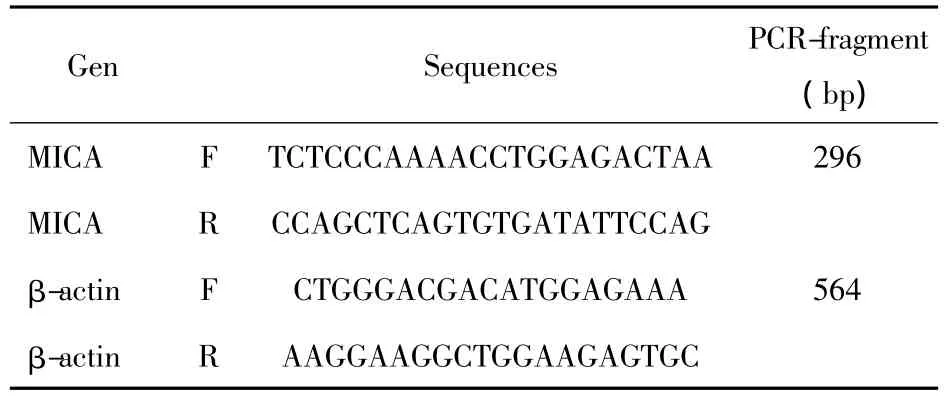
表1 PCR引物Tab.1 The prime of PCR
1.2.7 不同處理時γδT細胞殺傷肺癌A549細胞的細胞毒性檢測 在96孔板中,加入肺癌細胞1 000個,在5%CO2、37℃恒溫培養箱中培養2小時,在肺癌細胞貼壁后,按照下列方式處理:①不加任何試劑的空白對照;②按照效靶比20∶1的比例加入γδT細胞20 000個;③按照效靶比20∶1的比例加入γδT細胞20 000個,并加入終濃度為1 mmol/L的VPA;④按照效靶比20∶1的比例加入γδT細胞20 000個以及1 μg/ml的 MICA-抗體;⑤按照效靶比20∶1的比例加入γδT細胞20 000個,并加入終濃度為1 mmol/L的 VPA 以及1 μg/ml的 MICA-抗體;⑥加入終濃度為1 mmol/L VPA。每組設置5個復孔并用IgG代替MICA-抗體作為空白對照(重復5次),并調整每個孔的培養基為 100 μl,在 5%CO2、37℃恒溫培養箱中培養24小時,并參照LDH法說明書檢測細胞凋亡抑制率,凋亡抑制率=(靶細胞實驗處理組OD值-靶細胞空白對照組OD值)/(靶細胞最大釋放組OD值-靶細胞空白對照組OD值)。
1.3 統計學處理 采用SPSS18.0軟件進行t檢驗及方差分析,結果以x±s表示,樣本均數的兩兩比較采用t檢驗,結果均以P<0.05為差異,表示有統計學意義。
2 結果
2.1 γδT細胞純度的測定 從外周血PBMC中用流式分離出的γδT細胞,經ZA及IL-2刺激擴增培養后,其純度可達89.52%(圖1C),該純度可以滿足γδT細胞的功能研究。圖1A為同型陰性對照,為γδT細胞在外周血中占的比例為5.73%(圖1B)。
2.3 加入VPA后各組內肺癌A549細胞MICA基因轉錄 加入VPA后,各組內的MICA的基因轉錄均較未加入VPA的空白對照組增強,且隨著加入VPA濃度的增加,MICA的基因轉錄增強,在加入VPA為 1 mmol/L時,MICA基因的轉錄較明顯(圖2)。
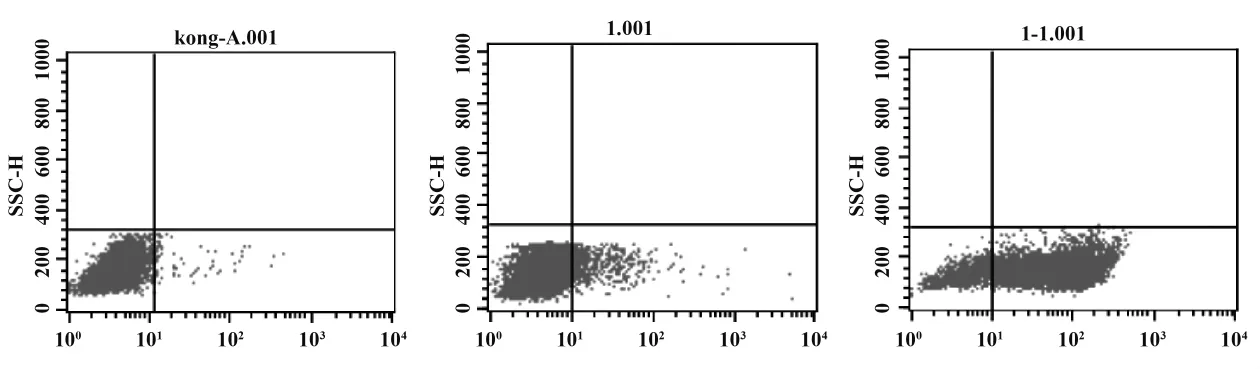
圖1 流式細胞儀檢測γδT細胞的純度Fig.1 The purity of γδT cells with Flow cytometry
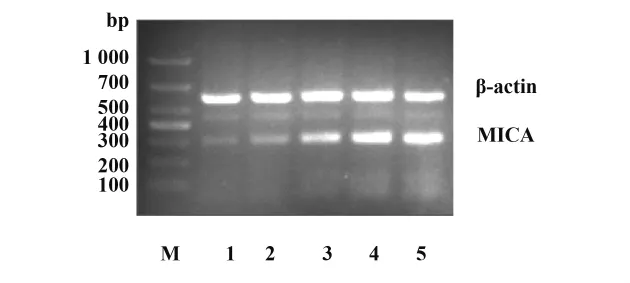
圖2 PCR檢測在VPA不同濃度下肺癌A549細胞MICA的表達Fig.2 The PCR of MICA in lung cancer A549 cell with different concentration of VPA
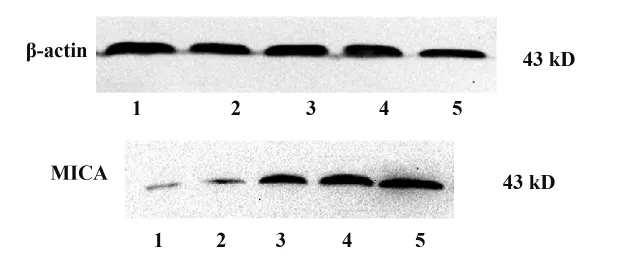
圖3 Western blot檢測在VPA不同濃度下肺癌A549細胞MICA蛋白的表達Fig.3 Expression of MICA protein was detected by western blot with different concentration of VPA
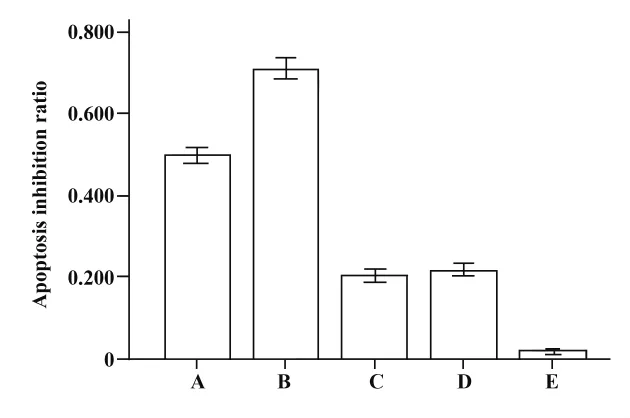
圖4 不同處理時γδT細胞殺傷肺癌A549細胞的細胞毒性結果Fig.4 The results of the cytotoxicity effects of γδT cells on lung cancer A549 lines cells in different treatment group
2.4 加入VPA后各組內肺癌A549細胞MICA蛋白加入VPA后,肺癌細胞上蛋白MICA的表達量較未加入的對照組的明顯增強,且在加入濃度為1 mmol/L的VPA時,MICA蛋白的表達增加明顯(圖3)。
2.5 不同處理組的細胞毒性檢測 不同處理組γδT細胞對肺癌A549細胞凋亡抑制率的LDH檢測結果如圖4所示:γδT細胞組凋亡抑制率為0.49±0.04,表明γδT細胞對肺癌A549細胞有較強的殺傷作用;加入VPA組與未加入VPA組的凋亡抑制率分別為0.70 ±0.03、0.49 ±0.04,差異有統計學意義(P<0.05);加入MICA-抗體封閉組與未加入MICA抗體組相比,細胞毒性較明顯減弱,兩組凋亡抑制率差異有統計學意義(P<0.05);加入VPA、MICA抗體組與只加入MICA抗體組相比,細胞毒性無明顯改變(P >0.05)。
3 討論
腫瘤的發生發展與體內的細胞免疫有著密切聯系,對于腫瘤的治療,除放療、化療、手術外,腫瘤的細胞免疫發揮著越來越重要的作用,常規的腫瘤細胞免疫主要依賴于MHC限制的αβT細胞,以及通過激活適應性免疫系統啟動細胞免疫,而腫瘤可通過某種機制下調人類白細胞抗原、降低機體的反應,逃避免疫監視[5]。然而近期一些研究發現 γδT細胞能對多種腫瘤細胞起到殺傷作用[6,7],且殺傷過程是不受MHC限制的,γδT細胞介于適應性免疫與固有免疫之間,可識別和殺傷那些逃避了αβT細胞攻擊的腫瘤細胞,為腫瘤的免疫治療開辟了一條新的途徑。
在體內,γδT細胞表達各種趨化性因子受體如CXCR3、CXCR4、CCR5、CCR1[8,9],炎癥性趨化因子干擾素誘導蛋白10(IFN inducible protein 10,IP-10)、基質細胞衍生因子1(stromal cell-derived factor,SDF-1 等對 γδT 細胞產生趨化作用[10],γδT 細胞到達腫瘤部位后,產生有效的抗腫瘤免疫應答。γδT細胞主要通過表面受體NKG2D識別表達于肺癌等腫瘤細胞上的MICA蛋白,通過NKG2D-MICA途徑對腫瘤細胞產生細胞毒性作用,MICA蛋白表達于多種腫瘤細胞的胞膜和胞漿中,且主要表達于包膜上,可與NKG2D特異結合,在γδT細胞的腫瘤免疫及細胞毒性作用中起著重要的作用。然而有研究發現腫瘤細胞通過脫落細胞膜上的MICA配體形成分泌型sMICA,導致細胞表面MICA的數量下降,降低了NKG2D與MICA的接觸,從而減弱γδT細胞對腫瘤細胞的細胞毒性,逃避MICA介導的細胞免疫[6]。研究發現腫瘤中組蛋白脫乙酰酶異常表達,使得組蛋白大部分處于低乙酰化狀態,進而細胞的相關蛋白表達下降,對腫瘤細胞的生物學效應產生影響[3];然而組蛋白脫乙酰酶抑制劑可通過增加細胞內組蛋白的乙酰化程度,調節多種基因的表達水平,進而上調相關蛋白的表達[4,11],使得相關的生物學效應增強。基于γδT細胞對腫瘤細胞的生物學作用和組蛋白脫乙酰酶抑制劑的調節作用,本研究探討了γδT細胞對肺癌A549細胞的毒性作用及組蛋白脫乙酰酶抑制劑-丙戊酸鈉在γδT細胞對肺癌A549細胞的毒性作用的正向調節能力。
實驗結果表明加入組蛋白脫乙酰酶抑制劑VPA后,PCR及Western blot顯示A549細胞MICA在基因轉錄水平及蛋白的表達水平上有著明顯的提高,從量-效分析,在 VPA的濃度為1 mmol/L時,MICA基因的轉錄及蛋白的表達增加明顯。
細胞毒性LDH結果顯示γδT細胞對肺癌A549細胞有較強的細胞毒作用,而加入組蛋白去乙酰酶抑制劑VPA后,γδT細胞對肺癌A549細胞的細胞毒性作用明顯地增加。在γδT細胞與肺癌A549細胞作用的過程中,加入MICA抗體,特異性阻斷γδT細胞介導的MICA途徑,LDH結果顯示γδT細胞對肺癌A549細胞的細胞毒性作用明顯減弱,表明MICA的表達可使得肺癌A549細胞對γδT細胞介導的細胞殺傷作用更敏感;而分別加入VPA、MICA抗體和MICA抗體后,LDH結果顯示γδT細胞對肺癌A549細胞的細胞毒性無明顯差別,這也提示VPA是通過改變MICA蛋白的變化起作用的。上述結果表明VPA能增強γδT細胞介導的對肺癌A549細胞的毒性作用,且VPA是通過改變肺癌A549細胞MICA蛋白的表達來改變γδT細胞對肺癌A549細胞的毒性作用的。
在γδT細胞介導的腫瘤免疫研究中,Kang等[5]通過擴增γδT細胞,對小鼠肺鱗癌的過繼免疫治療,觀察到小鼠的成活期延長;另一學者Nakajima等[12]通過對12例晚期肺癌患者回輸入經體外擴增培養的自體γδT細胞,發現對肺癌患者的治療起到了作用;而Bennouna等[13]在腎癌的臨床研究中觀察到,經體外刺激擴增的γδT細胞在大量輸入腎癌患者體內后,盡管延長了患者的生存時間,對腎癌的治療起到了一定的作用,但是部分患者卻出現胃腸功能紊亂以及流感樣癥狀,如寒戰、發熱、疲勞等,γδT細胞的數量也只能少量多次的輸入。
如何提高γδT細胞對腫瘤細胞的殺傷作用,從NKG2D-MICA途徑的調控著手是可能的途徑之一,通過提高腫瘤細胞MICA蛋白的表達,進而增強γδT細胞對肺癌A549細胞等腫瘤細胞的的毒性作用,本研究也證實了其可行性,這也為肺癌等腫瘤的免疫治療找到新的途徑及突破點。但這僅是肺癌A549細胞的體外實驗研究,目前有關γδT細胞的臨床應用仍面臨一些困難,首先γδT細胞在體內外周血單核細胞中占的比例較少,體外培養、擴增出大量較純的γδT細胞是一個關鍵;其次由于個體的抗原差異,從其他健康自愿者獲得的γδT細胞,經體外刺激擴增后輸入患者體內,其安全性也有待進一步證實;再者在體內是否能通過NKG2D-MICA途徑調控γδT細胞對肺癌細胞的殺傷能力,仍需實驗證明,且γδT細胞經MICA途徑作用于肺癌后,如何抑制肺癌A549細胞生長及導致肺癌A549細胞死亡的具體機制還有待更進一步研究;組蛋白去乙酰酶抑制劑VPA聯合γδT細胞應用于肺癌的臨床治療,其療效和安全性還有待深入探討。
1 Holtmeier W,Kabelitz D.Gammadelta T cells link innate and adaptive immune responses[J].Inmmunol Allergy,2005;86:151-183.
2 Caccamo N,Dieli F,Meraviglia S et al.Gamma delta T cell modulation in anticancer treatment[J].Curr Cancer Drug Targets,2010;10(1):27-36.
3 Sorin Armeanu,Michael Bitzer.Natural killer cell-mediated lysis of hepatoma cells via specific Induction of NKG2D ligands by the histone deacetylase inhibitor sodium valproate[J].Cancer Res,2005;65:6321-6329.
4 Johnstone R W.Histone-deacetylase inhibitors:novel drugs for the treatment of cancer[J].Nat Rev Drug Discov,2002;1(4):287-299.
5 Marincola F M,Jaffee E M,Hicklin D J et al.Escape of human solid tumors from T-cell recognition:molecular mechanisms and functional significance[J].Immunol,2000;74:181-273.
6 Wu J D,Higgins L M,Steinle A et al.Prevalent expression of the immunostimulatory MHC class I chain-related molecule is counteracted by shedding in prostate cancer[J].J Clin Invest,2004;114(4):560-568.
7 Kang N,Zhou J,Zhang T et al.Adoptive immunotherapy of lung cancer with immobilized anti-TCR gamma delta antibody-expanded human gamma delta T-cells in peripheral blood[J].Cancer Biol T-her,2009;8(16):1540-1549.
8 Schnurr M,Scholz C,Rothenfusser S et al.Apoptotic pancreatic tumor cells are superior to cell lysates in promoting cross-priming of cytotoxic T cells and activate NK and gammadelta T cells[J].Cancer Res,2002;62(8):2347-2352.
9 Glatzel A,Wesch D,Schiemann F et al.Patterns of chemokine receptor expression on peripheral blood gamma delta T lymphocytes:strong expression of CCR5 is a selective feature of V delta 2/V gamma 9 gamma delta T cells[J].J Immunol,2002;168(10):4920-4929.
10 Poggi A,Carosio R,Fenoglio D et al.Migration of V delta 1 and V delta 2 T cells in response to CXCR3 and CXCR4 ligands in healthy donors and HIV-1-infected patients:competition by HIV-1 Tat[J].Blood,2004;103(6):2205-2213.
11 Glaser K B,Staver M J,Waring J F et al.Gene expression profiling of multiple histone deacetylase(HDAC)inhibitors:defining a common gene set produced by HDAC inhibition in T24 and MDA carcinoma cell lines[J].Mol Cancer Ther,2003;2(2):151-163.
12 Nakajima J,Murakawa T,Fukami T et al.A phase I study of adoptive immunotherapy for recurrent non-small-cell lung cancer patients with autologous γδT cells [J].Eur J Cardiothorac Surg,2010;37:1191-1197.
13 Bennouna J,Bompas E,Neidhardt E M et al.Phase-I study of Innacell gammadelta,an autologous cell-therapy product highly enriched in gamma9delta2 T lymphocytes,in combination with IL-2,in patients with metastatic renal cell carcinoma[J].Cancer Immunol Immunother,2008;57(11):1599-1609.