淫羊藿苷對小鼠力竭游泳時間及力竭恢復小鼠血清生化指標的影響
臧 潔,李寶茹,吳 濤,劉明娟,楊建雄
陜西師范大學生命科學學院,西安 710062
在力竭運動中,機體耗氧增加,導致機體產生大量自由基,從而會造成臟器損傷,對細胞膜的損傷尤為嚴重。過多的自由基可以攻擊細胞膜上的不飽和脂肪酸,引發脂質過氧化作用,從而破壞細胞膜的完整性,使膜流動性降低,通透性增加,離子泵功能下降,細胞代謝紊亂,并導致運動能力下降,誘發運動性疲勞[1]。我們前期的研究表明,淫羊藿苷能夠抑制腎陽虛小鼠血清睪酮含量的下降[2],體外抗氧化活性研究表明,淫羊藿苷能夠清除DPPH·、和OH·,抑制脂質過氧化,提高總抗氧化能力和總還原力[3],提示淫羊藿苷可能有抗疲勞作用。縱艷芳等[4]采用游泳訓練模型研究了淫羊藿苷對大鼠的抗運動疲勞作用,但對運動恢復的作用未見研究報道。本文研究淫羊藿苷對小鼠力竭游泳時間及力竭恢復后血清生化指標的影響,探討其抗疲勞和促恢復作用,為淫羊藿苷進一步的開發和利用提供參考。
1 材料與方法
1.1 實驗動物與材料
昆明系雄性小鼠,購于西安交通大學醫學院動物實驗中心,體重(20±2)g。淫羊藿苷由陜西慧科植物開發有限公司提供,黃棕色粉末,純度93.4%,用0.5%的羧甲基纖維素鈉溶解。化學試劑均為國產分析純。
1.2 動物分組與處理
實驗動物適應性喂養2 d后,隨機分為4組,每組8只,分別為對照組,ICA低劑量組,ICA中劑量組,ICA高劑量組。每天上午分別給低、中、高劑量組以30、90、270 mg/kg ICA,對照組小鼠用等體積的羧甲基纖維素鈉灌胃,連續灌胃12 d。末次給藥后禁食兩小時,然后將小鼠置于21±1℃的水中進行一次性游泳至力竭,記錄游泳時間。力竭的判斷標準:小鼠沉入水中超過10 s,且放在平面無法完成翻正反射[5]。將小鼠置于干燥鼠籠中,恢復24 h后摘眼球采血備用。
1.3 血清生化指標的測定方法
將所采血液常規分離血清,4℃,3000 rpm離心5 min,取上清待測。ALT/AST的活性測定采用2,4-二硝基苯肼法,MDA含量的測定采用TBA(硫代巴比妥酸)比色法,BUN含量的測定采用Fearon反應,SG含量的測定采用葡萄糖氧化酶法。試劑盒均購自南京建成生物工程技術公司。所有指標測定均采用美國BioTek的Epoch超微量微孔板分光光度計完成。
1.4 LDH同工酶電泳及分析
采用不連續聚丙烯酰胺凝膠電泳分離LDH同工酶,用底物顯色劑染色以顯示同工酶位置。顯色后采用FluorChem(5500)System凝膠圖像分析系統分析。
1.5 數據處理
各組之間數據比較采用方差分析,用SPSS10.0統計軟件包進行統計學處理,以ˉX±SD表示結果。
2 結果和分析
2.1 ICA對小鼠力竭游泳時間的影響
由表1可知,ICA低、中劑量組游泳至力竭的時間顯著長于對照組(P<0.05),而ICA高劑量組則與對照組無明顯差異(P>0.05)。
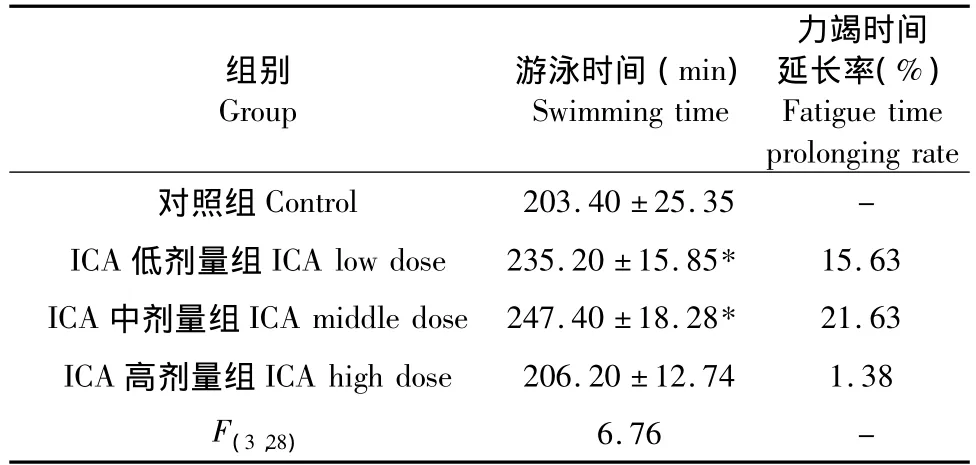
表1 各組小鼠力竭游泳時間的比較(n=8)Table 1 Swimming time of all groups(n=8)
2.2 ICA對力竭游泳恢復小鼠血清生化指標的影響
由表2可以看出,ICA中劑量組ALT活性較對照組低(P<0.01),ICA低、高劑量則無顯著差異(P>0.05);ICA低、中、高劑量組AST活性均較對照組低(P<0.05);ICA低、中劑量組MDA含量顯著低于對照組(P<0.05),而ICA高劑量組則無顯著差異(P>0.05);ICA低劑量組BUN含量顯著低于對照組(P<0.05),ICA中劑量組BUN含量與對照組有極顯著差異(P<0.01);各給藥組SG含量與對照組相比無顯著性差異(P>0.05)。
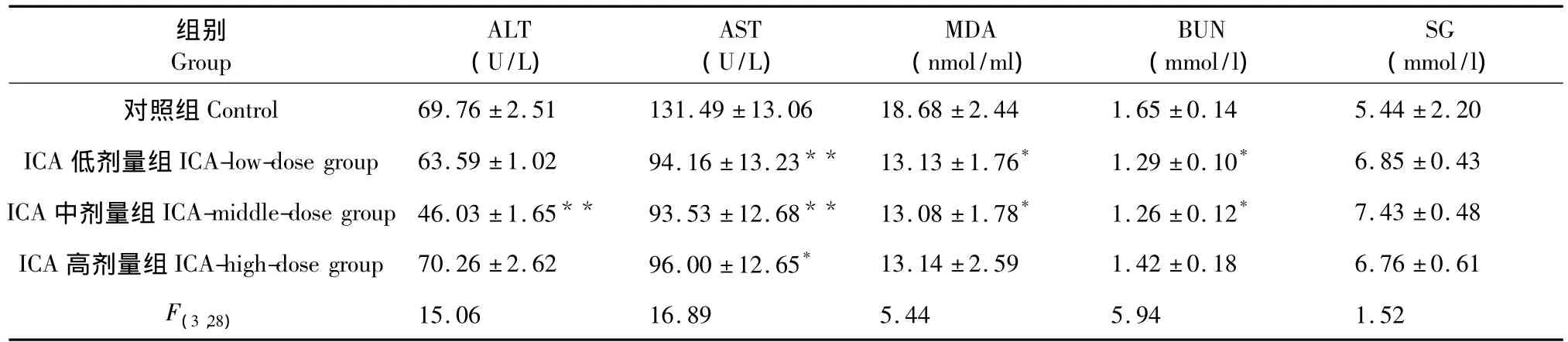
表2 各組小鼠血清生化指標的比較Table 2 Serum biochemical indicators of all groups
2.3 ICA對力竭游泳恢復小鼠血清LDH同工酶的影響
由圖1和表3可見,ICA低、中劑量組LDH總活力較對照組低(P<0.01),ICA高劑量組則無顯著差異(P>0.05);ICA低、中劑量組LDH4-5顯著低于對照組(P<0.05);ICA中劑量組LDH1-2較對照組高(P <0.05)。
3 討論
3.1 ICA對小鼠力竭游泳時間的影響
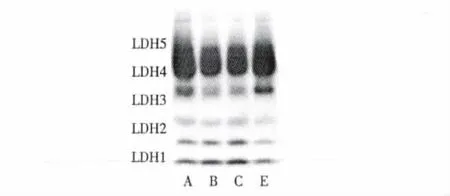
圖1 ICA對力竭運動恢復小鼠血清LDH同工酶的影響Fig.1 The effect of ICA on the activity of LDH isozymes in serum after exhausted swimming and 24 h recovering
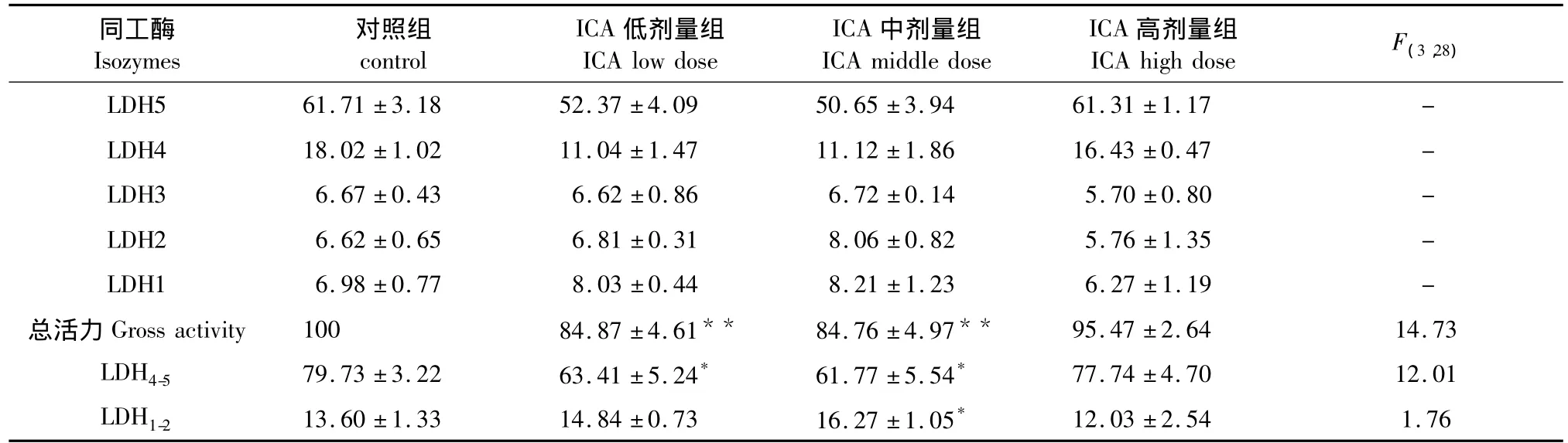
表3 各組小鼠血清LDH同工酶活力的比較Table 3 The activity of LDH isozymes in serum of all groups
游泳至力竭的時間是體能的綜合表現,其不僅反映機體抗疲勞的能力,也反映機體的抗應激能力及對不良環境的適應能力[6]。實驗結果表明,ICA可以延長小鼠游泳至力竭的時間,其中以低、中劑量組最為明顯,顯著長于對照組。縱艷芳等研究結果表明,淫羊藿苷顯著地延長了訓練大鼠游泳至力竭的時間,這與本實驗結果相符,提示ICA可以延緩疲勞的發生。有研究表明,包括黃酮類在內的多酚,在合適劑量時,有抗氧化作用,但劑量過高時,反而有促氧化作用[7]。藥物的抗疲勞作用,一般與其抗氧化作用相關。ICA高劑量組小鼠游泳至力竭的時間明顯低于低、中劑量組,與對照組無明顯差異,可能與高劑量ICA有一定的促氧化作用有關。
3.2 ICA對力竭游泳恢復小鼠血清生化指標的影響
ALT主要存在于肝細胞內,其次是腎臟、心臟和肌肉,血清中此酶活性較低。當肝細胞嚴重損傷或者壞死時,細胞內的該酶即釋放出來進入血液,血清中的ALT活力就會升高,因此,ALT是臨床上進行肝功能測試的一個標準。此外,劇烈的力竭運動,可使骨骼肌細胞膜的通透性發生改變,血清ALT活力也升高。正常情況下,AST存在于組織細胞中,其中心肌細胞中含量最高,其次為肝臟,血清中含量極少,一般測定血清中AST活性來診斷心肌梗塞、肝病及一些肌肉疾病[8]。本實驗結果顯示,ICA中劑量組ALT和AST都極顯著低于對照組,說明一定劑量的ICA對力竭恢復小鼠的肝臟、心臟、骨骼肌均有一定的保護作用,能加快力竭運動后機體的恢復。
力竭運動可導致機體自由基和脂質過氧化水平增加,各種氧自由基能攻擊生物膜中的多不飽和脂肪酸,引發脂質過氧化作用,MDA是脂質過氧化的終產物,既可反映機體內發生脂質過氧化的程度,也可反映生物膜的受損程度[9]。本實驗結果顯示,ICA低、中劑量組MDA顯著低于對照組,說明ICA低、中劑量組可以消除自由基的攻擊,降低力竭恢復狀態下MDA生成,保護機體,對延緩運動性疲勞的發生有積極的作用。
BUN是體內蛋白質和氨基酸等物代謝的終產物,在運動時,BUN可以評定運動負荷量的大小,負荷量越大,BUN的增加就越明顯。本實驗低、中劑量給藥組小鼠游泳至力竭的時間比對照組和高劑量給藥組長,即運動負荷量相對較大,一般會使BUN的含量顯著增加。經24 h恢復,低、中劑量給藥組的BUN反而比對照組和高劑量組低,提示低、中劑量ICA可以促進BUN的清除,促進疲勞小鼠的恢復。
正常情況下,SG的來源和去路維持一個動態平衡,使得SG濃度保持相對穩定。而在長時間力竭運動中,若無外界糖源的補充,可能會造成低血糖,產生疲勞。但正常情況下,SG恢復較快。本研究的結果說明經過24 h的恢復后,各組小鼠的血糖濃度基本恢復,水平已趨于一致。
3.3 ICA對力竭游泳恢復小鼠血清LDH同工酶的影響
越來越多的實驗證明,LDH同工酶活力與運動性疲勞有關[10]。LDH1、LDH2主要催化乳酸脫氫轉變成丙酮酸的反應,而LDH4和LDH5主要催化丙酮酸還原為乳酸的反應。在力竭運動中,機體供氧量不足,儲存的糖原分解為血糖后,主要是通過無氧酵解產生乳酸的反應為機體提供能量。本研究結果顯示,小鼠力竭游泳恢復24 h后,ICA低、中劑量組LDH總活性和LDH4-5顯著低于對照組,提示一定劑量的ICA可以修復受損傷的組織,使釋放到血液中的LDH減少,另一種可能的機制是ICA可以減少乳酸的堆積,LDH的活性可能適應性降低。而ICA中劑量組LDH1-2顯著高于對照組和其他給藥組,說明中劑量ICA可以加快乳酸的清除。由此可推知,中劑量ICA組通過減少乳酸的生成和加快乳酸的清除來緩解運動性疲勞,這與ICA中劑量組顯著延長小鼠游泳至力竭的時間相一致。
縱艷芳等采用游泳訓練模型,對大鼠力竭后即刻進行實驗取樣,測定血清中的生化指標以及心肌組織的SOD、MDA和脂褐素的含量。結果表明,淫羊藿苷增加了運動大鼠的乳酸脫氫酶活性,加快血乳酸和尿素氮的清除,顯示出了積極的抗運動性疲勞作用,并顯著增強了運動大鼠心肌SOD活性,加快MDA的清除,減少了脂褐素在心肌組織中的積累,具有保護細胞的作用及增強機體適應運動負荷的能力。大鼠力竭即刻采樣指標和本實驗的恢復后小鼠血清指標結果提示,ICA可以抗運動性疲勞和促進運動后疲勞的恢復。
本研究結果表明,ICA通過多方面作用對機體進行保護,緩解運動性疲勞。ICA低、中劑量組都能顯著延長小鼠游泳至力竭時間,但綜合血清中的生化指標,ICA中劑量組對于推遲疲勞的發生以及促進運動后疲勞的恢復有更好的作用。ICA對人體是否有抗疲勞作用,是否可提高人體的運動能力,值得進一步研究。
1 Cao HX(曹海信),Zhao QQ(趙啟權),Li SM(李世明).Study progress in free radical and sport fatigue.Sichuan Sports Sci(四川體育科學),2006,(4):33-35.
2 Bao Y(包宇),Yang JX(楊建雄),Sun RG(孫潤廣).Icariin rescues the downregulated testosterone and testicle androgen receptor expression in kidney yang deficient mice.Chin J Biochem Mol Biol(中國生物化學與分子生物學報),2011,27:174-179.
3 Bao Y(包宇),Yang JX(楊建雄),Sun RG(孫潤廣).Antioxidant effects of icariin and icarisideⅡ in vitro.J Jilin Univ(吉林大學學報),2012,38:423-428.
4 Zong YF(縱艷芳),Jiao XC(焦賢春),Shang ML(尚茂林).The experimental study on anti-exercise-induced fatigue of rat of the Icariin.J Jilin Inst Physical Education(吉林體育學院學報),2010,26(2):90-92.
5 Thomas DP,Marshall KI.Effect of repeated exhaustive exercise on myocardial subcellular membrane structure.Int J Sports Med,1988,9:257-260.
6 Hou GX(侯改霞),Yang JX(楊建雄).Effects of extract from Forsythia suspensa leaves tea on antioxidant enzymes and isozymes of LDH in cardiac muscle of mice at exhaustion and recovery.Chin J Sport Med(中國運動醫學雜志),2006,25:90-92.
7 Gong JY(龔金炎),Hong H(洪輝),Wu XQ(吳曉琴),et al.Advances in study on prooxidation and cytotoxicity of flavonoids.Chin Tradit Herb Drugs(中草藥),2008,39:1905-1909.
8 Peng L(彭莉),Wang QR(王啟榮),Bi QY(畢秋蕓).The effects of soy active peptide supplement on serum LDH、ALT、AST Level in rats after incremental exercise.J Beijing Sport Univ(北京體育大學學報),2008,31:199-201.
9 Flohr L,Fuzinatto CF,Melegari SP,et al.Effects of exposure to soluble fraction of industrial solid waste on lipid peroxidation and DNA methylation in erythrocytes of Oreochromis niloticus,as assessed by quantification of MDA and m5dC rates.Ecotoxicol Environ Saf,2012,76:63-70.
10 Zhou JL(周君來),Wang J(王健).Impacts of FDP on enzymes and free radical metabolism of both myocardium and serum in exercise-induced fatigue rats.J Beijing Sport Univ(北京體育大學學報),2005,28:1082-1085.

