溫脾通絡開竅法對阿爾茨海默病大鼠學習記憶及海馬Tau蛋白磷酸化表達的影響1)
吳 林,楊進平,溫惠娟,王青碧,蔡鑫昆,畢信亞,麻小梅,趙海濤
阿爾茨海默病(AD)又稱老年性癡呆,是一種以進行性記憶障礙和智能衰退為主要臨床特征的中樞神經系統退行性疾病[1]。AD發病機制極其復雜,病因學尚不清楚,其典型的病理特征是老年斑(SP)形成、神經纖維纏結(NFT)及膽堿能神經元的變性、壞死。其中,NFT的數量和患者的癡呆程度呈明顯的正相關,被認為是AD患者的神經元退化的病理基礎[2],是AD的核心病理改變。NFT的主要成分是由異常過度磷酸化的Tau蛋白聚集而形成的雙螺旋(PHFs)。
本實驗首先應用腦立體定位技術向大鼠右側海馬注射岡田酸建立AD大鼠動物模型,采用經典的Morris水迷宮實驗,對AD大鼠動物模型進行篩選并觀察溫脾通絡開竅法對AD大鼠學習記憶障礙的改善作用,以及采用蛋白免疫印跡法檢測AD大鼠海馬組織Tau蛋白磷酸化總量,旨在進一步探討溫脾通絡開竅湯抗AD的作用及機制。
1 材料與方法
1.1 實驗動物 3月齡,SPF級雄性SD大鼠60只,體重200g±20 g,由廣西醫科大學動物中心提供(編號:SCXK2007-0002)。
1.2 實驗藥物 溫脾通絡開竅方(黃芪30g,益智仁10g,三七10g,石菖蒲10g,何首烏10g,絞股藍10g),由江蘇江陰天江藥業有限公司提供中藥配方顆粒;石杉堿甲,浙江震元制藥有限公司生產(批號:120303)。
1.3 實驗試劑 岡田酸(OA),Sigma公司生產(批號:04511);二甲亞砜(DMSO),Amresco公司生產(批號:0231);兔抗大鼠磷酸化 Tau抗體(PHF-1,批號:ab32057)購自 Abcam 公司;HRP標記羊抗兔二抗、BCA蛋白濃度檢測試劑盒、免疫印跡化學發光試劑、蛋白提取試劑盒、預染的蛋白Marker、PVDF膜購自上海碧云天生物技術有限公司。
1.4 主要器材和設備 腦立體定位儀(ST-3ND型腦立體定位),成都儀器廠生產;Morris水迷宮設備全套(包括 Morris水迷宮,電腦攝像系統,配套軟件分析系統),北京中科院生理所生產;Bio-Rad垂直板式電泳槽儀,美國;DSCT-200數碼相機(日本SONY)。
1.5 方法
1.5.1 造模方法 60只SD大鼠適應性喂養1周,大鼠經10%水合氯醛3mL/kg腹腔注射麻醉后,固定于大鼠腦立體定位儀上。手術器械均消毒,常規皮膚消毒,無菌操作。52只大鼠實施OA右側的海馬CA1區注射造模,另8只作為空白對照組。參照George等的《大鼠腦立體定向圖譜》,選擇右側海馬CA1區(前囟后3.6mm,中線旁開2.4mm,顱骨表面下2.7mm),為注射靶區。用特制三棱針手動鉆顱骨至一定深度,再用微量進樣器旋轉鉆動至微有落空感,隨后自頭皮表面垂直進針4.0 mm(微量進樣器注射鋼針外套一次性介入導管并固定,針尖留出4.0mm),將溶于10%DMSO的 OA 1.5μL(0.4mmol/L)緩慢(10min)注入,留針15min以保證藥液充分彌散,然后緩慢拔出針。空白組大鼠于相同部位注射等體積的10%DMSO。間隔2d后以相同的方法再注射1次。所有大鼠術后傷口均涂適量紅霉素軟膏,術后腹腔注射青霉素鈉每只80 000U,以防感染。
1.5.2 Morris水迷宮的制作及實驗方法 MWM參照相關文獻制作[3],水迷宮置于房間的中央,為一圓形不銹鋼水池,直徑200cm,高50cm,水深30cm。水池內壁被漆為黑色,池水用黑炭墨均勻的染成黑色,水溫保持在(22±1)℃。將水池等分為4個象限,即第一、第二、第三、第四象限,在第三象限中心放置一黑色平臺,平臺為圓形,直徑11cm,平臺高28cm(即平臺低于水面2cm,稱隱藏平臺)。水迷宮正上方2m高處裝有一個小型攝像機,并與另一房間的錄像機和監視器連接,記錄大鼠的逃避潛伏期及跨越平臺次數。MWM實驗共進行4.5d,實驗方法如下。
1.5.2.1 定位航行實驗 共進行4.5d,每天分上下午2個時間段,每個時間段每只大鼠訓練4次。每次均隨機順序從不同等分水池的4個起點將大鼠面向池壁放入池中(大鼠頭向上,以防溺水),記錄其60s內成功進駐平臺(大鼠找到平臺并滯留其上5s為成功)所需時間(即逃避潛伏期)。如在60s內大鼠不能成功進駐平臺,則將其引上平臺并令其停留10s,記錄逃避潛伏期為60s,每次訓練間隔時間為60s。每一時間段內4次潛伏期的算術均數作為這一時間段的成績。
1.5.2.2 空間探索實驗 實驗最后半天撤除平臺,從第一象限池壁中點將大鼠放入水中,記錄2min內大鼠跨越第三象限平臺次數。
1.5.3 AD模型篩選 造模14d后進行AD模型篩選,按照上述定位航行實驗方法,參照趙憲林等[4]的AD大鼠模型篩選標準進行篩選,即以空白組大鼠逃避時間的均值為參考值,計算模型組大鼠各時段成績的平均逃避潛伏期與參考值之差占該鼠的平均逃避潛伏期時間的比例,該值>20%定為AD大鼠。造模組大鼠癡呆個數占造模組大鼠總數的比率為造模成功率。造模2周內造模組大鼠死亡4只,空白組死亡1只。經過篩選,造模組48只大鼠符合上述要求的大鼠40只進行后續實驗,造模成功率為76.9%。
1.5.4 分組及給藥劑量 將造模成功的模型組大鼠40只隨機分為溫脾通絡開竅湯高、中、低劑量組,西藥對照組,模型組。每組8只AD模型大鼠。空白對照組7只。造模第20天開始灌胃給藥,給藥量均按人與大鼠體表面積系數比確定,以臨床人用藥等效劑量作為中劑量,中藥高、中、低劑量組大鼠的給藥劑量分別為4.15g/kg、8.3g/kg、16.9g/kg,西藥組給藥劑量為3 mg/kg。模型組及空白對照組均予相應體積的雙蒸水灌胃。各組大鼠按劑量每天灌胃給藥一次,共21d。治療期間,模型組、中藥低劑量組、中藥中劑量組各死亡2只,西藥組、中藥高劑量組各死亡1只。
1.5.5 取材 各組AD大鼠治療21d后進行水迷宮實驗,待水迷宮實驗后,在冰臺上采取心臟灌注斷頭取腦,迅速分離右側海馬組織放入-80℃冰箱凍存。
1.5.6 Western-blot檢測大鼠海馬Tau蛋白異常磷酸化
1.5.6.1 組織蛋白提取 ①從凍存的-80℃冰箱里取50mg海馬組織,盡量將其剪碎;②將剪碎的組織塊放入勻漿器中,加入含有PMSF的緩沖液400μL,然后置于冰塊上勻漿;③在恒溫4℃下15 000r/min離心5min,再取上清液分裝在0.5mL凍存管中并放入-20℃冰箱保存備用。
1.5.6.2 Tau蛋白含量的測定 ①取1.5mL離心管,每管加入考馬斯亮藍溶液(4℃儲存)1mL。在室溫下放置30min后備用。②取一管考馬斯亮藍加0.15mol/L NaCl溶液100μL,混勻后放置2min,用于檢測空白樣品。③取一管考馬斯亮藍加入95μL 0.15mol/L NaCl溶液和5μL待測蛋白樣品,混勻后靜置2min,再進行檢測。
1.5.6.3 SDS-PAGE凝膠電泳 ①安裝玻璃板。②加入TEMED后立即搖勻即可凝膠。灌10%分離膠時,用10mL槍頭吸取5mL膠沿玻璃放出,待膠面升到綠帶中間線高度。在分離膠上覆蓋一層水,以隔絕空氣。③待水和凝膠之間出現一條清晰的線條時,倒去水并用吸水紙將水吸干。④加入TEMED后立即搖勻灌膠。在剩余空間灌滿4%濃縮膠,立即將梳子插入濃縮膠中。室溫垂直靜置,等待凝膠聚合。⑤用水沖洗濃縮膠,將其放入電泳槽中。⑥加入已煮沸變性的蛋白樣品,上樣量一致。⑦在電泳槽中加入1X電泳緩沖液。電泳時間3 h左右,電壓為40V。至溴酚藍剛跑出則終止電泳。
1.5.6.4 轉膜 ①切取6張大小與轉印區域一樣的濾紙,然后把它們浸泡在電轉緩沖液中。切取同樣大小的PVDF膜,置于有超純水的平皿器里2h。②在PVDF膜上墊3張濾紙,將凝膠平鋪其上,再放上3張濾紙,用玻璃棒在濾紙面上滾動除去各層氣泡,然后放入電轉儀內,用60V電轉2h(注:在槽的一邊放入一塊冰來降溫)。③轉完后將膜用1X麗春紅染液染5min。然后用水沖洗掉沒染上的染液,再將膜晾干備用。
1.5.6.5 免疫反應 ①將膜用TBS從下向上浸濕后,移至含有封閉液的平皿器中,室溫下在脫色搖床上搖動封閉1h。②傾去封閉液,加入用TBST稀釋的一抗;室溫下孵育1h左右后,在室溫下,用TBST在脫色搖床上洗兩次,每次10min;再用TBST洗1次,10min。③準備二抗稀釋液并與膜接觸,沖洗方法同上。
1.5.6.6 化學發光,顯影,定影 ①將A和B兩種試劑在保鮮膜上等體積混合;1min后,將膜蛋白面朝下與此混合液充分接觸;1min后,將膜移到另一保鮮膜上,去盡殘液,包好,放入X-光片夾中。②在暗室中用X膠片感片、顯影及定影。③用凝膠圖像分析將膠片進行拍照,用凝膠圖像處理系統分析目標帶的分子量和凈光密度值。
2 結 果
2.1 一般行為觀察 向已完全麻醉的大鼠右側海馬注射OA 5 h后,大部分大鼠蘇醒,8h后大鼠能全部蘇醒,本實驗未見有麻醉過量而死亡的大鼠。蘇醒后大鼠靜臥或能稍活動,有的甚至可以進食。在未進行AD大鼠篩選前,空白組大鼠較模型組大鼠表現活躍些,模型組大鼠絕大多數表現懶散少動,喜靜臥在鼠籠暗區,敲打鼠籠大多數只是睜眼,輕微動彈一下,而空白組大多數大鼠會睜眼張望,甚至起身走動。經過3周治療后,觀察到中藥高、中劑量組,西藥組和正常組大鼠反應比較敏捷,一有動靜即睜眼,跑到柵欄張望,對氣味也比較敏感,實驗人員取帶香味的食物置籠邊,大鼠立即跑來,鼻腔作嗅物狀,而低劑量組和模型組大鼠絕大多數在原地不動,只是稍許睜眼,反應遲鈍。
2.2 定位航行試驗 模型組潛伏期5d內的變化較緩慢,無明顯縮短。各治療組潛伏期隨著訓練天數的增加而明顯縮短,且各中藥組逃避潛伏期之間存在一定遞減關系。模型組平均潛伏期比空白組明顯延長(P<0.01)。西藥組和高、中、低劑量組平均潛伏期較模型組明顯縮短(P<0.01)。高劑量組與西藥組比較差異有統計學意義(P<0.01)。中、高劑量組差異有統計學意義(P<0.01)。模型組大鼠學習記憶行為能力明顯受損,而溫脾通絡開竅湯對AD模型大鼠有一定程度的保護作用,并且中藥各組之間存在一定的量效關系。
2.3 空間探索試驗 模型組較空白組大鼠成功找到平臺的次數明顯下降(P<0.01)。中藥組與模型組相比,差異有統計學意義(P<0.01)。西藥組與高、中劑量組比較差異有統計學意義(P<0.05或P<0.01),與低劑量組比較差異無統計學意義(P>0.05),高劑量組與中劑量組比較差異有統計學意義(P<0.01)。詳見表1。
表1 各組學習成績比較(±s)
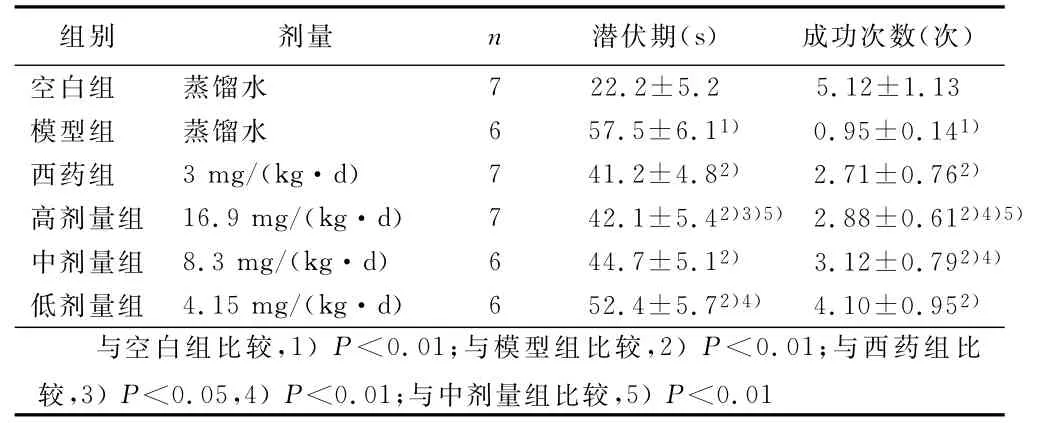
表1 各組學習成績比較(±s)
?
2.4 各組大鼠海馬組織磷酸化Tau蛋白含量比較 模型組與空白組比較含量顯著增加(P<0.01),低量組、西藥組與模型組比較差異無統計學意義(P>0.05),中藥高、中劑量組與模型組比較顯著降低(P<0.05或P<0.01),與西藥組比較差異有統計學意義(P<0.01),但中藥高、中劑量組之間差異無統計學意義(P>0.05)。詳見表2。
表2 各組大鼠海馬組織磷酸化Tau蛋白的表達(±s)
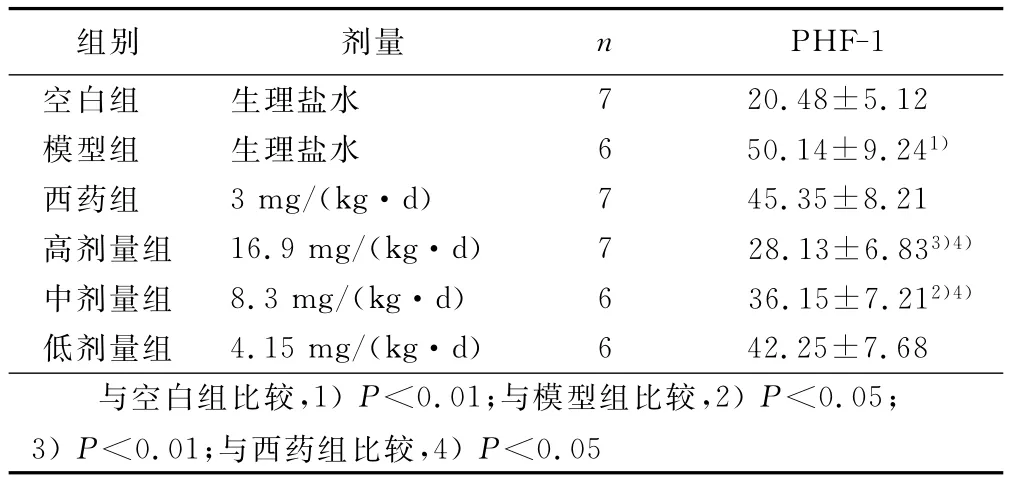
表2 各組大鼠海馬組織磷酸化Tau蛋白的表達(±s)
組別 劑量 n PHF-1空白組 生理鹽水 7 20.48±5.12模型組 生理鹽水 6 50.14±9.241)西藥組 3mg/(kg·d) 7 45.35±8.21高劑量組 16.9mg/(kg·d) 7 28.13±6.833)4)中劑量組 8.3mg/(kg·d) 6 36.15±7.212)4)低劑量組 4.15mg/(kg·d) 6 42.25±7.68與空白組比較,1)P<0.01;與模型組比較,2)P<0.05;3)P<0.01;與西藥組比較,4)P<0.05
3 討 論
Tau蛋白是一種能促使微管裝配的微管相關蛋白,由于以磷酸化和糖基化為主的Tau蛋白異常翻譯后修飾與神經原纖維纏結關系密切[3],Tau蛋白的異常過度磷酸化可能是神經元纖維退變的早期病理表現。因此,對于Tau的研究已經成為近年AD研究領域的一大熱點。近年來研究顯示,Tau蛋白的異常過度磷酸化不僅使其喪失催化微管裝配和穩定微管結構的正常生物活性,還使其變成具有細胞毒性的分子,導致神經元纖維的形態異常和軸漿轉運障礙[5],并促使其自身沉積為NFT,還可獵獲正常的微管相關蛋白,使微管崩解、軸突變性、細胞退化及丟失,最終導致AD患者的認知功能受到嚴重的損害。
從實驗結果中可以看出,岡田酸誘導的AD模型大鼠海馬組織磷酸化Tau蛋白總量增加,經過溫脾通絡開竅方治療后,中藥組AD模型大鼠海馬組織磷酸化Tau蛋白總量均有不同程度的下降,其中以中藥高、中劑量作用明顯,可見中藥組之間存在一定的量效關系,當溫脾通絡開竅方達到一定劑量時對磷酸化的Tau蛋白的抑制作用顯著。有關體外研究表明[6]當Tau蛋白異常磷酸化后,釋放出的Tau蛋白重新恢復其促微管的活力,而溫脾通絡開竅方恰能降低異常磷酸化的Tau蛋白水平,使其去磷酸化增多,這有可能逆轉了AD的神經纖維纏結的病理改變。
老年性癡呆屬中醫“善忘”、“癡呆”、“郁癥”等范疇,與增齡密切相關。中醫學認為心主神志,主持人的精神、意識、思維及情感活動,包括了現代醫學中樞神經系統的大部分功能在內。現代醫學將本病定位于腦,即是定位于中醫學之心。痰生于脾,而神由心主,痰必先蒙心竅,而后心神昏聵發為健忘、癡呆。因此本病發病機制主要在心脾兩臟。
痰濁的產生是衰老過程中的重要變化之一,是加速衰老的基本病理因素。“脾為生痰之源”,脾失健運,水濕不化,聚而為痰。痰之所生,當責之于脾。清代陳士鐸在《辨證錄·呆病門》中論及本病形成時說“起于肝氣之郁;其終也,由于胃氣之衰”。認為脾胃虛弱,運化不足為本病痰濁生成的關鍵之一,而“痰勢最盛,呆氣最深”,則進一步強調了癡呆程度與痰濁的關系。在治療方法中也談到“治呆無奇法,治痰即治呆”,認為溫脾化痰開竅是本病治本之法。
中醫素有“老人多瘀”、“久病必瘀”之說。人至老年,脾氣不足,氣化無源,推動無力,氣不行血,血流失暢,郁于心絡乃成血瘀。另一方面,痰濁蒙心,痰瘀相關,亦可加重血行不暢。唐容川在《血證論》中指出:“凡心有瘀血,亦令健忘……血在上則濁蔽而不明矣。凡失血家猝得健忘者,每有瘀血”。說明瘀血痹阻心絡是本病又一重要病理基礎。
中醫學自古即腎虛、脾虛并存,其治有補腎、補脾之爭。生命既始,先天之源概止,性命全賴水谷之養。脾氣運化,化生水谷精微,其氣升清,將水谷之精上輸于心肺,維持心神及全身生命活動。若脾虧氣化不行,谷精不得布散,積而為痰成瘀;痰蒙清竅,瘀阻心絡,心神失養,發為健忘、癡呆。腎為先天之本,脾為后天之本。老年人脾氣既虧,納減運弱,化源不足,先天失充則腎精化生乏源,腎虛髓減。腎氣不足則志氣衰,不能上通于心,故迷惑善忘也。所以現代所用補腎填精方藥治療此病也能收到一定的療效。但是在本病發病過程中,脾虛為本,故填精補血之法并不能取得令人十分滿意的療效。總之,AD早期以脾虛為本,痰蒙心竅,心絡不暢,心神失常為發病關鍵,至后期痰瘀痹阻,膠著不解,心竅閉塞,脾腎兩虧,遷延難愈。
針對AD病機演變過程中的關鍵環節,采用溫脾通絡開竅之法,擬定溫脾通絡開竅方進行中醫藥早期干預,以期在疾病早期控制病情,防止病情發展。方中黃芪性微溫、味甘,歸肺、脾經,功專補氣升陽;益智仁性溫,味辛,入脾、腎經,溫脾暖腎,固氣澀精;二藥相須為用,益氣補陽,溫腎助脾,既資后天之源,又強運水化濕之功以絕痰濁之源,共為主藥;益智仁復取其益火補土之意,溫腎陽以助脾陽。三七性溫,味甘、微苦,歸肝、胃經,通絡活血;石菖蒲性溫,味辛、苦,入心、脾、肝經,和中祛濕辟濁,豁痰開竅醒神;三七配黃芪,可加強通絡之力,石菖蒲伍益智仁,又能醒脾助運,共為臣藥。何首烏性微溫,味苦、甘、澀,入肝、腎經,補肝腎,益精血,以補精血之不足。絞股藍性寒,味甘、苦,歸脾、肺經,溫脾化痰,又因其性寒可防止溫脾通絡之藥溫燥傷陰之弊,共為佐使。諸藥相合,補而不膩,溫而不燥,既可溫脾治本,又能通絡祛痰除標,開竅醒神改善癥狀。
臨床上以溫脾通路開竅法[7,8]治療AD患者療效顯著,從而也證實了AD以脾虛為本,痰蒙心竅,心絡不暢,心神失常為發病關鍵,及至后期痰瘀痹阻,膠著不解,心竅閉塞,脾腎兩虧,遷延難愈的病理演變過程。本實驗的結果也反證了溫脾通絡開竅法防治AD的現代機制所在,其對AD大鼠學習記憶障礙具有明顯的改善作用,且可降低AD大鼠海馬Tau蛋白異常磷酸化水平,這也可能是其抗AD的作用機制之一。
[1]丁新生.重視 Alzheimer病的診治[J].臨床神經病學雜志,2005,18(4):241-243.
[2]陳羅西,郭玲玲,李亮.Morris圓形水迷宮的應用及其相關檢測指標分析[J].遼寧中醫藥大學學報,2008,8(10):55-57.
[3]Gong CX,Liu F,Grundke-Iobal I,etal.Poet-tmnslatiorud modifications of Tau protein in Alzheimer’s disease[J].J Neural Transm,2005,112(6):813-838.
[4]趙憲林,方秀斌,李東培.大鼠血管性癡呆模型制作[J].中國醫科大學學報,2002,31(3):166-167.
[5]Alonso AC,Grundke-Iqbal I,Iqbal K.Alzheimer’s disease hyperphosphorylated Tau sequesters normal Tau into tangles of filaments and disassembles microtubules[J].Nat Med,1996,2(7):783.
[6]Hoyer S,Lannert H.Long-term effects of corticosterone on behav-ior,oxidative and energy metabolism of parietotemporal cerebral cortex and hippocampus of rats:Comparison to intracerebroventricular streptozotocin[J].J Neural Transm,2008,115(9):1241-1249.
[7]吳林,陳煒,張其瑞,等.溫脾通絡開竅法治療老年性癡呆的臨床體會[J].遼寧中醫雜志,2009,11(36):1901-1902.
[8]李鵬,吳林.溫脾益神湯治療老年癡呆20例[J].新中醫,2009,10(41):80.

