Ghrelin對大鼠心肌梗死后血管重構的影響及機制研究
袁明杰 孔 彬 權 力 胡紅耀 王少波 唐艷紅
武漢大學人民醫院心血管內科,湖北武漢 430060
心肌梗死(MI)后心室主要重構過程包含心室擴張、纖維化,最終導致心功能異常。有療效的誘導血管再生對于MI后的慢性心肌缺血和相關的重塑是一種很有前景的治療方法[1]。血管內皮生長因子(VEGF)是血管生成的一個重要引發劑[2]。Ghrelin是從人類和大鼠胃里分離出的一個28-氨基酸多肽,并在1999年認定為一個GHS-R1A型的內源性配體,這已被證明作用在心臟和血管里[3-4]。人工培養的心肌細胞能夠合成Ghrelin。Ghrelin除對心血管系統有保護作用外,Ghrelin及其受體在人類微血管內皮細胞(HMVEC)中有表達,并且Ghrelin通過ERK2信號的激活,刺激HMVEC的增殖、遷移和血管生成[5]。另外,Ghrelin表達量的減少是血管生成后老化相關損害的影響因素之一[6]。目前,Ghrelin是否能促進心肌梗死后的活體動物模型心肌血管生成及其可能的機制仍未明確。因此,本研究旨在通過建立心肌梗死大鼠模型,研究Ghrelin對心肌血管在成的影響,并試圖闡明其相關的機制。
1 材料與方法
1.1 主要試劑與儀器
Ghrelin購自美國Alexis公司;日本Bioer定量PCR檢測系統;S-P免疫組化染色試劑盒購自于深圳晶美生物科技公司;DBA顯示試劑盒購自于深圳晶美生物科技公司;抗兔多克隆抗體及化學發光工具包購自于碧云天生物技術研究所;α-平滑肌肌動蛋白(α-SMA)購自于武漢博士德公司。
1.2 動物模型制作及分組
清潔級健康雄性SD大鼠,10周齡,體重為200~250 g購自華中科技大學同濟醫學院實驗動物中心。3%戊巴比妥鈉(30 mg/kg)腹腔給藥麻醉動物后氣管插管,連接小動物呼吸機,然后暴露心臟,在左心耳與肺動脈圓錐之間結扎冠脈前降支制成心肌梗死(MI)模型。納入實驗的雄性SD大鼠65只,隨機分為假手術組(15只),心肌梗死鹽水組(25 只),心肌梗死 Ghrelin 組(25 只)。
1.3 藥物干預
在MI模型成功建立后第7天,開始藥物干預。心肌梗死Ghrelin組大鼠按100 μg/kg皮下注射大鼠Ghrelin,每天兩次,假手術組及心肌梗死鹽水組在相應部位注射生理鹽水,給藥時間為4周。
1.4 實時定量PCR(RT-PCR)方法檢測VEGF mRNA表達
取梗死邊緣區左室心肌組織100~150 g,加入l mL Trizol,冰上勻漿,提取總RNA,并合成cDNA。所有引物均參照GenBank提供的序列,用Primer 5.0設計,由上海生物工程公司合成。引物序列如下:VEGF(15 bp):上游5′-GGGATGATGACGACCTGC-3′,下游 5′CCACTTGTTGGCTTATGTT-3′;GAPD (10 bp):上游 5′-GCAAGTTCAACGGCACAG-3′,下游 5′-TTGCGTTTCCAAAGTAAGTG-3′;反應條件:第1次循環94℃預變性 1 min,其后以94℃變性1 min;56℃退火 15 s,72℃延伸 5s,循環 50 次,最后 72℃5 min終止。反應完成后計算機自動分析Ct值。Ct值定義為每個反應管內的熒光信號到達設定的域值時所經歷的循環次數。根據溶解曲線和產物電泳結果判斷反應產物特異性。
1.5 Western Blot方法分析檢測VEGF蛋白表達
取梗死邊緣區心肌組織,按照蛋白抽提試劑盒說明書分離提取胞漿蛋白。利用12%聚丙烯酰胺凝膠電泳后將蛋白轉移至硝酸纖維素膜上。置于5%脫脂奶粉中室溫封閉l h,加入1∶500稀釋的一抗(VEGF多克隆抗體)和1∶2000的磷酸甘油醛脫氫酶抗體,4℃孵育過夜。T-TBS洗滌3次后加入l∶1500稀釋的辣根過氧化物酶標記的二抗(抗兔IgG)中室溫下孵育1h,然后T-TBS洗膜3次。將膜與增強化學發光(ECL)反應1~5 min后,曝光于X光膠片上,顯影、定影。GAPDH作為上樣內參,目的條帶積分光密度值(OD)與上樣內參積分OD比較,得出的相對OD值為VEGF蛋白表達水平。實驗重復3次,取其平均值為最終結果。
1.6 免疫組織化學法分析新生血管的密度
取梗死邊緣區和非梗死左室心肌組織100~150 mg,免疫組化分析切片組織具體同文獻[7]。小動脈被定義為圓形的,α-SMA 陽性血管直徑>10 μm,直徑>20 μm 為大動脈。通過免疫組化圖像分析系統測量光學密度,分析血管密度。
1.7 統計學方法
應用SPSS 18.0統計學軟件進行數據分析,計量資料以均數±標準差表示(±s),多組間比較用方差分析,組間兩兩比較采用LSD-t檢驗;以Kaplan-Meier曲線分析生存率。以P<0.05為差異有統計學意義。
2 結果
2.1 動物存活情況
24 h內死亡情況比較:心肌梗死鹽水組與心肌梗死Ghrelin組死亡率分別為18.0%和16.0%(P>0.05)。術后存活24 h的45只動物進行Kaplan-Meier生存分析顯示,心肌梗死鹽水組和心肌梗死Ghrelin組28 d生存率比較,差異無統計學意義(66.1%比81.2%,P>0.05)。對死亡動物解剖分析未見到左室破裂,死亡原因多為急性充血性心力衰竭或心律失常。
2.2 Ghrelin對VEGF表達的影響
為了闡明血管生成的機制,在MI后的28 d,收集邊界區的心肌組織進行實時定量PCR方法和Western blot分析方法對VEGF mRNA和VEGF蛋白含量進行測定。與假手術組相比,心肌梗死鹽水組VEGF mRNA表達水平顯著降低;與心肌梗死鹽水組相比,心肌梗死Ghrelin組能顯著提高MI大鼠降低的 VEGF mRNA表達量 (0.65±0.05比0.35±0.03,P<0.05);心肌梗死 Ghrelin 組的 VEGF 蛋白表達水平顯著提高(0.75±0.04 比 0.50±0.03,P<0.05)。Ghrelin促進血管生成可能是由于增加了局部VEGF的表達。見圖1。
2.3 Ghrelin對梗死區和梗死周圍血管密度的影響
與心肌梗死鹽水組相比,心肌梗死Ghrelin組血管α-SMA 在心肌梗死部位密度較高 [(6±2.1)/mm2比 (4±1.8)/mm2(P<0.05)],在梗死邊緣區密度較高[(25±9.5)/mm2比(15±5.7)/mm2,(P<0.05)]。因此認為 Ghrelin 可有效的誘導缺血心肌的血管生成。見圖2。
3 討論
本研究利用MI動物模型證實了通過Ghrelin治療能夠誘導缺血心肌血管生成。Ghrelin對于MI后的血管重建的積極作用在于增加心肌VEGF的表達。
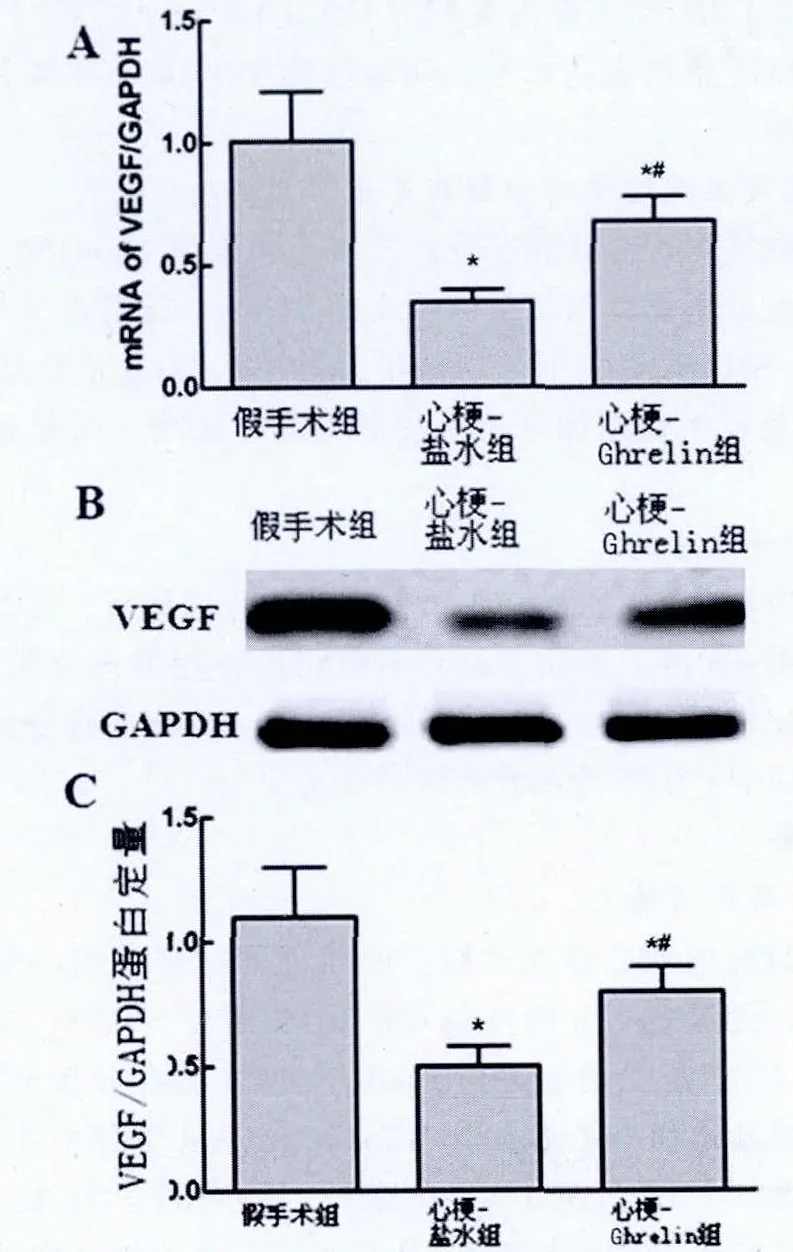
圖1 各組大鼠VEGF mRNA和蛋白表達的定量比較
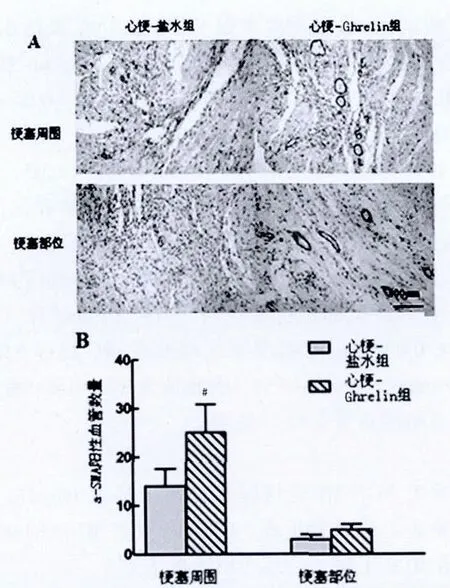
圖2 心肌梗死鹽水組與心肌梗死Ghrelin組在梗死區與梗死周圍血管密度的比較
新生血管形成是梗死愈合過程的一個主要組成部分,特別是在梗死后早期,以及在后期的重塑階段[8]。新生血管有利于建立側支循環并減緩后期重塑的進展。VEGF是一個同型二聚體,在血管新生、動脈粥樣硬化和損傷后應答的血管重塑中起著重要的作用[2,9]。基礎和臨床研究資料表明,VEGF能誘導缺血心肌的血管新生,改善心肌梗死心臟的功能[10-11]。過度表達的VEGF通過促進血管生成和抗凋亡作用改善心功能[8]。在愈合期增加的VEGF表達可促進傷口新生血管的形成[10]。在本模型中,筆者發現Ghrelin進一步增加心肌梗死后28 d動物的α-SMA陽性血管密度。Ghrelin增加心肌邊界區域VEGF mRNA和蛋白表達水平,這表明Ghrelin使梗死心肌的新生血管增多可能是通過VEGF水平增加所介導的。Ghrelin使新生血管的增加可能改善心功能障礙和防止心臟重塑。
Ghrelin發揮上述積極作用可能存在如下機制:①PI3激酶/Akt信號通路在誘導MI后的心肌血管再生中有潛在的作用[12]。已有報道,胰島素調控心肌VEGF的基因表達和血管生成,特別是通過胰島素受體和激活PI3K/Akt通路[4,13]。②ERK1/2 MAP激酶途徑也是通過抑制細胞凋亡調節血管生成的一個關鍵的級聯反應[5,14],Ghrelin通過激活ERK2信號刺激HMVEC增殖、遷移和血管生成[15]。③Ghrelin使體外培養的內皮細胞 (ECs)和完整的血管內的一氧化氮(NO)合酶(eNOS)激活[16-17]。④體內 Ghrelin干預可能會加大心臟原始干細胞增殖或補充外周血干細胞到梗死的心肌以促進血管形成[18]。綜上提示,Ghrelin可能通過不同的信號通路介導血管生成。
綜上所述,本研究顯示Ghrelin能增加MI后心肌VEGF的表達,從而促進血管生成。Ghrelin治療可望成為抑制心肌梗死后左室重塑的一種新對策。同時,Ghrelin對血管生成的作用更為詳細的信號通路和分子機制仍需要進一步研究。
[1]Haider H,Akbar SA,Ashraf M.Angiomyogenesis for myocardial repair[J].Antioxid Redox Signal,2009,11(8):1929-1944.
[2]Zhao T,Zhao W,Chen Y,et al.Vascular endothelial growth factor(VEGF)-A:role on cardiac angiogenesis following myocardial infarction[J].Microvasc Res,2010,80(2):188-194.
[3]Gnanapavan S,Kola B,Bustin SA,et al.The tissue distribution of the mRNA of ghrelin and subtypes of its receptor,GHS-R,in humans[J].J Clin Endocrinol Metab,2002,87(6):2988.
[4]Kishimoto I,Tokudome T,Hosoda H,et al.Ghrelin and cardiovascular diseases[J].J Cardiol,2012,59(1):8-13.
[5]Wang L,Chen Q,Li G,et al.Ghrelin stimulates angiogenesis via GHSR1a-dependent MEK/ERK and PI3K/Akt signal pathways in rat cardiac microvascular endothelial cells[J].Peptides,2012,33(1):92-100.
[6]Ahluwalia A,Li A,Cheng G,et al.Reduced ghrelin in endothelial cells plays important mechanistic role in aging-related impairment of angiogenesis[J].J Physiol Pharmacol,2009,60(2):29-34.
[7]Yuan MJ,Huang CX,Tang YH,et al.A novel peptide ghrelin inhibits neural remodeling after myocardial infarction in rats[J].Eur J Pharmacol,2009,618(1-3):52-57.
[8]Hao X,Mansson-Broberg A,Grinnemo KH,et al.Myocardial angiogenesis after plasmid or adenoviral VEGF-A (165) gene transfer in rat myocardial infarction model[J].Cardiovasc Res,2007,73(3):481-487.
[9]Kajdaniuk D,Marek B,Foltyn W,et al.Vascular endothelial growth factor(VEGF)-part 1:in physiology and pathophysiology[J].Endokrynol Pol,2011,62(5):444-455.
[10]Schwarz ER,Speakman MT,Patterson M,et al.Evaluation of the effects of intramyocardial injection of DNA expressing vascular endothelial growth factor(VEGF) in a myocardial infarction model in the rat--angiogenesis and angioma formation[J].J Am Coll Cardiol,2000,35(5):1323-1330.
[11]He Z,Opland DM,Way KJ,et al.Regulation of vascular endothelial growth factor expression and vascularization in the myocardium by insulin receptor and PI3K/Akt pathways in insulin resistance and ischemia[J].Arterioscler Thromb Vasc Biol, 2006,26(4):787-793.
[12]Ackah E,Yu J,Zoellner S,et al.Akt1/protein kinase Balpha is critical for ischemic and VEGF-mediated angiogenesis[J].J Clin Invest,2005,115(8):2119-2127.
[13]Tao Z,Chen B,Tan X,et al.Coexpression of VEGF and angiopoietin-1 promotes angiogenesis and cardiomyocyte proliferation reduces apoptosis in porcine myocardial infarction (MI) heart[J].Proc Natl Acad Sci USA,2010,108(5):2064-2069.
[14]Zhou L,Ma W,Yang Z,et al.VEGF165 and angiopoietin-1 decreased myocardium infarct size through phosphatidylinositol-3 kinase and Bcl-2 pathways[J].Gene Ther,2005,12(3):196-202.
[15]Li A,Cheng G,Zhu GH,et al.Ghrelin stimulates angiogenesis in human microvascular endothelial cells:Implications beyond GH release[J].Biochem Biophys Res Commun,2007,353(2):238-243.
[16]Chen LL,Yin H,Huang J.Inhibition of TGF-beta1 signaling by eNOS gene transfer improves ventricular remodeling after myocardial infarction through angiogenesis and reduction of apoptosis[J].Cardiovasc Pathol,2007,16(4):221-230.
[17]Xu X,Jhun BS,Ha CH,et al.Molecular mechanisms of ghrelin-mediated endothelial nitric oxide synthase activation[J].Endocrinology,2008,149(8):4183-9412.
[18]Gao M,Yang J,Liu G,et al.Ghrelin promotes the differentiation of human embryonic stem cells in infarcted cardiac microenvironment[J].Peptides,2012,34(2):373-379.

