自身抗體陽性的藥物性肝損害臨床病理特點分析
王欣欣 劉燕敏 劉 暉 孫 琳 廖慧鈺 呂福東▲
1.首都醫科大學附屬北京佑安醫院病理科,北京 100069;2.首都醫科大學附屬北京佑安醫院肝病免疫科,北京 100069
藥物性肝損傷(DILI)是與用藥有關的肝功能損傷。根據個體反應不同,DILI在嚴重程度、病情進展等方面有顯著差異。自身免疫性肝炎(AIH)是由異常自身免疫反應介導的肝實質慢性炎癥性病變。免疫介導的DILI(即伴自身免疫現象的DILI)是藥物誘發免疫介導的具有AIH特征的肝損傷。三者之間既相互區別又相互聯系,如何在初診時予以鑒別、適當治療和預測進展是臨床上的重要任務。本研究回顧分析確診為DILI患者的臨床病理資料,總結分析其臨床、病理特征,以期提高對本病的認識。
1 資料與方法
1.1 一般資料
選擇2008年10月~2012年6月首都醫科大學附屬北京佑安醫院收治,藥物性肝損傷診斷標準(DDW標準,日本)評分值≥4分,血清自身抗體檢測陽性,且均行肝穿刺活檢的藥物性肝損傷患者。血清及肝組織中病毒學檢測均排除嗜肝及非嗜肝病毒感染,并排除酒精、非酒精性肝損傷及遺傳代謝性肝病等。
經臨床和病理確診患者共31例,其中男6例,女24例,年齡 35~60 歲,平均(48.6±8.9)歲。31 例患者均有明確服藥史或化學毒物接觸史。其中急性DILI患者14例,慢性DILI患者17例;17例慢性患者中11例有長期服用治療慢性疾病藥物史,6例初次就診以“急性肝損害”收入院,后經肝組織活檢證實已發展為慢性損傷,經6~38個月隨訪其中3例因肝功能反復異常入院檢查,1例進展為典型AIH。急性與慢性DILI患者年齡、性別的一般資料比較,差異均無統計學意義(P>0.05),具有可比性。
1.2 方法
肝生化功能由我院臨床檢驗中心檢測,靜脈采血3 mL,及時分離血清,做肝功能檢測。使用酶聯免疫吸附法進行血清病毒標志物檢測。自身抗體檢測由感染免疫研究中心采用間接免疫熒光法協同完成。儀器采用美國Beckman cx7全自動生化分析儀,試劑由北京中生生物工程高技術公司提供。
肝穿刺活檢及免疫組化:B超引導下自動活檢槍經皮穿刺取肝組織,穿刺肝組織長度>1.0 cm,且無破碎;標本采用10%中性福爾馬林液及時固定,石蠟包埋,4 μm連續切片,分別做HE、Masson三色、Gomori網織纖維和D-PAS染色。免疫組化染色:鼠抗人HBsAg、HBcAg、CK19抗體均購自北京中山生物技術有限公司,均為即用型抗體,免疫組化步驟按SP免疫組化染色方法進行。設陰性對照,以磷酸鹽緩沖液(PBS)代替一抗。
1.3 觀察指標
總結患者一般情況,觀察血清谷丙轉氨酶(ALT),谷草轉氨酶 (AST), 堿性磷酸酶 (ALP),γ-谷氨酰轉肽酶(GGT),總膽紅素(TBil),直接膽紅素(DBil),球蛋白(GLB)變化。血清檢測抗核抗體(ANA)、抗線粒體抗體(AMA)、平滑肌抗體(SMA)、肝腎微粒抗體 1型(LKM-1)、肝細胞胞溶質抗原1型 (LC-1)、 可溶性肝抗原 (SLA)/肝胰抗原(LP),以及 SS-A、SS-B、dsDNA 等多種抗體。光鏡下個觀察肝臟病理形態特點。
1.4 統計學方法
采用統計軟件SPSS 13.0對數據進行分析,計量資料以均數±標準差(±s)表示,比較采用 Mann-Whitney秩和檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 肝功能檢測
將14例急性藥物性肝損害與17例慢性藥物性肝損害兩組患者肝功能檢測結果進行分析對比,經秩和檢驗分析,兩組患者僅GLB水平差異有統計學意義(P=0.03),其余指標差異均無統計學意義(P>0.05)。見表1。
2.2 自身抗體檢測
31例患者周圍血中可檢測到7種自身抗體,主要是ANA 20例(64.5%),其次是 SMA 6例(19.4%)、AMA 4例(12.9%);還有肝特異性膜脂蛋白 (LSP)、抗壁細胞抗體(APCA)、著絲點抗體(ACA),抗干燥綜合征抗體(SSA)各 1例。急性DILI組自身抗體ANA、SMA滴度均≤1∶320。慢性DILI患者中ANA、AMA、SMA出現高滴度自身抗體,其中ANA 滴度≥1∶320者 15例,7例患者 ANA 為 1∶1000,出院后復查 ANA 滴度,4 例降至 1∶320,2 例降至 1∶100,1 例狼瘡腎患者抗體滴度未改變。慢性肝損害患者中1例入院時ANA 滴度為 1∶320,出院復查已升至 1∶1000,二次肝組織活檢提示慢性DILI特征伴自身免疫現象或自身免疫性肝炎。
表1 急性與慢性DILI患者肝生化指標比較(±s)

表1 急性與慢性DILI患者肝生化指標比較(±s)
注:與急性比較,*P<0.05;ALT:丙氨酸轉氨酶;AST:門冬氨酸轉氨酶;ALP:堿性磷酸酶;GGT:γ-谷氨酰轉肽酶;TBil:總膽紅素;DBil:直接膽紅素;GLB:球蛋白;DILI:藥物性肝損傷
DILI分型 ALT(U/L) AST(U/L)ALP(U/L)急性(n=14)慢性(n=17)521.1±387.5321.0±299.7352.5±280.9298.8±182.7133.4±50.1147.4±97.3 GGT(U/L)TBil(μmol/L)DBil(μmol/L) GLB(g/L)159.9±134.1180.6±227.9103.7±101.898.4±95.766.4±73.361.2±72.125.1±5.328.6±5.1*
2.3 肝穿刺病理活檢
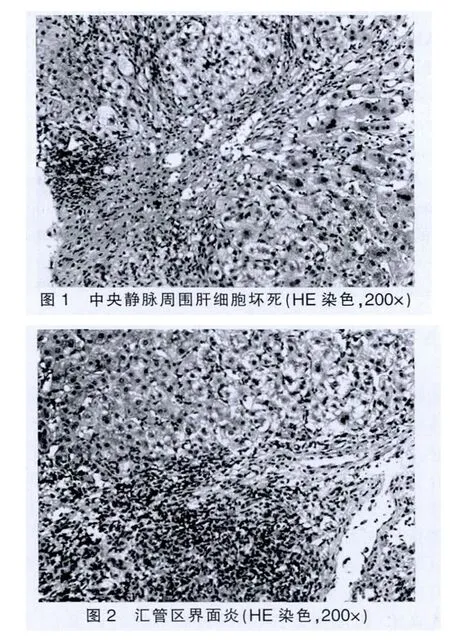
31例患者均未提示自身免疫性肝炎及原發性膽汁性肝硬化(PBC)病理特征。急性組肝活檢病理主要表現為兩種形式,即肝細胞型或膽管型。肝細胞型表現為小葉中心性肝細胞壞死脫失(圖1),網狀支架塌陷,淋巴細胞和少量漿細胞浸潤,匯管區水腫,混合炎細胞(淋巴細胞、嗜酸和中性粒細胞等)浸潤,可伴輕度界面炎(圖2),罕見漿細胞;膽管型表現為腺泡3帶為主的肝細胞內淤膽,毛細膽管膽拴形成,肝細胞壞死脫失,蠟紙樣細胞浸潤,匯管區水中,輕度擴大,混合炎細胞浸潤,小葉間膽管破壞伴細膽管反應明顯(圖3)。慢性組病例主要表現為混合型,中央靜脈周圍肝細胞大片壞死,網狀支架塌陷瘢痕形成,重者可致肝小葉結構破壞(圖4),匯管區顯著擴大,纖維組織增生,匯管區及塌陷瘢痕內淋巴細胞及少量漿細胞浸潤,輕度界面炎伴周圍細膽管反應性增生。僅靠肝穿刺小組織活檢有時慢性DILI所致網狀支架塌陷形成的瘢痕與病毒性肝炎肝硬化不宜鑒別,需密切結合既往臨床病史和影像學檢查等綜合分析。
3 討論
肝臟是藥物代謝的重要器官。隨著我國衛生醫療條件的改善和民眾自我保健意識的提高,藥物性(毒物)肝損害近年來呈上升趨勢。DILI大致可以分為可預測性和不可預測性兩種。可預測性DILI通常是由藥物的直接毒性作用引起;不可預測性DILI常發生在一些過敏或代謝特異體質的患者,由機體免疫機制介導,病變程度與用物劑量或療程無關。臨床上患者可以出現轉氨酶升高、黃疸、自身抗體出現等類似急、慢性病毒性肝炎或自身免疫性肝病表現的不同臨床癥狀。
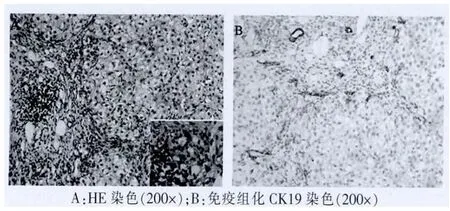
圖3 小葉間膽管損傷,上皮空泡變性,周圍細膽管反應性增生

圖4 大片壞死后網狀支架塌陷,纖維瘢痕分割肝小葉
最近,有學者將AIH和DILI的關系分為3類:免疫介導的DILI即伴自身免疫現象的DILI,指藥物引發的具有AIH特征的肝損傷,臨床表現為自身抗體陽性、免疫球蛋白高、肝組織界面炎明顯;第二類是藥物介導的AIH:指患者本身沒有或有輕度的AIH,使用可疑藥物后能誘導出現或加重AIH;第三類是合并DILI的AIH,指明確診斷為AIH患者同時并發DILI,鑒別診斷需要靠肝組織活檢[1]。免疫介導的DILI與普通型DILI不同,也不同于AIH,部分患者經短期或錐形免疫抑制劑治療效果好,停藥后不會復發,也有一部分患者進展為典型的AIH[2]。以上病例具有以下共同特點:①患者為中老年女性,發病前有明確的用藥史。②實驗室檢查方面,肝功異常在先,自身抗體出現在后,且自身抗體滴度可因反復用藥而逐漸升高,血清球蛋白輕度升高。③肝損害起病急緩不一,停藥后經保肝降酶等一般性治療肝功能恢復快,但慢性DILI卻不易降到正常。④再次用藥時,短時間內即可出現類似癥狀,呈自身免疫介導的特異體質性肝損害表現。特異體質性DILI屬于個體特異性的,動物模型不能復制,臨床上缺乏過敏反應征象,發病率為 1/(103~105)[3]。有研究顯示在引起 DILI的相關藥物中抗生素、解熱鎮痛類藥、中藥、抗腫瘤藥和降糖藥占到約70%[4-6]。國內學者胡錫琪[7]借鑒慢性肝炎評分系統,非酒精性脂肪性肝病活動度評分和國際自身免疫性肝炎評分方法,總結出藥物性肝炎病理學5階評估法,將DILI的病理診斷分為不可能、可能、很可能和明確的DILI,并于今年3月重新修正,為DILI的病理診斷提供重要依據。AIH與免疫介導的DILI在組織學上有一定的相似之處,均表現為界面性肝炎、淋巴細胞、漿細胞、嗜酸粒細胞浸潤,小葉中心性壞死等,但Suzuki等[8]的研究結果顯示兩者在組織學上仍有顯著差異性。Ju等[9]研究了29例肝功異常且有用藥史患者的血清學和組織學特點,其中組織學診斷DILI 21例和AIH 8例,發現兩組間血清AST、GLB和凝血酶原時間有顯著差異,7例 (30%)DILI伴 ANA抗體陽性,8例(100%)AIH患者ANA抗體陽性,提示肝功能異常且有用藥史的患者,不能除外AIH的可能,肝活檢對鑒別診斷有重要作意義。
特異質性肝細胞毒素的許多機制現已闡明:包括有藥物代謝性個體遺傳變異,以及出現對藥物及其代謝產物產生免疫反應[10]。這類DILI主要是藥物引發免疫介導的肝損傷,細胞色素450酶(CYP450)是參與藥物代謝的主要酶系,包括各種同工酶,如抗-LKM1和抗-LKM2、ANA和SMA等,藥物活性代謝產物可能通過對肝臟細胞色素P450系統酶的綁定產生新生抗原誘導免疫反應。而自身抗體是AIH診斷的重要指標,臨床根據ANA、SMA、LKM1和LKM2不同陽性抗體的出現分為Ⅰ、Ⅱ、Ⅲ型AIH。本研究顯示,DILI中最常出現的抗體是 ANA (66.7%)、SMA(16.7%)和 AMA(19.4%)[11]。
由于伴自身免疫現象的DILI在診斷時缺乏特異性,DILI的藥物中毒因果關系評價困難[12],容易被漏診或誤診,尤其是與非典型性自身免疫性肝病的鑒別。對本病的早期診斷主要在于詳細的詢問病史,提高對本病的警惕性,及時的肝穿刺活檢對診斷和鑒別診斷具有重要意義。除此之外,關于糖皮質激素在這類患者中的治療時機及治療療程,因缺乏指導治療和療效評判的客觀指標,目前臨床仍有困惑和爭論。總之,藥物誘導的肝損傷個體差異大,臨床表現不一,甚至可以成為各種原發性肝病的誘因,因此對DILI的認識還有待提高。
[1]Weiler-Normann C,Schramm C.Drug induced liver injury and its relationship to autoimmune hepatitis[J].J Hepatol,2011,55(4):747-749.
[2]Wree A,Dechene A,Herzer K,et al.Steroid and ursodesoxycholic acid combination therapy in severe drug-induced liver injury[J].Digestion,2011,84:54-59.
[3]Uetrecht J.Immunoallergic drug-induced liver injury in humans[J].Semin Liver Dis,2009,29(4):383-392.
[4]Andrade RJ,Lucena MI,Fernandez MC,et al.Drug-induced liver injury:an analysis of 461 incidences submitted to the Spanish registry over a 10-year period[J].Gastroenterology,2005,129:512-521.
[5]Shigeto E.Survey of anti-tuberculosis drug-induced severe liver injury in Japan[J].Kekkaku,2007,82:467-473.
[6]王淑珍,劉燕敏,閆惠平,等.兒童反復肝功能異常伴肝腎微粒體抗體陽性[J].中華檢驗醫學雜志,2012,35(3):280-282.
[7]胡錫琪.藥物性肝損傷組織病理學評分探討[J].中華肝臟病雜志,2012,20(3):176-177.
[8]Suzuki A,Brunt EM,Kleiner DE,et al.The use of liver biopsy evaluation in discrimination of idiopathic autoimmune hepatitis versus drug-induced liverinjury[J].Hepatology,2011,54(3):931-939.
[9]Ju HY,Jang JY,Jeong SW,et al.The clinical features of drug-induced liver injury observed through liver biopsy:focus on relevancy to autoimmune hepatitis[J].Clin Mol Hepatol,2012,18(2):213-218.
[10]Ohira H,Takahashi A.Current trends in the diagnosis and treatment ofautoimmunehepatitisinJapan[J].HepatolRes,2012,42(2):131-138.
[11]楊建軒,閆惠平,檀玉芬.藥物性肝損傷患者的自身抗體分析[J].臨床薈萃,2008,23(14):992-995.
[12]劉燕敏.藥物性肝損害伴自身抗體陽性患者臨床特征及轉歸[J].臨床肝膽病雜志,2012,28(5):335-338,342.
[13]戴維佳,賴榮陶,王暉,等.113例藥物性肝損害臨床特征及影響因素分析[J].臨床肝膽病雜志,2011,27(10)1058-1061,1065.
[14]Rolf T,Christian F,Johannes S,et al.Herbal hepatotoxicity:Challenges and pitfalls of causality assessment methods[J].World J Gastroenterol,2013,19(19):2864-2882.

