低強度脈沖超聲對立體培養的人退變髓核細胞的影響
張曉軍 胡偵明 郝 杰 沈皆亮 (重慶醫科大學附屬第一醫院骨科,重慶 400016)
椎間盤退變(IDD)是引起椎間盤源性疾病的主要原因。近年來國內外研究發現IDD的本質是椎間盤發生細胞學和生物學的變化,椎間盤細胞的數量和生物活性下降,椎間盤內細胞外基質(ECM)合成的減少和降解的增加〔1,2〕。因此找到某種方法來增加椎間盤細胞的數目和活性,促進細胞外基質的合成,恢復椎間盤的生物活性,是可能修復椎間盤退變的有效手段。低強度脈沖超聲(LIPUS)目前作為一種促進骨折愈合的物理治療方法已經被廣泛應用于臨床,大量研究證明LIPUS不僅可以促進骨折愈合,而且還對軟骨細胞的增殖和細胞外基質分泌具有一定的調節作用〔3〕。椎間盤細胞與關節軟骨細胞在基因表達和功能方面具有高度同源性。本研究通過觀察低強度脈沖超聲對退變椎間盤髓核細胞的作用,以期探索一種能修復椎間盤退變的方法,并能用于臨床上治療因椎間盤退變引起的椎間盤源性疾病。
1 材料與方法
1.1 標本來源 椎間盤髓核組織來源于重慶醫科大學附屬第一醫院脊柱外科住院患者腰后路減壓術中切除的髓核,均獲得患者知情同意,并通過重慶醫科大學附屬第一醫院倫理委員會批準。退變的椎間盤髓核組織來源于16例病人,年齡60~72歲(男7例,女9例),所取椎間盤退變程度根據脊柱MRI Pfirrmann分級〔4〕分為GradeⅢ~Ⅵ。
1.2 主要儀器 低強度脈沖超聲儀由重慶市超聲醫學工程重點實驗室提供。
1.3 主要試劑 DMEM/F12(1∶1)培養基 (Hyclone,美國),胎牛血清 (Hyclone,美國),Ⅱ型膠原酶、胰蛋白酶(Sigma,美國);鼠單抗 COLA2α1抗體(Santa Cruz,美國),鼠單抗 aggrecan抗體(Santa Cruz,美國);兔抗人Ⅱ型膠原多克隆抗體、S-P試劑盒、DAB顯色試劑盒 (博士德,武漢)。RNA抽提試劑盒(Invitrogen,USA),逆轉錄試劑盒(TaKaRa,大連),熒光定量 PCR反應試劑盒(TaKaRa,大連)。
1.4 方法
1.4.1 髓核細胞的分離培養及鑒定
1.4.1.1 髓核細胞的分離培養 術中所取的椎間盤標本,置入預先準備好的內含少量DMEM/F12(Hyclone,美國)培養基的無菌培養皿并置入冰盒內迅速帶回實驗室。按照文獻〔5〕的方法,稍加改進。在超凈臺內將所取椎間盤組織用眼科剪和眼科鑷小心去除軟骨終板和纖維環組織,并用PBS緩沖液清洗3遍,去除血污。將髓核組織剪碎至1 mm3大小,置于0.25%的胰酶中,37℃恒溫水浴20 min,每5 min搖勻一次,以利于充分消化。加入適量含10%胎牛血清的DMEM/F12培養基終止消化,離心(800 r/min,5 min),棄上清,PBS液沖洗洗、離心2遍,加入0.2%Ⅱ型膠原酶37℃水浴消化3~4 h至組織塊基本消失。200目不銹鋼細胞篩過濾,離心(800 r/min,5 min),去除上清液,加入適量PBS液沖洗、離心2遍。用含20%胎牛血清的DMEM/F12培養基吹打混勻細胞,鏡下計數,按1.0×105/ml細胞密度種植于25 cm2培養瓶,置37℃、體積分數為5%CO2的培養箱中培養。
1.4.1.2 免疫組化鑒定 取P2代髓核細胞爬片,取出經PBS。液洗后,用4%多聚甲醛固定30 min,3%H2O2室溫孵育10 min,蒸餾水洗滌(5 min×3次)。滴加5%BSA封閉液阻斷,室溫20 min,去除多余液體,加入適當濃度COLA II(1∶200)一抗,4℃冰箱過夜。室溫平衡后,PBS洗滌(5 min×3次),加入生物素標記二抗(1∶400),37℃ 30 min,PBS液沖洗(5 min×3次)。滴加試劑SABC,室溫孵育30 min,PBS液沖洗(5 min×3次)。顯色劑DAB顯色,蒸餾水洗滌,蘇木精復染,脫水、透明、常規封片。陰性對照以一抗稀釋液代替一抗。
1.4.2 髓核細胞三維立體培養 參考文獻〔6〕并稍加改進,選擇P3代細胞轉移至6孔板進行三維立體培養。取適量P3代細胞懸液與1.2%的藻酸鈉溶液混勻,通過22號針頭逐滴加入各孔預先置入100 mmol/L氯化鈣溶液的6孔板,形成直徑約為2 mm大小的藻酸鈣凝珠,靜置10 min。吸走剩下的氯化鈣溶液,用生理鹽水洗滌藻酸鈣凝珠3次,再用DMEM/F12培養基洗滌3次。最后每孔加入4 ml含青霉素100 U/ml、鏈霉素100 μg/ml和20%FBS的 DMEM/F12培養液,置 37℃、體積分數為5%CO2的培養箱中培養,每隔2 d換液。
1.4.3 LIPUS作用于三維立體培養髓核細胞 細胞轉至6孔板內三維立體 24 h后 開 始 不 同 強 度(0、15、30、60、120 mW/cm2)的超聲刺激(20 min/d),總共1 w。在超聲儀的6孔板支架臺上涂抹專用超聲藕合膠,使6孔板底部緊貼于支架臺上的超聲探頭,開始不同強度的超聲刺激。對照組(0 mW/cm2)同條件置于支架臺上20 min,不予超聲刺激。低強度脈沖超聲波頻率為1.5 MHz,脈沖頻率為1 kHz,超聲波作用時間為200 μs,間隙時間為 800 μs。
1.4.4 流式細胞儀檢測細胞凋亡率 選取超聲波強度為0、15、30、60、120 mW/cm2分別作用于三維立體培養的髓核細胞1 w后,用濃度為50 mmol/L的檸檬酸鈉溶液溶解藻酸鈣凝珠,使包埋在其中的髓核細胞游離出來。收集細胞后用PBS洗2次,將細胞重懸結合緩沖液,加入Annexin V-FITC和PI進行標記后用FACS Calibur流式細胞儀(BD公司,美國)檢測凋亡率。
1.4.5 RT-PCR檢測 根據1.4.4結果,選擇超聲波強度為30、60、120 mW/cm2作用下的游離髓核細胞。收集細胞提取RNA,檢測aggrecan和Ⅱ型膠原的mRNA表達水平。按RNA抽提試劑盒RNAiso Plus說明書提取細胞總RNA,用逆轉錄試劑盒PrimeScriptR RT reagent Kit With gDNA Eraser將RNA逆轉錄為cDNA。熒光定量PCR反應使用SYBRR Green Realtime PCR Master Mix試劑。反應體系按說明書執行,iQ5定量PCR儀(Bio-Rad,美國)上機檢測。反應條件為:95℃預變性2 min,95℃變性5 s,各自的退火溫度30 s,72℃延伸30 s,共35循環。引物序列:COL2 α1 上游:5'-CAGGTGAACCTGGACGAGAG-3',下游5'-CCCACAGCACCAGTCTCAC-3';聚集蛋白聚糖(aggrecan):上游:5'-GGAATGATGTTCCCTGCAAT-3',下游:5'-GTCTGCGTTTGTAGGTGGTG-3';GAPDH:上游:5'-CTTTGGTATCGTGGAAGGACTC-3',下游:5'-GTAGAGGCAGGGATGATGTTCT-3'。以上引物均由生工生物工程公司(上海)合成。結果采用2-ΔΔCt法行相對定量解析。
1.4.6 Western印跡檢測 選擇1.4.5相同的游離髓核細胞,收集細胞提取總蛋白,檢測aggrecan和Ⅱ型膠原的蛋白表達水平。用預冷的PBS液洗滌細胞3次,加入預冷的RIPA裂解液冰上反應30 min,4℃下13 000 g/min離心5 min,收集上清液即為蛋白質粗提物。BCA法測定蛋白質濃度,取等量蛋白質樣品進行SDS-PAGE電泳,電轉至PVDF膜,5%脫脂奶粉室溫下封閉2 h,一抗4℃孵育過夜,TBST液洗滌(15 min×4次);辣根過氧化物酶標記的二抗室溫孵育1 h,TBST液洗滌(15 min×3次),ECL顯色。常規壓片,顯影,照相,Quantity One軟件分析各條帶灰度值。
1.5 統計學方法 采用SPSS17.0統計軟件,數據以±s表示,數據顯著性檢驗用Dunnett-t檢驗。
2 結果
2.1 顯微鏡下細胞形態 細胞5~7 d開始爬壁生長,形態呈短梭形、多角形;9~14 d能爬滿培養瓶90%,呈鋪路石樣或蜂窩狀生長,可傳第一代(P1);3 w左右能傳第二代(P2)。見圖1。
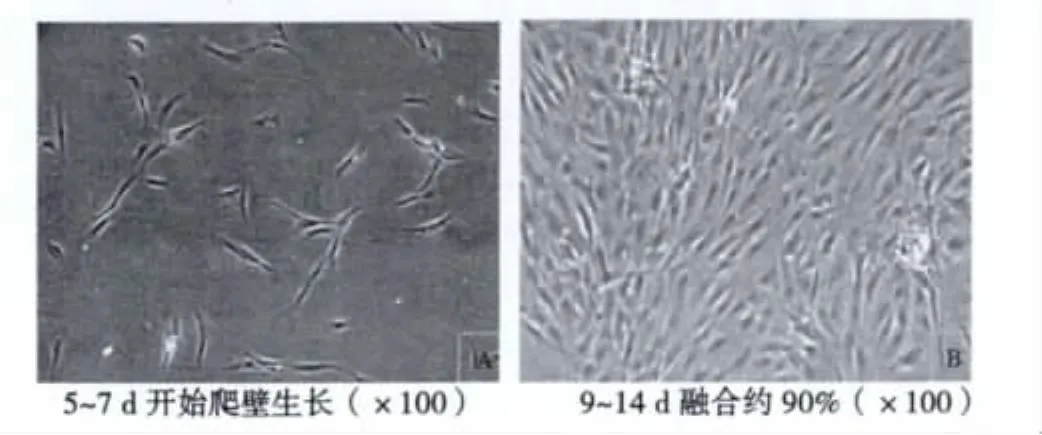
圖1 細胞鏡下觀察
2.2 免疫組化鑒定結果 見圖2。

圖2 免疫組化可見髓核細胞胞質著色呈棕黃色
2.3 流式細胞術檢測凋亡 結果顯示予以超聲強度為30、60、120 mW/cm2的 LIPUS 刺激細胞后,30、60、120 mW/cm2組細胞凋亡率較對照組明顯降低,15 mW/cm2與對照組比較無明顯差異 (見圖3)。
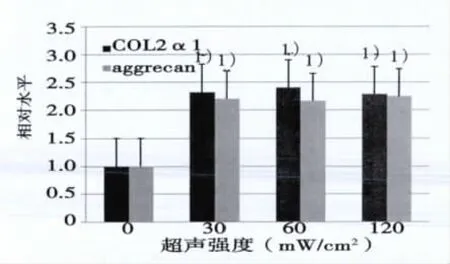
圖3 不同超聲強度對細胞凋亡率的影響
2.4 RT-PCR檢測aggrecan和Ⅱ型膠原mRNA表達水平 結果顯示予以超聲強度為30、60、120 mW/cm2的LIPUS刺激細胞后,aggrecan和Ⅱ型膠原mRNA表達水平較對照組顯著升高,組間比較無明顯差異(見圖4)。
2.5 Western印跡檢測aggrecan和Ⅱ型膠原蛋白表達水平結果顯示予以超聲強度為30、60、120 mW/cm2的LIPUS刺激細胞后,aggrecan和Ⅱ型膠原蛋白表達水平較對照組(0 mW/cm2)顯著升高,組間比較亦無明顯差異(見圖5)。
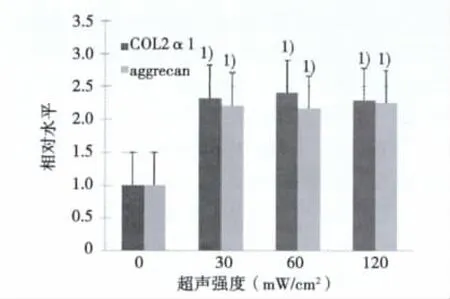
圖4 Aggrecan和Ⅱ型膠原mRNA水平表達結果
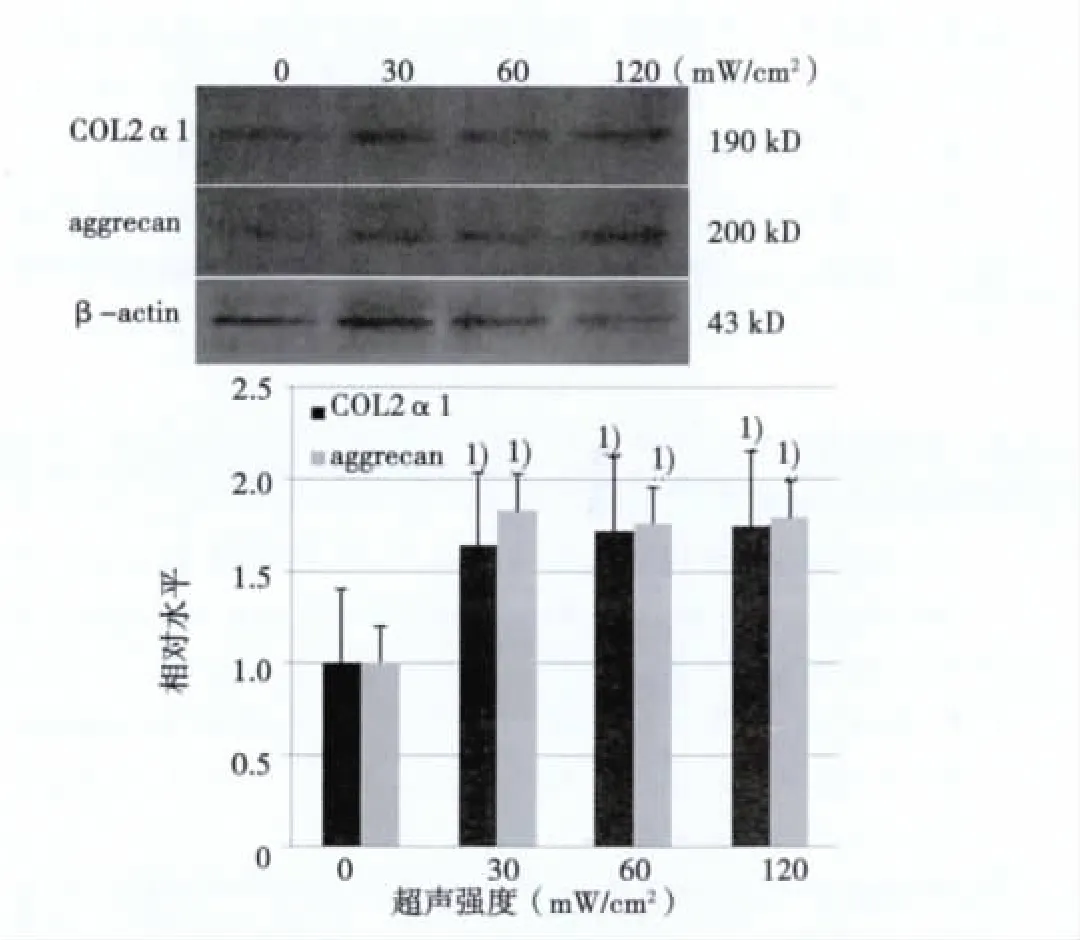
圖5 Aggrecan和Ⅱ型膠原蛋白水平表達結果
3 討論
椎間盤退變涉及髓核、纖維環及軟骨終板,但顯著的改變還是發生在髓核,如細胞外基質成分合成減少、降解增多,基質水合作用降低,而負責基質合成的髓核細胞的凋亡,在這個病變過程中發揮了關鍵作用〔7〕。因此,通過抑制髓核細胞的凋亡,促進髓核基質的合成,是可能延緩或修復椎間盤退變的途徑。
椎間盤髓核細胞的體外培養技術已非常成熟,既往對體外細胞的相關研究多采用單層培養,而大多細胞體外單層培養一定時間后細胞會發生去分化現象,尤其是髓核細胞,傳至3~5代后細胞便開始向纖維細胞分化,增殖能力下降,而藻酸鈣凝膠三維立體培養能夠很好地保持細胞原有表型〔8〕。本研究對退變椎間盤髓核細胞采用藻酸鈣凝珠三維立體培養,更好地模擬體內環境,使髓核細胞保持圓球形,自身所分泌Ⅱ型膠原、蛋白多糖被局限在細胞的周圍,使得細胞與細胞外基質之間的密切關系得到了保持,更有利于細胞存活、增殖和合成細胞外基質。因為藻酸鈣在交聯過程中,凝膠內形成通向表面的放射狀管道,增加了藻酸鈣凝膠的表面積,提供了細胞需要的營養和代謝產物的交換渠道〔9〕。
超聲波主要有三大效應:空泡效應、熱效應、機械效應。低強度脈沖超聲不用于高強度聚焦超聲對組織和細胞的殺死作用,其致熱效應很微弱,對細胞主要產生促進增殖和合成相關細胞外基質的生物學效應。低強度脈沖超聲在促進骨折愈合方面的確切療效〔10〕,使得其獨特的生物學效應越來越被重視,將其用于軟骨等其他軟組織方面的研究越來越多〔11,12〕,但其在椎間盤退變方面的研究報道較少。Iwashina等〔13〕發現LIPUS對體外培養的兔正常椎間盤細胞增殖和細胞ECM(主要是蛋白多糖)的合成有促進作用。Kobayashi報道〔14〕LIPUS可以促進人髓核細胞株合成蛋白多糖和 BMP2、FGF7、TGFβR1、VEGF等生長因子及相關受體的表達。
本研究說明一定超聲強度的LIPUS有抑制體外三維立體培養的細胞凋亡的作用。LIPUS有促進退變髓核細胞合成Ⅱ型膠原和蛋白多糖的作用。推測其機制可能為LIPUS通過其機械效應對細胞膜產生一種微應力,使信號傳遞到細胞內產生一些列生物學效應,亦或通過縫隙連接促進細胞間的信息傳遞而產生效應〔15〕。但組間比較差異無顯著性,提示LIPUS對細胞外基質合成的促進作用在一定范圍內無明顯劑量依賴性。
1 Loreto C,Musumeci G,Castorina A,et al.Degenerative disc disease of herniated intervertebral discs is associated with extracellular matrix remodeling,vimentin-positive cells and cell death〔J〕.Ann Anat,2011;193(2):156-62.
2 Le Maitre CL,Pockert A,Buttle DJ,et al.Matrix synthesis and degradation in human intervertebral disc degeneration〔J〕.Biochem Soc Trans,2007;35(Pt 4):652-5.
3 Vaughan NM,Grainger J,Bader DL,et al.The potential of pulsed low intensity ultrasound to stimulate chondrocytes matrix synthesis in agarose and monolayer cultures〔J〕.Med Biol Eng Comput,2010;48(12):1215-22.
4 Griffith JF,Wang YX,Antonio GE,et al.Modified Pfirrmann grading system for lumbar intervertebral disc degeneration〔J〕.Spine,2007;32(24):E708-12.
5 Ciapetti G,Granchi D,Devescovi V,et al.Ex vivo observation of human intervertebral disc tissue and cells isolated from degenerated intervertebral discs〔J〕.Eur Spine J,2012;21(1):S10-9.
6 Stephan S,Johnson WE,Roberts S.The influence of nutrient supply and cell density on the growth and survival of intervertebral disc cells in 3D culture〔J〕.Eur Cell Mater,2011;22:97-108.
7 Singh K,Masuda K,Thonar EJ,et al.Age-related changes in the extracellular matrix of nucleus pulposus and anulus fibrosus of human intervertebral disc〔J〕.Spine,2009;34(1):10-6.
8 Darling EM,Athanasiou KA.Rapid phenotypic changes in passaged articular chondrocyte subpopulations〔J〕.J Orthop Res,2005;23(2):425-32.
9 Lin YJ,Yen CN,Hu YC,et al.Chondrocytes culture in three-dimensional porous alginate scaffolds enhanced cell proliferation,matrix synthesis and gene expression〔J〕.J Biomed Mater Res A,2009;88(1):23-33.
10 Pounder NM,Harrison AJ.Low intensity pulsed ultrasound for fracture healing:a review of the clinical evidence and the associated biological mechanism of action〔J〕.Ultrasonics,2008;48:330-8.
11 Naito K,Watari T,Muta T,et al.Low-intensity pulsed ultrasound(LIPUS)increases the articular cartilage type II collagen in a rat osteoarthritis model〔J〕.J Orthopaedic Res,2009;28(3):361-9.
12 Anil K,Richard TC.N.The effects of LIPUS on soft-tissue healing:a review of literature〔J〕.British Medical Bulletin,2009;89:169-82.
13 Iwashina T,Mochida J,Miyazaki T,et al.Lowintensity pulsed ultrasound stimulates cell proliferation and proteoglycan production in rabbit intervertebral disc cells cultured in alginate〔J〕.Biomaterials,2006;27:354-61.
14 Kobayashi Y,Sakail D,Iwashina T,et al.Low intensity pulsed ultrasound stimulates cell proliferation,proteoglycan synthesis and expression of growth factors related genes in human nucleus pulposus cell line〔J〕.Eur Cells Materials,2009;17:15-22.
15 Kotaro S,Siddhesh RA,Arihiko K.Low-intensity pulsed ultrasound and cell-to-cell communication in bone marrow stromal cells〔J〕.Ultrasonics,2011;51:639-44.

