高脂血癥對腦缺血大鼠模型腦皮質MMP-2表達和神經元凋亡的影響
張振強 宋軍營 賈亞泉 李澎濤 潘彥舒 (河南中醫學院,河南 鄭州 4500046)
缺血性腦病成為嚴重危害人類健康的慢性流行性疾病之一,其發病機制較為復雜。近年研究發現,在腦缺血后的幾個小時內,缺血半暗帶或梗死區周圍的神經元死亡主要以凋亡性死亡為主,這提示了腦缺血損傷與細胞凋亡密切相關〔1〕。因此,對腦缺血后神經細胞凋亡機制及基于抗凋亡為靶點的抗腦缺血的研究成為國內外研究的熱點。Bcl-2蛋白家族主要參與線粒體引起的凋亡途徑,Bcl-2和Bax參與了腦出血后神經細胞的凋亡。Bcl-2通過阻斷細胞凋亡而促進細胞存活,維持細胞生存;而Bax與 Bcl-2功能相反,則誘導細胞凋亡。因此,Bcl-2與Bax的比值變化決定細胞的凋亡與生存〔2〕。近年來,基質金屬酶(MMPs),尤其是MMP-2,在缺氧缺血性腦損傷及腦水腫中所起的作用,逐漸被人們所關注。MMP-2即72kDa IV型膠原酶,由肥大的星形細胞、星形膠質細胞、缺血的內皮細胞和巨噬細胞等合成和分泌。其過度表達不僅能夠引起微血管的損失,而且破壞神經細胞賴以生存的環境,并對炎癥因子發揮正反饋作用,使腦缺血后炎癥發生,加速神經細胞凋亡〔3〕。高脂血癥和高黏滯血癥是缺血性心腦血管病的重要原因。因此,本文在高脂血癥的病理基礎上探討腦缺血后神經細胞凋亡及相關基因表達的機制。
1 材料與方法
1.1 動物分組 實驗動物隨機分為正常組(C1)、高脂對照組(H1)、假手術組(C2)、高脂假手術組(H2)、單純腦缺血組(I3和I7)、復合腦缺血組(H+I3和H+I7)。其中對照組與假手術組每組10只;模型組設兩個時間組,分別為腦缺血手術后3 d(I3和H+I3)和7 d(I7和H+I7),每個時間點15只動物(按預實驗死亡率25%計,保證造模成功后取材的動物數)。
1.2 實驗動物模型制備 健康雄性SPF級Wistar大鼠,體重280~300 g,購買于北京維通利華實驗動物技術有限公司,許可證編號為:SCXK(京)2007-0001,質量合格證號:0243109。高脂血癥組大鼠每天以高脂飼料(組成:3.5%膽固醇、10%豬油、0.2%丙硫氧嘧啶、0.5%膽酸鈉、5%白糖、80.8%基礎飼料)喂養,正常對照組以清潔級正常飼料喂養。
大鼠以10%水合氯醛(0.3 ml/100 g)腹腔注射麻醉,線栓法制作大鼠大腦中動脈缺血模型(MCAO)。動物仰臥固定,頸部正中切口,分離并暴露右側頸總動脈及頸內、外動脈,結扎頸總動脈及頸外動脈根部,由頸總動脈近分叉處剪一小口插入尼龍線(長50 mm,直徑0.26 mm,18 mm處作標記),插入長度約(18±0.5)mm時感到有輕微阻力時停止,扎緊并固定插線,縫合皮膚。
模型制備成功后,每組各取動物5只,以10%水合氯醛(0.3 ml/100 g)腹腔注射麻醉,背位固定于鼠板上,腹主動脈取血5 ml,靜置 30 min,以 3 000 r/min,離心 15 min,取上清液,-20℃冰箱冷凍備用。每組再各取動物5只,以10%水合氯醛(0.3 ml/100 g)腹腔注射麻醉,背位固定于鼠板上,剪開胸腔,暴露出心臟,先用手術剪剪開右心耳,再用100 ml注射器進入左心室插進主動脈,先灌注生理鹽水150 ml左右,再灌注多聚甲醛400 ml左右;斷頭取出全腦,腦組織經過常規脫水透明,制備蠟塊,備用。
1.3 神經功能評分 對造模大鼠蘇醒后和取材前分別進行神經功能評分。評分標準參照Longa的5級評分方法評定動物的神經系統功能。0級:無體征;1級:動物左側前肢不能完全伸展;2級:左前膚癱瘓,出現追尾現象;3級:肢體癱瘓,不能站立;4級:動物昏迷,無自主性活動。評分為1級到3級的動物為造模成功,入組,于相應時間點再次評分后取材。計算方法:以各組動物造模蘇醒時、取材前兩次評分進行組間比較。
1.4 免疫組化 腦組織片按上面的時間步驟進行脫蠟脫水;3%H2O237℃孵育 10 min,阻斷滅活內源性過氧化物酶0.01 mmol/L枸櫞酸緩沖液微波修復抗原12 min自然冷卻20 min以上;正常羊血清工作液封閉,37℃ 20 min,吸去多余液體,勿洗。兔多克隆抗體 MMP-2(1∶200),Bcl-2(1∶200)和Bax(1∶100)4℃冰箱孵育過夜,PBS沖洗3×5 min(用 PBS緩沖液代替一抗作陰性對照);生物素標記二抗,37℃孵育60 min,HRP標記鏈親和素孵育60 min,DAB顯色液反應染色。蘇木精染核,酒精脫水,二甲苯透明,中性樹膠封片。所有結果在10倍,40倍物鏡下觀察,采用40倍物鏡拍照。采用Lmageproplus 6.0圖像分析系統檢測平均光密度值。
1.5 統計學分析 采用SPSS16.0統計軟件分析,實驗數據以±s表示,多組間比較采用單因素方差分析,兩組間比較采用t檢驗。
2 結果
2.1 神經功能評分結果 見表1。對各模型組造模蘇醒后及3、7 d取材前評分進行比較,各組間沒有明顯差異(P>0.05);復合腦缺血組與單純腦缺血組在造模蘇醒后和3、7 d取材前評分差值比較,3 d時組間沒有明顯差別(P>0.05),7 d時組間比較差值增大,差異顯著(P<0.05)。
表1 各組造模蘇醒后和相應時間點取材前的神經功能評分差異(± s,n=5)
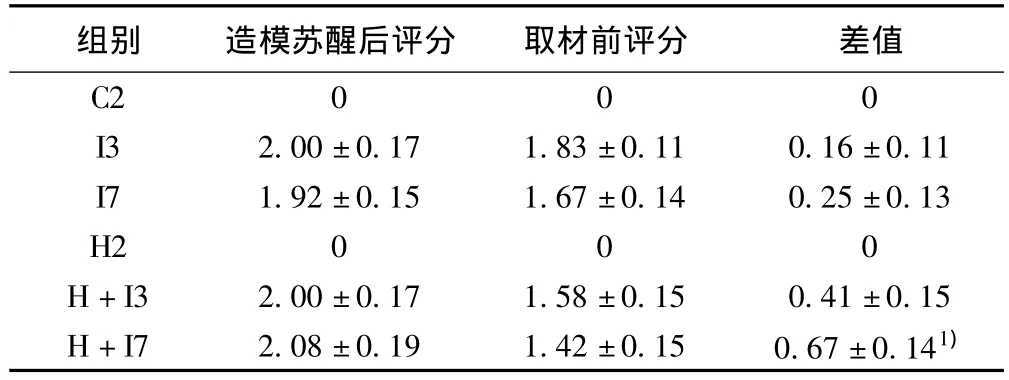
表1 各組造模蘇醒后和相應時間點取材前的神經功能評分差異(± s,n=5)
與單純腦3 d組相比較:1)P<0.05
組別 造模蘇醒后評分 取材前評分 差值C2 0 0 0 I3 2.00±0.17 1.83±0.11 0.16±0.11 I7 1.92±0.15 1.67±0.14 0.25±0.13 H2 0 0 0 H+I3 2.00±0.17 1.58±0.15 0.41±0.15 H+I7 2.08±0.19 1.42±0.15 0.67±0.141)
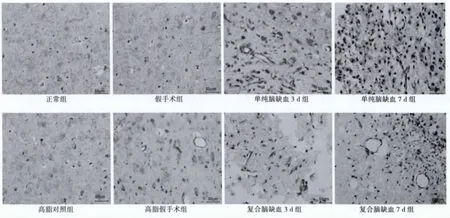
圖1 大鼠腦皮質梗死邊緣區MMP-2表達(×400)
2.2 高脂血癥病理條件下腦缺血組織中MMP-2的表達變化與正常(21.77±1.51)及假手術組(30.90±1.94)相比,MMP-2在單純腦缺血組(85.93±2.47)、(70.87±3.07)、高脂血癥組(44.32±1.99)、(54.61±4.02)和復合腦缺血組(80.82±2.95)、(99.68±2.54)的表達顯著增多(P<0.05),與高脂血癥及高脂血癥假手術相比,復合腦缺血組的MMP-2的表達也是明顯增多的(P<0.05),且MMP-2在復合腦缺血7 d組的表達顯著高于在單純腦缺血組的表達。這些結果表明高脂血癥的病理條件可能對MMP-2的表達有影響,見圖1。
2.3 高脂血癥病理條件下腦缺血組織中Bcl-2和Bax的表達變化 見表2和圖2。假手術的Bcl-2和Bax表達量都很少,但是,Bcl-2和Bax在單純腦缺血、高脂血癥和復合腦缺血組均有表達,而且差異顯著(P<0.05)。與單純腦缺血相比,復合腦缺血組的Bax的表達顯著下降(P<0.01),Bcl-2的下降幅度小于Bax,復合腦缺血7 d尤為顯著。因此,Bcl-2/Bax比值升高,差異顯著(P<0.05)。這些結果說明腦缺血后神經細胞的凋亡程度主要由Bcl-2/Bax比值變化決定,高脂血癥對腦缺血后神經細胞的凋亡有一定的影響作用。
表2 大鼠腦皮質梗死邊緣區Bcl-2和Bax的蛋白表達(± s,n=5)
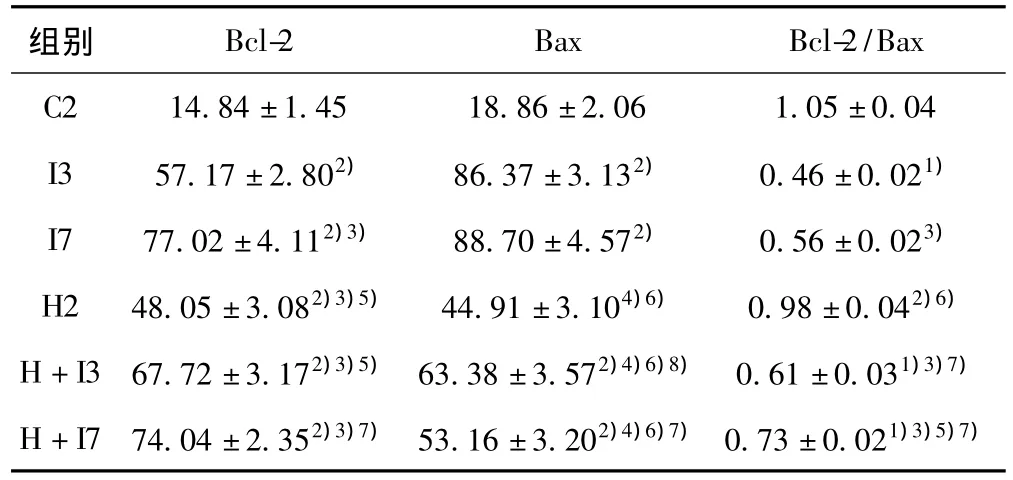
表2 大鼠腦皮質梗死邊緣區Bcl-2和Bax的蛋白表達(± s,n=5)
與C2組相比較:1)P<0.05,2)P<0.01),與 I3組相比較:3)P<0.05,4)P<0.01;與I7組比較:5)P <0.05,6)P <0.01;與 H2組比較:7)P <0.05,8)P <0.01
組別Bcl-2 Bax Bcl-2/Bax C2 14.84±1.45 18.86±2.06 1.05±0.04 I3 57.17±2.802) 86.37±3.132) 0.46±0.021)I7 77.02±4.112)3) 88.70±4.572) 0.56±0.023)H2 48.05±3.082)3)5) 44.91±3.104)6) 0.98±0.042)6)H+I3 67.72±3.172)3)5) 63.38±3.572)4)6)8) 0.61±0.031)3)7)H+I7 74.04±2.352)3)7) 53.16±3.202)4)6)7)0.73±0.021)3)5)7)
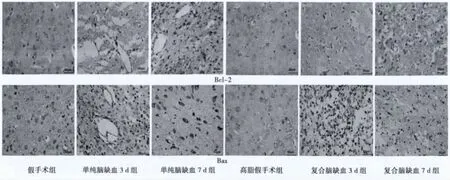
圖2 大鼠腦皮質梗死邊緣區Bcl-2、Bax的蛋白表達(×400)
3 討論
腦缺血后缺血部位神經元死亡的形式主要是壞死和凋亡。腦缺血時缺血中心區神經元以壞死為主,而缺血半暗帶區則以神經元凋亡為主要形式〔4,5〕。高脂血癥從發病機制的特點來看,一方面已經發生了腦組織的相對缺血缺氧及炎癥反應,另一方面引起血管損傷并激活血管內皮細胞。這些特征與急性腦缺血的主要病理過程相似。但是,目前還不清楚缺血前腦部是否已經激活了相應的腦保護機制而出現“預處理”(pretreatment)或“預適應”(preconditioning)效果。
腦缺血后,隨著病程進展,缺血壞死組織通過組織水解酶及炎癥細胞吞噬、消化和吸收,梗死體積縮小,神經功能有所恢復。本實驗顯示,復合腦缺血模型組與單純腦缺血組在各時間點對比,神經功能評分沒有顯著性差異,但缺血后7 d和3 d的差值比較,復合腦缺血模型組差值增大,差異顯著,缺血后3 d無顯著差異。復合腦缺血模型組與單純腦缺血組比較,缺血后7 d梗死體積縮小,差異顯著。結果表明,復合腦缺血在神經功能恢復及梗死體積改善方面優于單純腦缺血組。可能與炎癥反應在缺血不同時期表達變化有關,也可能與高脂血癥病變期誘發體內的某些保護機制有關。
筆者的研究結果顯示,Bcl-2、Bax在伴有腦缺血模型各時間點均有高表達,復合腦缺血組和單純腦缺血組與相應假手術組組內比較,差異顯著(P<0.05);復合腦缺血組與單純腦缺血組比較,表達下降,缺血后3 d、7 d組間差異顯著(P<0.05),Bcl-2/Bax比值升高,在缺血后7 d組間差異顯著(P<0.05)。腦缺血后神經細胞凋亡過程中,Bcl-2/Bax比值升高,對神經元有保護作用。復合腦缺血與單純腦缺血在梗死邊緣區神經元凋亡較少,提示高脂血癥可能通過炎癥因子上調體內抗凋亡基因或下調促凋亡基因的表達,或炎癥因子刺激小膠質細胞、巨噬細胞等分泌一些對缺血腦組織損傷修復作用的物質,如MMP-2〔6〕。
炎癥細胞因子(IL-6、TNF-α)、趨化因子(MCP-1、IL-8)等可通過基因調控 Bcl-2和 Bax的蛋白,從而影響神經元的存活〔7,8〕。而這些炎癥因子也可能在腦缺血缺氧后引起 MMP-2的活化,激活的MMP-2進而導致血腦屏障打開,使炎癥因子及炎癥細胞透過血腦屏障進入中樞神經腦組織,使潛在的MMP-9激活,加重血腦屏障的滲透性,加速了神經元的死亡。也有研究表明MMPs能夠直接誘導細胞死亡,而且認為MMP-9的表達與神經細胞的凋亡同步,參與神經細胞的凋亡過程,但是MMP-2的表達較晚,不直接與神經元的凋亡有關,可能參與了腦缺血后神經細胞的修復〔9〕。筆者的研究表明腦缺血后MMP-2的表達明顯增加(P<0.05),MMP-2在復合腦缺血7 d組的表達也較為顯著(P<0.05)。也有最新研究,在高脂血癥小鼠模型的缺血性微血管中,MMP-2的表達被激活,但是MMP-2激活可能加重了高脂血癥引起的血腦屏障的滲透性〔10〕。這提示了高脂血癥的基礎病理條件能夠影響MMP-2的表達,也提示了高脂血癥發病機制可能存在腦缺血缺氧現象。MMP-2表達的增加可能參與了復合腦缺血的神經元修復,對腦組織細胞具有保護作用。因此,明確高脂血癥的發病機制及MMP-2在高脂血癥復合腦缺血的作用機制還需要做深入研究。
高脂血癥引起的中風〔11〕,其病機也主要為痰瘀互結,進而導致化毒損絡〔12〕。“毒損腦絡”的現代生物學依據主要表現為腦缺血后發的生物級連反應,產生的大量自由基和代謝物質,這些物質積聚成為有害的毒性物質〔11,13〕。毒性物質也可以損傷神經膠質細胞和神經元〔14〕。這為中醫藥防治和治療高脂血癥復合腦缺血/中風提供理論依據。
總之,本研究表明復合腦缺血組與單純腦缺血組比較,在缺血7 d梗死體積縮小,神經功能及腦組織損傷恢復較快,Bcl-2/Bax比值升高,MMP-2的表達明顯增加,可能與高脂血癥在痰瘀基礎上,激發機體抵抗病邪有關,也有可能是在痰瘀基礎上合并腦缺血后一定時間的特殊表現,其遠期結果尚需進一步研究。本研究為運用中醫治療中風及中樞神經系統疾病提供了理論基礎。
1 Zhang C,Zu J,Shi H,et al.The effect of Ginkgo biloba extract(EGb 761)on hepatic sinusoidal endothelial cells and hepatic microcirculation in CCl4 rats〔J〕.Am J Chin Med,2004;32:(1)21-31.
2 Gross A,McDonnell JM,Korsmeyer SJ.BCL-2 family members and the mitochondria in apoptosis〔J〕.Genes Dev,1999;13:(15)1899-911.
3 Nordqvist AC,Smurawa H,Mathiesen T.Expression of matrix metalloproteinases 2 and 9 in meningiomas associated with different degrees of brain invasiveness and edema〔J〕.J Neurosurg 2001;95(5):839-44.
4 Charriaut-Marlangue C,Margaill I,Represa A,et al.Apoptosis and necrosis after reversible focal ischemia:an in situ DNA fragmentation analysis〔J〕.J Cereb Blood Flow Metab,1996;16(2):186-94.
5 王繼生,邱宗蔭,夏永鵬,等.茅莓總皂苷對大鼠局灶性腦缺血/再灌注后神經細胞凋亡及相關蛋白Bcl-2、Bax表達的影響〔J〕.中國藥理學通報,2006;2:(2)224-8.
6 劉勝達.大鼠腦出血后腦組織MMP-2、MMP-9表達及其與腦水腫關系的研究〔J〕.實用心腦肺血管病雜志,2007;15(4):249-51.
7 Sriram K,O'Callaghan JP.Divergent roles for tumor necrosis factor-alpha in the brain〔J〕.J Neuroimmune Pharmacol,2007;2:(2)140-53.
8 Spranger M,Krempien S,Schwab S,et al.Superoxide dismutase activity in serum of patients with acute cerebral ischemic injury.Correlation with clinical course and infarct size〔J〕.Stroke,1997;28(12):2425-8.
9 陳大慶,張 榮,朱烈烈,等,大鼠腦出血后MMP-2、MMP-9的表達與神經元凋亡關系的實驗研究〔J〕.福建醫藥雜志,2008;30(4):4-6.
10 ElAli A,Doeppner TR,Zechariah A,et al.Increased blood-brain barrier permeability and brain edema after focal cerebral ischemia induced by hyperlipidemia:role of lipid peroxidation and calpain-1/2,matrix metalloproteinase-2/9,and RhoA overactivation〔J〕.Stroke,2008;42(11):3238-44.
11 馮加純,張淑琴,饒明俐,等.大鼠全腦缺血再灌注后幾個腦區在不同時間的LPO、SOD、GSH-Px含量變化〔J〕.中風與神經疾病雜志,1994;11(3):129-32.
12 祝維峰.缺血性中風痰瘀互結機制的探討〔J〕.浙江中醫雜志,2000;22(3):57-8.
13 李澎濤,王永炎,黃啟福.“毒損腦絡”病機假說的形成及其理論與實踐意義〔J〕.北京醫藥大學學報,2001;24(1):1-6.
14 Holtzman DM,Sheldon RA,Jaffe W,et al.Nerve growth factor protects the neonatal brain against hypoxic-ischemic injury〔J〕.Ann Neurol,1996;39(1):114-22.

