6周高強度跑臺運動對大鼠關節液及滑膜白細胞介素-1β的影響①
趙景新,王瑜,何曼,金宇,白倫浩
骨關節炎(osteoarthritis,OA)是最常見的關節炎形式和慢性致殘的首要因素,關節軟骨的退行性改變是OA的基本病變。OA通常分為原發性和繼發性兩類,而在繼發性OA中,由運動引起關節軟骨損傷所導致的創傷性關節炎占很大比例。近年來,越來越多的研究表明,白細胞介素-1β(interleukin-1beta,IL-1β)在OA的發病機制中起重要作用。
1 材料與方法
1.1 實驗對象及分組
2月齡清潔級健康雄性Sprague-Dawley大鼠24只,體重(209±11)g,購自承德醫學院實驗動物室。分籠飼養,每籠3只,國家標準嚙齒類動物飼養,自由攝食飲水,動物房溫度18~22℃,相對濕度40%~60%,飼養室每天的明暗時間各為12 h。所有動物實驗前均未進行過跑臺運動實驗,亦未受過任何刺激干擾。
大鼠平衡膳食1周后開始在由跑步機改裝的跑臺上進行適應性運動訓練3 d,坡度0°,速度10 m/min,時間10 min。適應訓練后將大鼠隨機分為安靜對照組和高強度運動組,每組12只。休息2 d后進行正式運動。根據Bedford[1]的研究確定運動強度。正式運動跑臺坡度0°,初始速度10 m/min,在10 min內逐漸增加到28 m/min,并維持此速度60 min,每天1次,每周5 d,共6周。高強度運動組大鼠分別于上午8:00~12:00進行跑臺運動,運動中采用聲音、小木棒驅趕等方式刺激大鼠使其持續運動。整個運動過程中無電刺激。
1.2 取材與指標測定
最后一次運動結束后24 h,10%水合氯醛0.3 mg/kg腹腔麻醉大鼠。取材前各組大鼠禁食12 h。取各組大鼠左側膝關節股骨內側髁及滑膜組織,置4%多聚甲醛中固定,股骨內側髁EDTA脫鈣4周,常規石蠟包埋切片,HE染色,光鏡下觀察關節軟骨及滑膜組織結構變化;免疫組化法測定IL-1β在大鼠滑膜中的表達。隨機選取5個視野,在10×40倍鏡下照相,用OlympusBX52 VIEWER顯微圖像采集系統測定陽性單位的積分光密度值(IOD)。
切開大鼠右側膝關節皮膚及皮下組織,從髕上囊部位向關節腔注入生理鹽水0.5 ml,反復活動關節后,抽取灌洗液約0.2 ml。關節灌洗液置-70℃保存備用。大鼠關節液中IL-1β水平測定采用酶聯免疫吸附法(ELISA)。測定時將每份關節腔灌洗液5倍稀釋后,分別取100 μl稀釋液,嚴格按照試劑盒說明書操作。免疫組化及ELISA試劑盒均購自北京中杉金橋生物技術有限公司。
1.3 統計學分析
2 結果
2.1 HE染色
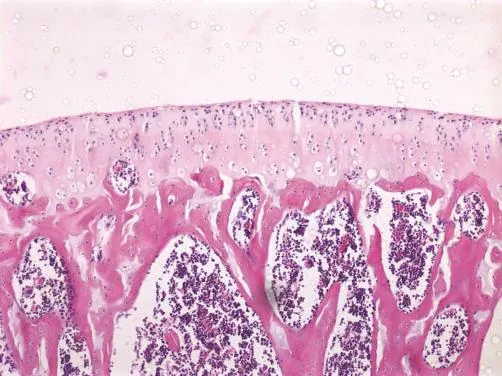
圖1 安靜對照組關節軟骨(HE染色,100×)
安靜對照組大鼠關節軟骨表面光滑,表層軟骨細胞呈梭形,排列密集,其長軸平行于軟骨表面;中間層軟骨細胞呈圓形,排列無規律,呈雙細胞“背靠背”分布;肥大細胞層細胞大,由雙細胞逐漸過渡到多細胞成團分布,無明顯的潮線;鈣化軟骨層及軟骨下骨無明顯病理改變(圖1)。高強度運動組大鼠關節軟骨表面出現潰瘍缺損和小裂隙,軟骨細胞數目減少,排列紊亂,有簇聚現象(圖2)。安靜對照組大鼠滑膜組織滑膜細胞為1~2層,細胞分布較規則,滑膜組織無慢性炎癥表現(圖3)。高強度運動組大鼠滑膜組織增生明顯,滑膜細胞層增生為3~5層,排列紊亂,滑膜下層纖維組織和毛細血管增生,出現單核細胞和淋巴細胞浸潤,并可見到滑膜脂肪水腫(圖4)。
2.2 IL-1β
IL-1β在安靜對照組大鼠的滑膜中有少量表達(圖5)。在高強度運動組大鼠滑膜的滑膜細胞、單核細胞、淋巴細胞和血管內皮細胞呈陽性表達,胞質呈棕黃色(圖6)。高強度運動組大鼠滑膜IL-1β的IOD值明顯高于安靜對照組(P<0.01)。見表1。高強度運動組大鼠膝關節關節液中IL-1β較安靜對照組升高(P<0.05)。見表1。
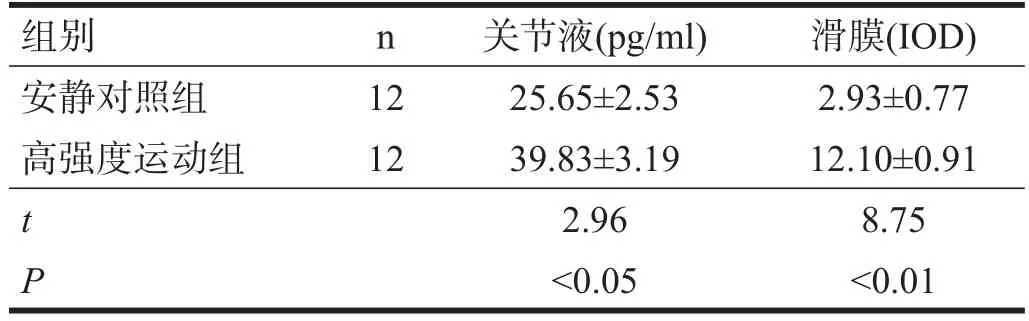
表1 兩組大鼠IL-1β比較
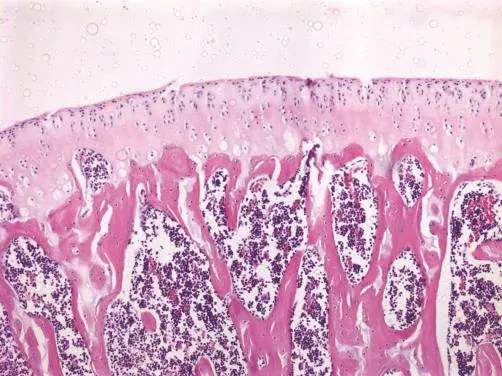
圖2 高強度運動組關節軟骨(HE染色,100×)

圖5 安靜對照組滑膜(IL-1β免疫組化染色,400×)
3 討論
本研究顯示,6周高強度跑臺運動對關節軟骨造成損傷,有導致OA的潛在危險。關節創傷后導致關節軟骨退變即創傷性關節炎,其終末階段與原發性OA末期的臨床表現相同。由于外傷或過度訓練導致的關節軟骨機械性損傷是OA發生的常見原因[2]。一些優秀運動員,即使他們沒有損傷史,膝關節OA發病風險也會增加[3]。運動組大鼠滑膜還出現了滑膜細胞層次增多,炎細胞浸潤等滑膜炎表現。滑膜炎時,滑膜能產生細胞因子和蛋白水解酶,加速關節軟骨的退變[4]。近年來越來越多的研究表明,滑膜組織參與了OA的發病過程。
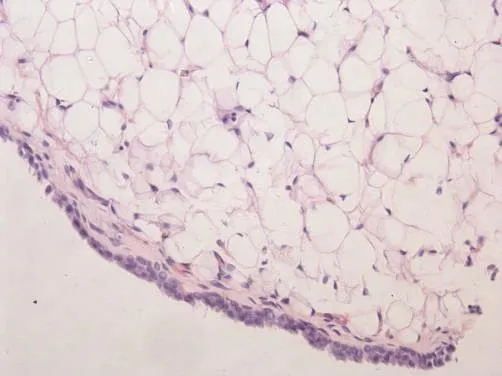
圖4 高強度運動組滑膜(HE染色,400×)
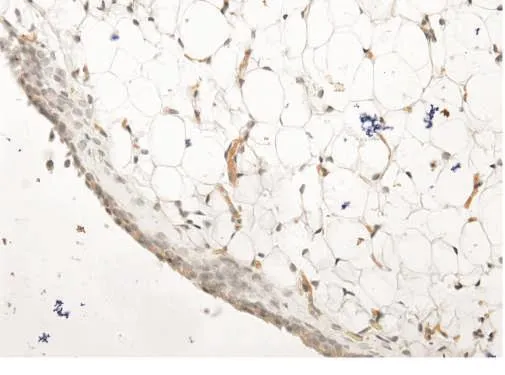
圖6 高強度運動組滑膜(IL-1β免疫組化染色,400×)
有關運動訓練對關節液及滑膜中IL-1β的研究報道較少。IL-1β在OA的發病機制中起著關鍵作用[5-7],OA患者關節液和滑膜中IL-1β呈現高表達狀態[8]。IL-1β由單核細胞、巨噬細胞和滑膜細胞等細胞產生[9]。IL-1β前體在細胞內合成后,被酶切為成熟形態后排出到細胞外。IL-1β通過與軟骨細胞和滑膜細胞表面的受體結合,刺激基質金屬蛋白酶(matrix metalloproteinases,MMPs)、前列腺素E2(Prostaglandin E2,PGE2)、IL-6、IL-8和一氧化氮(NO)的合成,同時抑制Ⅱ型膠原和蛋白多糖的合成及軟骨細胞增殖,對軟骨產生破壞作用[7,10]。尤其在關節軟骨已經損傷的情況下,關節液及滑膜中IL-1β的高表達勢必造成軟骨基質得不到有效的修復,從而使軟骨損傷進一步加重。目前,研究者們已將IL-1β作為OA的治療靶點,通過信號通路調節其表達來發揮治療作用[11-13]。但還處于試驗階段。
長期進行高強度運動,會造成軟骨機械性損傷、滑膜炎癥反應和IL-1β在關節液與滑膜中的高表達三者之間的惡性循環,導致關節軟骨進行性損害,逐漸發生退變,引起骨關節炎的發生。高強度運動所導致的關節軟骨損傷、滑膜炎癥以及關節液、滑膜中IL-1β的異常表達可能是創傷性關節炎發生的機制之一。通過合理的治療手段調節IL-1β的表達,可能延緩甚至阻斷創傷性關節炎病情的發生與發展。但針對IL-1β的治療目前仍不成熟,需進一步的研究。
[1]Bedford TG,Tipton CM,Wilson NC,et al.Maximum oxygen consumption of rats and its changes with various experimental procedures[J].J Appl Physiol,1979,47(6):1278-1283.
[2]Buckwalter JA.Sports,joint injury,and posttraumatic osteoarthritis[J].J Orthop Sports Phys Ther,2003,33(10):578-588.
[3]Spector TD,Harris PA,Hart DJ,et al.Risk of osteoarthritis associated with long-term weight-bearing sports:a radiologic survey of the hips and knees in female ex-athletes and population controls[J].Arthritis Rheum,1996,39(6):988-995.
[4]Ayral X,Pickering EH,Woodworth TG,et al.Synovitis:a potential predictive factor of structural progression of medial tibiofemoral knee osteoarthritis-results of a 1 year longitudinal arthroscopic study in 422 patients[J].Osteoarthritis Cartilage,2005,13(5):361-367.
[5]Ge Z,Hu Y,Heng BC,et al.Osteoarthritis and therapy[J].Arthritis Rheum,2006,55:493-500.
[6]Aigner T,Sachse A,Gebhard PM,et al.Osteoarthritis:pathobiology-targets and ways for therapeutic intervention[J].Adv Drug Delivery Rev,2006,58:128-149.
[7]Lee YA,Choi HM,Lee SH,et al.Synergy between adiponectin and interleukin-1β on the expression of interleukin-6,interleukin-8,and cyclooxygenase-2 in fibroblast-like synoviocytes[J].Exp Mol Med,2012,44(7):440-447.
[8]孫正明,凌鳴,劉淼,等.大骨節病和骨性關節炎患者滑膜白介素-1β和腫瘤壞死因子-α的比較[J].南方醫科大學學報,2009,29(1):5-8.
[9]Choy EH,Panayi GS.Cytokine pathways and joint inflammation in rheumatoid arthritis[J].N Engl J Med,2001,344(12):907-916.
[10]Kamm JL,Nixon AJ,Witte TH.Cytokine and catabolic enzyme expression in synovium,synovial fluid and articular cartilage of naturally osteoarthritic equine carpi[J].Equine Vet J,2010,42(8):693-699.
[11]Montaseri A,Busch F,Mobasheri A,et al.IGF-1 and PDGF-bb suppress IL-1β-induced cartilage degradation through downregulation of NF-κB signaling:involvement of Src/PI-3K/AKT pathway[J].PLoS One,2011,6(12):e28663.
[12]van Buul GM,Villafuertes E,Bos PK.Mesenchymal stem cells secrete factors that inhibit inflammatory processes in short-term osteoarthritic synovium and cartilage explant culture[J].Osteoarthritis Cartilage,2012,20(10):1186-1196.
[13]Itthiarbha A,Phitak T,Sanyacharernkul S,et al.Polyoxypregnane glycoside from Dregea volubilis extract inhibits IL-1β-induced expression of matrix metalloproteinase via activation of NF-κB in human chondrocytes[J].In Vitro Cell Dev Biol Anim,2012,48(1):43-53.

