長期胰島素治療通過促進BNP表達延緩缺血性心力衰竭的發展及其機制*
于立明, 閆文俊, 邢文娟, 喬紅玉, 張 薇, 朱妙章, 高 峰, 于 軍, 張海鋒△
(第四軍醫大學 1教學實驗中心, 2西京醫院心內科, 3生理學教研室, 4唐都醫院心內科, 陜西 西安 710032)
長期胰島素治療通過促進BNP表達延緩缺血性心力衰竭的發展及其機制*
于立明1, 閆文俊2, 邢文娟3, 喬紅玉1, 張 薇4, 朱妙章3, 高 峰3, 于 軍1, 張海鋒1△
(第四軍醫大學1教學實驗中心,2西京醫院心內科,3生理學教研室,4唐都醫院心內科, 陜西 西安 710032)
目的探討心肌梗死后長期胰島素治療對心臟結構與功能的影響及機制。方法對成年雄性SD大鼠行冠狀動脈左前降支結扎手術,并隨機分為4組(每組8~10只):(1)生理鹽水組:心梗后1 mL·kg-1·d-1,ih,4周;(2)胰島素組:2 U·kg-1·d-1,ih,4周;(3)胰島素+wortmannin(Wm, PI3K抑制劑)組:Wm 15 μg·kg-1·d-1,胰島素給藥前15 min,ip;(4)假手術組不結扎冠脈,作為對照。檢測各組大鼠心臟結構及功能,測定心肌細胞PI3K及p38 MAPK表達量,測定血清腦鈉尿肽(BNP)及心肌BNP mRNA表達量。結果心梗后胰島素長期強化治療4周可減少心臟縱軸長度/心臟重量,但對心臟重量/體重和心肌細胞橫截面積無顯著影響,并增加心臟射血分數、左心室發展壓和左室壓微分(均P<0.05);此外,胰島素治療4周可增加PI3K表達和Akt磷酸化,降低p38 MAPK磷酸化水平,同時提高血清BNP水平而不改變心肌細胞BNP mRNA表達量,但該作用不能被Wm阻斷(均P<0.05)。結論心梗后長期胰島素強化治療可通過非PI3K-Akt依賴通路上調BNP水平,減輕心臟病理性重構并改善心功能,延緩缺血性心力衰竭的發展。
心肌缺血; 心力衰竭; 胰島素; 鈉尿肽,腦; p38 絲裂原活化蛋白激酶
缺血性心臟病(ischemic heart disease, IHD)是威脅人類健康的“第一殺手”,如何緩解缺血性心衰的發生和發展是醫學界重要課題之一。本實驗室前期工作首次發現胰島素除代謝調節外,還可通過激活磷脂酰肌醇3-激酶(phospatidylinositol 3-kinase,PI3K)-蛋白激酶B(Akt)-內皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)信號抑制缺血/再灌注(ischemia/reperfusion, I/R)心肌細胞凋亡,促進心肌存活及功能恢復[1-2]。我們的進一步研究證明,心肌缺血早期胰島素治療可通過增加一氧化氮(nitric oxide, NO)的產生,減少心肌細胞凋亡和心肌梗死面積,顯著改善缺血引起的心臟結構和功能長期變化[3],但長期胰島素治療對缺血性心力衰竭的作用尚不清楚。腦鈉尿肽(brain natriuretic peptide, BNP)是心血管系統另一種重要多肽,具有利尿、利鈉、擴血管和抗心肌肥厚等作用,BNP水平在心衰狀態下升高,成為急性和慢性心衰的顯著特征[4]。多年來,在心衰的研究領域中對BNP的研究從未停止,一方面是由于其水平在心衰進展過程中具有重要診斷意義,另一方面則是由于BNP生物學作用的復雜性,且BNP對缺血后心臟的影響及機制仍未完全闡明。因此,本實驗擬研究長期胰島素強化治療對缺血性心力衰竭的作用如何、是否與BNP有關,如相關則進一步探討其信號機制。
材 料 和 方 法
1主要試劑和儀器
3%戊巴比妥鈉和大鼠胰島素(Sigma),wortmannin(Wm,PI3K抑制劑;Santa Cruz),羅氏活力型血糖儀及血糖試紙(Roche),大鼠胰島素和BNP ELISA試劑盒(尚柏生物公司),ACUSON Sequoia 512型超聲心動儀(Siemens),BL420E機能實驗系統(成都泰盟公司),RT-PCR試劑盒(寶生物工程公司),定量PCR儀(伯樂公司)。
2動物模型建立
成年雄性SD大鼠(購自第四軍醫大學動物中心)40只,體重250~300 g,參照Xing等[3]的方法,行冠狀動脈左前降支結扎手術,并隨機分為4組(每組8~10只):(1)生理鹽水組:心梗后1 mL·kg-1·d-1,ih,4周;(2)胰島素組:2 U·kg-1·d-1,ih,4周;(3)胰島素+Wm組:Wm 15 μg·kg-1·d-1,胰島素給藥前15 min,ip;(4)假手術組不結扎冠脈,作為對照。所有大鼠飼養4周。
3血液指標的測定
第4周剪尾法采血,立即使用羅氏血糖測定儀檢測各組大鼠血糖,其余標本靜置離心取血清,采用ELISA方法測血清胰島素和BNP水平,具體方法見試劑盒說明書。
4超聲心動圖檢測
采血完畢稱量大鼠體重,3%戊巴比妥鈉腹腔注射麻醉并固定,用超聲心動儀(頻率14MHz,深度3 cm)測量5個心動周期,取平均值作為最后檢測數據。根據Xing等[3]的方法,測量并計算:收縮期室間隔厚度[systolic interventricular septum thickness, IVS(S)]、左室收縮末期內徑(left ventricular end-systolic dimension, LVESD)、左室舒張末期內徑(left ventricular end-diastolic dimension, LVEDD)及左室射血分數(left ventricular ejection fraction, LVEF)等。
5左室血流動力學檢測
超聲心動圖檢測后第2天,將各組大鼠麻醉后仰臥于手術臺上。分離右側頸總動脈,結扎遠心端,經右側頸動脈插入心導管至左心室,與生物信號采集處理系統相連,連續記錄各組大鼠心率(heart rate, HR)、左室發展壓(left ventricular developed pressure, LVDevP)和左室內壓微分(the instantaneous first derivation of left ventricle pressure, ±LV dp/dtmax)。
6HE及Masson染色
打開胸腔摘取心臟,稱全心重量(heart weight, HW)和全心長度(heart length, HL),并計算HL/HW及全心肥厚指數(HW/BW),然后在結扎處下2 mm切取0.5 cm厚的心肌組織橫切面,進行常規脫水石蠟包埋切片后,做HE及Masson三色染色。
7Westernblotting檢測心肌組織PI3K、Akt、糖原合成酶激酶3β(glycogensynthasekinase3β,GSK3β)及p38絲裂原活化蛋白激酶(p38mitogen-activatedproteinkinase,p38MAPK)等表達及磷酸化水平
剪取缺血區心肌標本0.1 g,常規方法提蛋白,并用BCA法蛋白濃度定量。Western blotting檢測PI3K、Akt、p-Akt、p38 MAPK、p-p38 MAPK、GSK3β、p-GSK3β表達情況,以β-actin作為內參照,使用ECL-Plus試劑盒發光,并通過生化檢測系統成像。用Image-Pro Plus軟件分析蛋白條帶密度。
8實時熒光定量PCR檢測心肌β-肌球蛋白重鏈(β-myosinheavychain,β-MHC)、心房鈉尿肽(atrialnatriureticpeptide,ANP)和BNPmRNA含量
應用Trizol抽提組織總RNA,采用RT-PCR試劑盒檢測。ANP上游引物5’-CTGGGACCCCTCCGATAGAT-3’,下游引物5’-TCGGTACCGGAAGCTGTTG-3’;BNP上游引物5’-GGGCTGTGACGGGCTGAGGTT-3’,下游引物5’-AGTTTGTGCTGGAAGATAAGA-3’;β-MHC上游引物5’-GCAGCTTATCAGGAAGGAATAC-3’,下游引物5’-CTTGCGTACTCTGTCACTC-3’;GAPDH上游引物5’-AACTCCCTCAAGATTGTCAGCAA-3’,下游引物5’-CAGTCTTCTGAGTGGCAGTGATG-3’。引物由大連寶生物公司設計并合成,擴增條件:95℃10 min進入循環;95℃ 15 s,60℃/55.1℃ 1 min,循環40次。以目的基因的表達/內參照基因的表達對ANP、BNP、β-MHC mRNA表達相對定量。
9統計學處理
數據以均數±標準差(mean±SD)表示,采用Prism 5.0軟件分析,多組間數據比較采用方差分析(ANOVA),若總體差異顯著,再以LSD-t檢驗分析相應兩組間的顯著性差別。以P<0.05為差異有統計學意義。
結 果
1心梗后長期胰島素強化治療顯著改善心臟功能和結構
與生理鹽水組相比,超聲心動圖結果顯示胰島素治療有效增加左室射血分數,并使心腔縮小,室間隔增厚,顯著改善心肌缺血后心臟結構,而使用wortmannin則降低射血分數,使心腔擴大,室間隔變薄,抑制了胰島素的保護作用(均P<0.05),見圖1。

Figure 1. Insulin treatment for 4 weeks significantly increased cardiac function and retarded cardiac remodeling. A: echocardiography; B: left ventricular ejection fraction (LVEF); C: systolic interventricular septum thickness [IVS(S)]; D: systolic left ventricle cavity dimension [LV(S)]. Ins: insulin; Wm: wortmannin. Mean±SD.n=8.**P<0.01vssham;#P<0.05vsMI+saline;△△P<0.01vsMI+Ins.
圖1胰島素治療4周顯著增加心肌缺血后心臟射血分數,改善心臟結構
血流動力學結果顯示,胰島素治療4周顯著升高LVDevP和±LV dp/dtmax(均P<0.05),明顯改善心功能。使用wortmannin顯著降低LVDevP和±LV dp/dtmax(均P<0.05),抑制了胰島素的保護作用,見表1。
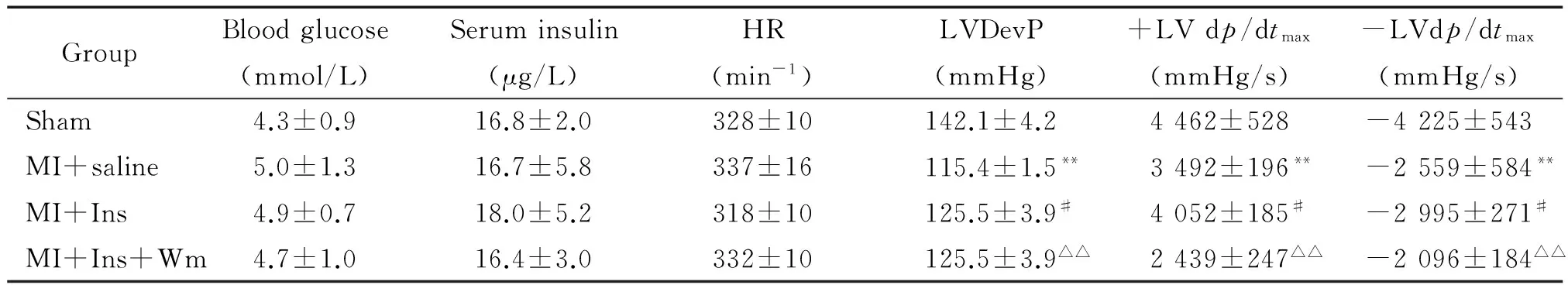
表1 胰島素治療4周顯著改善心肌缺血后心臟血流動力學功能
Ins: insulin; Wm: wortmannin.**P<0.01vssham;#P<0.05vsMI+saline;△△P<0.01vsMI+Ins.
2心梗后長期胰島素強化治療減輕心肌缺血后心臟病理性重構
HE染色心肌切片顯示,與生理鹽水組相比,胰島素治療組心肌細胞排列更加規整,見圖2A;Masson染色顯示,與生理鹽水組相比,胰島素治療組梗死纖維化區域及左室橫截面積明顯縮小,室壁增厚,wortmannin顯著抑制了胰島素的保護作用,見圖2B。另外,長期胰島素治療減少HL/HW,但對HW/BW和心肌細胞橫截面積無顯著影響,見圖2C、D、E。

Figure 2. Insulin treatment for 4 weeks attenuated cardiac pathological remodeling. A: HE staining(×400); B: Masson staining; C: heart length/heart weight (HL/HW); D: heart weight/body weight (HL/BW); E: cross-sectional cell area. Ins: insulin; Wm: wortmannin. Mean±SD.n=8.**P<0.01vssham;#P<0.05vsMI+saline;△P<0.05vsMI+Ins.
圖2胰島素治療4周減輕心肌缺血后心臟病理性重構
3胰島素激活PI3K-Akt通路,并抑制p38MAPK通路
Western blotting檢測發現胰島素可增加PI3K表達,促進Akt及GSK3β磷酸化,激活心肌梗死周邊區PI3K-Akt信號,同時降低p38 MAPK磷酸化水平,抑制p38 MAPK信號通路,見圖3。

Figure 3. Insulin treatment activated PI3K-Akt signaling pathway and inhibited p38 MAPK signaling. A:PI3K expression;B:Akt phosphorylation;C:GSK3β phosphorylation;D:p38 MAPK phosphorylation. Ins: insulin; Wm: wortmannin. Mean±SD.n=10.**P<0.01vssham;#P<0.05,##P<0.01vsMI+saline;△P<0.05,△△P<0.01vsMI+Ins.
圖3胰島素激活PI3K-Akt通路和抑制p38MAPK通路
4長期胰島素治療升高血清BNP濃度,但不改變心肌BNPmRNA表達
通過檢測病理性心臟重構相關基因mRNA水平,發現胰島素長期治療顯著減少β-MHC和ANP mRNA水平,并且可增加血清中BNP濃度,但對心肌BNP mRNA水平則無顯著影響。與胰島素治療組相比,使用PI3K抑制劑wortmannin可顯著提高心臟重構相關基因水平,但是對血清BNP水平及心肌BNP mRNA水平無顯著影響 ,見圖4。
討 論
近年來,基礎及臨床研究證實胰島素不僅發揮調節能量代謝的作用,還可通過多種促生存和抗凋亡信號途徑參與心肌保護[5],是葡萄糖-胰島素-鉀極化液(glucose-insulin-potassium,GIK)保護缺血心肌的關鍵成分[1]。已有實驗證明胰島素可減輕缺血/再灌注損傷,促進心肌存活及心功能恢復,然而心肌缺血后長期胰島素強化治療對缺血性心力衰竭的作用及機制尚未完全闡明[6]。本研究通過結扎大鼠冠狀動脈左前降支構建缺血性心力衰竭動物模型,發現心梗后長期胰島素強化治療可通過激活生存信號PI3K-Akt,抑制p38 MAPK信號,減輕心臟病理性重構、延緩缺血性心力衰竭并改善心功能。

Figure 4. Effects of long-term insulin treatment on serum BNP level (A) and myocardial mRNA expression of BNP (B),β-MHC (C) and ANP (D). Ins: insulin; Wm: wortmannin. Mean±SD.n=10.**P<0.01vssham;#P<0.05,##P<0.01vsMI+saline;△P<0.05vsMI+Ins.
圖4長期胰島素治療對血清中BNP濃度的影響
BNP是1988年首次從豬腦內分離得到的一種具有強效利鈉、利尿、擴血管和降壓作用的多肽,由于其生物學作用的復雜性及對心衰診斷與預后評價的特殊價值而備受關注[7]。BNP是由心肌細胞合成的具有生物活性的天然激素,當左心室功能不全時,由于心肌擴張而快速合成釋放入血,有助于調節心臟功能。深入研究發現,BNP可發揮減輕缺血/再灌注損傷[8],抑制病理性心肌肥厚和抗凋亡抗纖維化等作用[4],延緩缺血性心衰進程。我們發現長期胰島素強化治療可顯著提高血清BNP水平,而不改變心肌BNP mRNA水平,BNP可能參與胰島素的心肌保護作用。
作為心血管系統兩大重要激素,胰島素與鈉尿肽系統相互作用機制尚不明確。有研究表明,BNP減輕心臟缺血/再灌注損傷可能與PI3K-Akt信號通路有關[8-9],而胰島素抵抗患者與非胰島素抵抗患者相比,血清N端BNP前體的水平顯著下降[10]。這些結論都提示,胰島素信號通路與鈉尿肽信號通路可能有密切關系。本實驗證實,缺血性心臟病情況下胰島素可提高血清BNP水平而不改變心肌細胞BNP mRNA含量,故胰島素可能在轉錄后水平調節血清BNP含量,其具體機制有待于進一步研究。前期研究已證實胰島素有2條信號通路:PI3K-Akt-eNOS及Ras-MAPK信號通路,前者發揮擴管、抗凋亡和抑制氧化應激等作用保護心肌,后者發揮促細胞增殖作用,促心肌肥厚,生理情況下二者相互平衡,共同調節,但在以胰島素抵抗為主特征的糖尿病患者則嚴重抑制前者,后者穩定不變甚至強化,加重心血管疾病的病程及預后[5]。Xing等[3]發現,心梗后給予短期胰島素治療可激活梗死周邊區PI3K-Akt-eNOS信號保護缺血心肌,而Gao等[11]研究發現胰島素通過激活PI3K-Akt信號而非Ras-MAPK信號減輕心肌缺血再灌注損傷,另外,有研究顯示抑制p38 MAPK信號通路可抑制內皮黏附分子表達減輕缺血再灌注損傷[12]。本研究證實,缺血區周圍心肌p38 MAPK激活,發揮促進心臟肥厚等作用,而使用長期外源胰島素治療可促進心肌PI3K-Akt信號而相對抑制Ras-MAPK信號通路,抑制缺血心肌梗死,減輕缺血心臟病理重構,改善心功能,延緩心力衰竭的發展。同時注意到胰島素治療上調血清BNP,而這種作用不能被PI3K抑制劑wortmannin阻斷,同時wortmannin也不能改變缺血心肌BNP mRNA水平,即胰島素可通過非PI3K-Akt依賴途徑對BNP產生正性作用,Ras-MAPK信號通路很可能參與胰島素對BNP的調控,其具體機制有待進一步研究。
本研究首次證實心梗后胰島素長期強化治療可通過非PI3K-Akt依賴途徑促進BNP表達,延緩缺血性心衰的發展,提示胰島素對長期缺血性心臟病及缺血性心衰的潛在治療價值,對糖尿病合并心梗的病人尤有意義,其詳細機制有待在糖尿病等模型進一步研究。
[1] Gao F, Gao E, Yue TL, et al. Nitric oxide mediates the antiapoptotic effect of insulin in myocardial ischemia-reperfusion: the roles of PI3-kinase, Akt, and endothelial nitric oxide synthase phosphorylation[J]. Circulation, 2002,105(12):1497-1502.
[2] Gao F, Tao L, Yan W, et al. Early anti-apoptosis treatment reduces myocardial infarct size after a prolonged reperfusion[J]. Apoptosis, 2004,9(5):553-559.
[3] Xing W, Yan W, Fu F, et al. Insulin inhibits myocardial ischemia-induced apoptosis and alleviates chronic adverse changes in post-ischemic cardiac structure and function[J]. Apoptosis, 2009,14(9):1050-1060.
[4] Kapoun AM, Liang F, O’Young G, et al. B-type natriuretic peptide exerts broad functional opposition to transforming growth factor-beta in primary human cardiac fibroblasts: fibrosis, myofibroblast conversion, proliferation, and inflammation[J]. Circ Res, 2004,94(4):453-461.
[5] Yu Q, Gao F, Ma XL. Insulin says no to cardiovascular disease[J]. Cardiovasc Res, 2011,89(3):516-524.
[6] 裴漢軍, 宋光遠, 吳永健, 等. 糖尿病在糖尿病大鼠心肌梗死后心力衰竭形成中的效應[J]. 中國病理生理雜志, 2009,25(6):1051-1058.
[7] Di Angelantonio E, Chowdhury R, Sarwar N, et al. B-type natriuretic peptides and cardiovascular risk: systematic review and meta-analysis of 40 prospective studies[J]. Circulation, 2009,120(22):2177-2187.
[8] Sun Y, Deng T, Lu N, et al. B-type natriuretic peptide protects cardiomyocytes at reperfusion via mitochondrial calcium uniporter[J]. Biomed Pharmacother, 2010,64(3):170-176.
[9] 王華祖, 龔興國. 蛋白激酶B的研究進展[J]. 中國病理生理雜志, 2003,19(11):84-89.
[10] Khan AM, Cheng S, Magnusson M, et al. Cardiac natriuretic peptides, obesity, and insulin resistance: evidence from two community-based studies[J]. J Clin Endocrinol Metab, 2011,96(10):3242-3249.
[11] Gao F, Yan WL, Zhang HF, et al.Anti-apoptotic effect of insulin in myocardial ischemia-reperfusion and its principal signaling pathway[J]. Zhonghua Nei Ke Za Zhi, 2003,42(3):153-156.
[12] Gao F, Yue TL, Shi DW, et al. p38 MAPK inhibition reduces myocardial reperfusion injury via inhibition of endothelial adhesion molecule expression and blockade of PMN accumulation[J]. Cardiovasc Res, 2002,53(2):414-422.
Long-terminsulintreatmentimprovespostischemiccardiacstructureandfunctionviaincreasingserumBNPlevels
YU Li-ming1, YAN Wen-jun2, XING Wen-juan3, QIAO Hong-yu1, ZHANG Wei4, ZHU Miao-zhang3, GAO Feng3, YU Jun1, ZHANG Hai-feng1
(1CenterofTeachingExperiment,2DepartmentofCardiology,XijingHospital,3DepartmentofPhysiology,4DepartmentofCardiology,TangduHospital,ForthMilitaryMedicalUniversity,Xi’an710032,China.E-mail:hfzhang@fmmu.edu.cn)
AIM: To investigate the influence of long-term insulin treatment on postischemic cardiac structural and functional changes, and to further explore the underlying mechanisms.METHODSAdult male SD rats were randomly divided into 4 groups (8~10 rats per group): sham group, myocardial infarction (MI) + saline (1 mL·kg-1·d-1, hypodermic injection for 4 weeks) group, MI + insulin (2 U·kg-1·d-1, hypodermic injection for 4 weeks) group and MI + insulin (2 U·kg-1·d-1, hypodermic injection for 4 weeks) + wortmannin [a phosphatidylinositol 3-kinase (PI3K) inhibitor; 15 μg·kg-1·d-1, intraperitoneal injection 15 min before each insulin treatment] group. The rats in the latter 3 groups were subject to ligation of the left anterior descending coronary artery, while those in sham group underwent the same surgical procedures without tying the sutures. The cardiac structural and functional changes were observed by echocardiogram, heart catheterization and microscopy with HE and Masson trichrome staining. Blood glucose was determined by Roche blood glucose meter, and the serum levels of insulin and brain natriuretic peptide (BNP) were detected by ELISA. The protein expression and phosphorylation of PI3K, Akt, glycogen synthase kinase 3β (GSK3β) and p38 mitogen-activated protein kinase (p38 MAPK) in myocardial tissues were detected by Western blotting. The mRNA expression of BNP, β-myosin heavy chain (β-MHC) and atrial natriuretic peptide (ANP) in myocardial tissues was determined by real-time fluorescence quantitative PCR.RESULTSAt the end of the 4th week, MI rats receiving long-term insulin treatment showed decreased ratio of heart length/heart weight, smaller systolic left ventricle cavity, thicker systolic interventricular septum, and increased cardiac ejection fraction, left ventricular development pressure and instantaneous first derivate of left ventricle pressure (P<0.05vsMI + saline group). Moreover, insulin treatment significantly increased the phosphorylation of PI3K and Akt and the serum level of BNP, and inhibited the phosphorylation of p38 MAPK (P<0.05vsMI + saline group), but did not change the mRNA expression of BNP in myocardial tissues. The effects of insulin on BNP were not blocked by wortmannin (P>0.05vsMI + insulin group).CONCLUSIONInsulin improves postischemic cardiac structure and function by increasing serum BNP levels possibly independent of PI3K-Akt signaling pathway.
Myocardial ischemia; Heart failure; Insulin; Natriuretic peptide,brain; p38 mitogen-activated protein kinases
R331.31
A
1000- 4718(2013)09- 1554- 07
2013- 04- 28
2013- 07- 11
國家自然科學基金資助項目(No. 81270330; No.31271220; No. 81270329; No.81100083)
△通訊作者 Tel: 029-84779277; E-mail: hfzhang@fmmu.edu.cn
10.3969/j.issn.1000- 4718.2013.09.003

