硫化氫通過調控NF-κB通路抑制阿霉素引起的心肌細胞炎癥與細胞毒性*
徐文明, 郭潤民, 陳景福, 陳 剛, 郭瑞鮮, 馮鑒強, 廖新學
(1中山大學附屬第一醫院黃埔院區內科,廣東 廣州 510700; 2廣東醫學院附屬醫院心內科,廣東 湛江 524001;3中山大學中山醫學院生理學教研室,廣東 廣州 510080;中山大學附屬第一醫院 4心血管內科, 5高血壓血管病科,廣東 廣州 510080)
硫化氫通過調控NF-κB通路抑制阿霉素引起的心肌細胞炎癥與細胞毒性*
徐文明1, 郭潤民2, 陳景福2, 陳 剛1, 郭瑞鮮3, 馮鑒強3, 廖新學4,5△
(1中山大學附屬第一醫院黃埔院區內科,廣東 廣州 510700;2廣東醫學院附屬醫院心內科,廣東 湛江 524001;3中山大學中山醫學院生理學教研室,廣東 廣州 510080;中山大學附屬第一醫院4心血管內科,5高血壓血管病科,廣東 廣州 510080)
目的探討硫化氫(H2S)是否通過調控核因子κB(NF-κB)通路抑制阿霉素(DOX)引起的心肌細胞炎癥反應與細胞毒性。方法應用Western blotting法測定NF-κB p65表達;酶聯免疫吸附試驗(ELISA)測定白細胞介素(IL)-1β、IL-6及腫瘤壞死因子α(TNF-α)的分泌水平;細胞計數盒(CCK-8)檢測細胞存活率,Hoechst 33258核染色法檢測凋亡細胞的形態學及數量的變化。結果應用5 μmol/L DOX處理H9c2心肌細胞明顯上調磷酸化NF-κB p65(p-p65)表達水平,并引起炎癥反應和細胞毒性,表現為IL-1β、IL-6、TNF-α的分泌水平升高、凋亡細胞數量增多及細胞存活率降低。400 μmol/L NaHS(H2S供體)預處理30 min能顯著抑制DOX對心肌細胞p-p65表達的上調作用,并減輕DOX引起的炎癥反應和細胞損傷,使IL-1β、IL-6、TNF-α的分泌水平下降、凋亡細胞數量降低及細胞存活率升高。與NaHS的作用相似,NF-κB抑制劑吡咯烷二硫代氨基甲酸鹽(PDTC,100 μmol/L)預處理也能阻斷DOX引起的心肌炎癥反應和細胞毒性。IL-1受體拮抗劑(IL-1Ra, 20 μg/L)與DOX共處理能拮抗DOX對心肌細胞NF-κB p65的激活作用及細胞毒性作用。結論在DOX引起的心肌細胞炎癥中,NF-κB通路與IL-1β之間存在正的相互作用;H2S可通過抑制NF-κB通路保護心肌細胞對抗DOX引起的炎癥反應與細胞毒性。
硫化氫; NF-κB; 阿霉素; 心肌細胞; 炎癥反應
阿霉素(又稱多柔比星,doxorubicin, DOX)是一種臨床上常用的化療藥物,用于治療白血病及一些實體癌腫,如乳腺癌、卵巢癌和小細胞肺癌等。然而,由于它能引起嚴重的劑量依賴性的急性或慢性心肌毒性(cardiotoxicity)[1-2],故限制了其在臨床上的應用。DOX引起心肌毒性的機制是多方面的,其中的一個病理生理機制是誘發心肌細胞炎癥反應。Sauter等[3]報道,DOX引起一些炎癥細胞因子,如白細胞介素 (interleukin, IL)-1β、IL-6和腫瘤壞死因子α(tumor necrosis factor α, TNF-α)的分泌增多。值得注意的是,TNF-α能激活核因子 κB(nuclear factor-κB, NF-κB)[4]。柔紅霉素(daunorubicin,DOX類似物)能增強TNF-α對NF-κB的激活作用[5],提示NF-κB可能也參與DOX引起的炎癥。但是,在DOX引起的心肌細胞炎癥中,NF-κB通路的作用如何?尚未完全清楚。
NF-κB是一個二聚體轉錄因子,具有調節與應激反應(包括炎癥、氧化應激、凋亡等)相關的基因的作用,并參與心肌的炎癥與壞死過程[6]。最近,我們證實,第3種內源性氣體信號分子——硫化氫(hydrogen sulfide,H2S)能通過抑制NF-κB/環氧化酶2(cyclooxygenase-2, COX-2)通路保護人皮膚角質形成細胞(HaCat細胞)對抗化學性低氧引起的炎癥[7],并能保護心肌細胞對抗DOX心肌毒性[8]。因此,我們推測外源性H2S可通過調控NF-κB通路對抗DOX引起的心肌細胞炎癥。為了驗證上述推測,本研究應用5 μmol/L DOX處理H9c2心肌細胞建立DOX心肌毒性實驗模型[8],重點探討:(1)NF-κB在DOX引起的心肌細胞炎癥中的作用;(2)硫氫化鈉(sodium hydrosulfide,NaHS;H2S供體)能否通過調控NF-κB通路對抗DOX引起的心肌細胞炎癥反應。
材 料 和 方 法
1材料
DOX和NaHS購自Sigma-Aldrich,細胞計數試劑盒8(Cell Counter Kit-8, CCK-8)由Dojindo Lab提供,蛋白預覽marker(10~170 kD)購自Fermenta,DMEM-F12 培養基以及特級胎牛血清購自Gibco BRL,抗NF-κB p65、磷酸化NF-κB p65(p-p65)抗體及吡咯烷二硫代氨基甲酸鹽(pyrrolidine dithiocarbamate,PDTC;NF-κB 抑制劑) 購自Cell Signaling Technology。IL-1受體拮抗劑(IL-1 receptor antagonist, IL-1Ra)購自ProSpec。IL-1β、IL-6 和TNF-α ELISA試劑盒購自武漢博士德生物工程有限公司。
2細胞培養與實驗分組
H9c2心肌細胞來源于大鼠胚胎期心臟組織,培養于含10%胎牛血清的DMEM-F12培養基,置于5% CO2、37 ℃的溫箱條件下培養。實驗分8組:(1)正常對照組;(2)DOX損傷組:應用5 μmol/L DOX處理H9c2心肌細胞;(3)PDTC預處理+DOX損傷組:100 μmol/L PDTC作用心肌細胞30 min,撤去,用PBS洗2次,接著應用5 μmol/L DOX 作用24 h;(4)NaHS預處理+DOX損傷組:400 μmol/L NaHS作用H9c2 心肌細胞30 min, 撤去,用PBS洗2次,接著應用5 μmol/L DOX 作用24 h;(5)IL-1Ra+DOX共處理組:參考Byrne等[9]介紹的方法應用20 μg/L IL-1β受體阻斷劑IL-1 Ra與DOX共同處理H9c2心肌細胞24 h;(6)PDTC組:單獨應用100 μmol/L PDTC作用心肌細胞30 min;(7)NaHS組:單獨應用400 μmol/L NaHS作用H9c2 心肌細胞30 min;(8)IL-1Ra組:單獨應用20 μg/L IL-1Ra處理H9c2細胞24 h。
3細胞存活率的測定
H9c2 心肌細胞接種于96孔培養板中,當細胞生長到培養孔的約80%面積時, 根據實驗需要進行不同的處理,每個處理因素設4個復孔。終止培養后,每孔加入10 μL CCK-8,輕搖,37 ℃孵育2 h,用酶標儀(λ=450 nm)記錄各孔的吸光度(A)。取4孔A值的平均數,按下列公式計算細胞存活率:細胞存活率(%)=處理組A/對照組A×100%,重復3次。
4Hoechst33258核染色法觀察凋亡細胞形態和數量改變
H9c2 心肌細胞按分組要求(1)正常對照組;(2)DOX損傷組;(3)NaHS預處理+DOX損傷組;(4)NaHS組)進行相應的處理后,小心棄去培養基,用PBS 洗1遍,4% 多聚甲醛固定10 min,PBS 漂洗后,加入5 mg /L Hoechst 33258 試劑,室溫輕搖30 min。在熒光顯微鏡(BX50-FLA, Olympus) 下攝片,染色質均勻分布,核被染成均勻藍色的細胞定為正常細胞,核呈濃縮、碎裂的明亮藍色細胞定為凋亡細胞,隨機選取視野在熒光顯微鏡下攝片。
5ELISA法測定IL-1β、IL-6和TNF-α的分泌水平
采用雙抗體夾心ABC-ELISA 法檢測培養基中IL-1β、IL-6和TNF-α的水平。H9c2細胞接種于96孔培養板中,當80%融合時,分別給予不同的條件處理培養基,每組3個復孔。處理完成后,取100 μL培養基加入預先用IL-1β、IL-6 和TNF-α抗體包被的酶標板中,37 ℃孵育90 min,然后吸出培養基,加入IL-1β、IL-6和TNF-α抗體繼續孵育60 min,經TBS漂洗3次,加入生物素標記的Ⅱ抗,反應30 min,采用TMB 法顯色,經終止液終止反應后,用酶標儀(Multiscan MK3,Thermo Labsystems)記錄450 nm 波長處的吸光度。取3 孔標準化處理后的A值進行統計分析。
6Westernblotting法檢測NF-κB的表達水平
H9c2心肌細胞接種于60 mm培養皿中,各實驗組給予不同的處理因素后,用預冷的PBS洗2次,加入細胞裂解液,4 ℃靜置30 min,12 000 r/min離心10 min,取上清,采用BCA法進行蛋白定量。總蛋白經SDS-PAGE分離后,轉移到PVDF膜上。用5%脫脂奶粉封閉1.5 h,隨后加入抗p65和p-p65抗體(1∶1 000),4 ℃過夜,用TBST洗3次,10 min/次。將PVDF膜用發光試劑ECL顯色,暗室曝光到X線片上,凝膠成像系統掃描分析結果。
7統計學處理
用SPSS 13.0統計軟件分析,數據用均數±標準誤(mean±SEM)表示,組間比較用單因素方差分析(One-way ANOVA),兩兩比較按LSD-t檢驗進行,檢驗水準P<0.05。以P<0.05為差異有統計學意義。
結 果
1硫化氫抑制DOX對心肌細胞磷酸化NF-κBp65表達的上調作用
應用5 μmol/L DOX處理H9c2細胞90 min能明顯增加p-p65的表達水平,與正常對照組比較,差異有統計學意義(P<0.01)。但是,在DOX處理心肌細胞前,應用400 μmol/L NaHS預處理30 min能顯著抑制DOX對p-p65表達的上調作用(P<0.01)。單獨應用400 μmol/L NaHS處理心肌細胞30 min對p-p65的表達無明顯的影響,見圖1。

Figure 1. Hydrogen sulfide inhibited doxorubicin (DOX)-induced up-regulation of phosphorylated NF-κB p65 (p-p65) expression in H9c2 cells. Mean±SEM.n=5.**P<0.01vscontrol;##P<0.01vsDOX.
圖1硫化氫抑制DOX對心肌細胞磷酸化NF-κBp65表達的上調作用
2硫化氫和NF-κB抑制劑抑制DOX對心肌細胞IL-1β分泌的促進作用
圖2顯示,應用5 μmol/L DOX處理H9c2細胞24 h可明顯增加IL-1β的分泌水平,與正常對照組比較,差異有統計學意義(P<0.01)。400 μmol/L NaHS預處理30 min能顯著阻斷DOX對心肌細胞IL-1β分泌的促進作用(P<0.01)。與NaHS的作用相似,在DOX處理心肌細胞前,應用100 μmol/L PDTC預處理30 min也能抑制DOX對IL-1β分泌的促進作用(P<0.01)。單獨NaHS 或PDTC預處理本身不影響IL-1β的基礎分泌水平。上述結果提示H2S可通過抑制NF-κB通路繼而阻斷DOX對心肌細胞IL-1β分泌的促進作用。
3硫化氫和NF-κB抑制劑抑制DOX對心肌細胞IL-6分泌的促進作用
圖3顯示,應用5 μmol/L DOX處理H9c2細胞24 h可引起IL-1β的分泌明顯增多,與正常對照組比較,差異有統計學意義(P<0.01)。在DOX處理心肌細胞前,分別應用400 μmol/L NaHS或100 μmol/L PDTC預處理30 min均能減弱DOX對心肌細胞IL-6分泌的促進作用(P<0.01)。單獨NaHS 或PDTC預處理本身對心肌細胞IL-6的基礎分泌無明顯影響。上述結果提示,H2S可通過抑制NF-κB通路繼而抑制DOX對心肌細胞IL-6分泌的促進作用。

Figure 2. Hydrogen sulfide and NF-κB inhibitor PDTC attenuated doxorubicin(DOX)-induced over-secretion of IL-1β in H9c2 cells. Mean±SEM.n=5.**P<0.01vscontrol;##P<0.01vsDOX.
圖2硫化氫和NF-κB抑制劑抑制DOX對心肌細胞IL-1β分泌的促進作用

Figure 3. Hydrogen sulfide and NF-κB inhibitor PDTC blocked doxorubicin(DOX)-induced increase in IL-6 secretion in H9c2 cells. Mean±SEM.n=5.**P<0.01vscontrol;##P<0.01vsDOX.
圖3硫化氫和NF-κB抑制劑抑制DOX對心肌細胞IL-6分泌的促進作用
4硫化氫和NF-κB抑制劑阻斷DOX對心肌細胞TNF-α分泌的促進作用
圖4顯示,應用5 μmol/L DOX處理H9c2細胞24 h,可明顯地增加TNF-α的分泌水平,與正常對照組比較,差異有統計學意義(P<0.01)。在DOX處理心肌細胞前,分別應用400 μmol/L NaHS或100 μmol/L PDTC預處理30 min可顯著阻斷DOX對心肌細胞TNF-α分泌的促進作用(P<0.01)。單獨NaHS 或PDTC預處理本身對心肌細胞TNF-α的基礎分泌無明顯的影響。
5硫化氫抑制DOX引起的心肌細胞凋亡
Hoechst 33258 核染色檢測結果顯示,正常H9c2心肌細胞染色質分布均勻,為彌散均勻的低密度熒光(圖5A)。但是,經5 μmol/L DOX處理24 h后,未經硫化氫預處理的H9c2心肌細胞呈現典型的凋亡特征,即細胞核呈現濃縮致密的固縮形態或顆粒熒光(圖5B)。400 μmol/L NaHS預處理本身對H9c2心肌細胞的凋亡無明顯的影響(圖5D),但是,NaHS預處理能明顯地對抗5 μmol/L DOX對心肌細胞的致凋亡作用,使呈現濃縮致密的固縮形態或顆粒狀熒光的凋亡細胞數量明顯減少(圖5C)。

Figure 4. Hydrogen sulfide and NF-κB inhibitor PDTC reduced doxorubicin(DOX)-induced up-regulation of TNF-α secretion in H9c2 cells. Mean±SEM.n=5.**P<0.01vscontrol;##P<0.01vsDOX.
圖4硫化氫和NF-κB抑制劑抑制DOX對心肌細胞TNF-α分泌的上調作用
6IL-1β受體拮抗劑抑制DOX對心肌細胞p-p65表達的上調作用
圖6顯示,IL-1Ra與DOX共處理可明顯地減弱DOX對p-p65表達的上調作用。單獨IL-1Ra處理H9c2心肌細胞90 min對p-p65的基礎表達無明顯的作用。結合圖2的實驗結果,提示在DOX誘發心肌細胞炎癥反應中,NF-κB與IL-1β之間存在正的相互作用。
7NF-κB和IL-1β介導DOX引起的心肌細胞毒性
圖7顯示,應用5 μmol/L DOX處理H9c2心肌細胞24 h可引起細胞毒性,使細胞存活率明顯地降低,與正常對照組比較,差異有統計學意義(P<0.01)。在DOX處理心肌細胞前,應用100 μmol/L PDTC預處理30 min可抑制DOX引起的細胞毒性,使細胞存活率明顯升高(P<0.01)。另一方面,應用 20 μg/L IL-1Ra與DOX共同處理H9c2細胞24 h也能拮抗DOX引起的細胞毒性(P<0.01)。單獨應用PDTC或IL-1Ra處理心肌細胞對細胞存活率無明顯影響。上述結果提示NF-κB和IL-1β參與DOX引起的心肌細胞毒性。
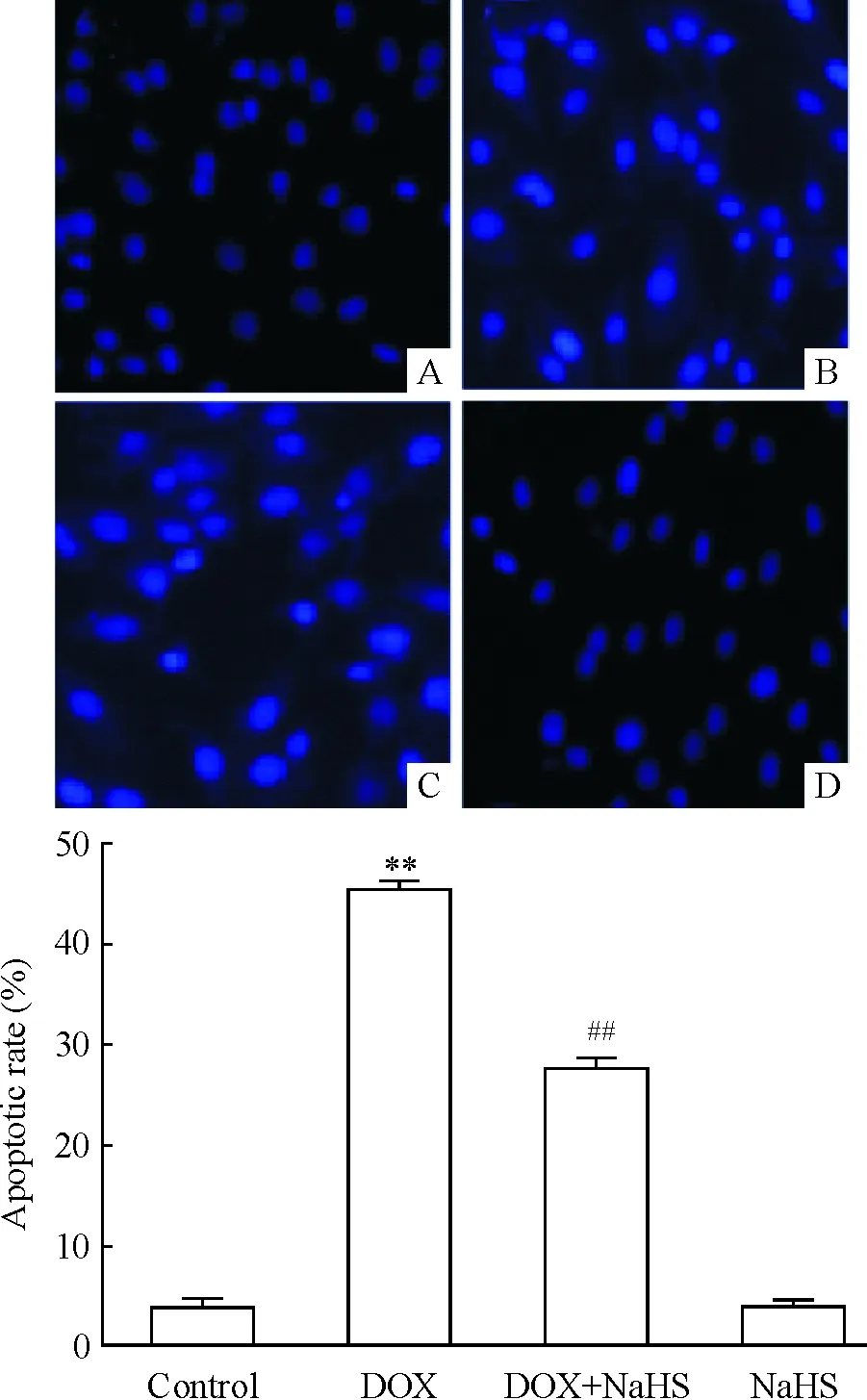
Figure 5. Inhibitory effect of hydrogen sulfide on doxorubicin(DOX)-induced apoptosis of H9c2 cells (Hoechst staining,×400).A:control group;B:DOX group; C:DOX+NaHs group;D:NaHS group. Mean±SEM.n=5.**P<0.01vscontrol;##P<0.01vsDOX.
圖5硫化氫抑制DOX對心肌細胞的致凋亡作用

Figure 6. Antagonist of IL-1β receptor (IL-1Ra) depressed doxorubicin(DOX)-induced up-regulation of phosphorulated NF-κB p65 (p-p65) expression level in H9c2 cells. Mean±SEM.n=5.**P<0.01vscontrol;##P<0.01vsDOX.
圖6IL-1β受體拮抗劑抑制DOX對心肌細胞p-p65表達的上調作用

Figure 7. Both NF-κB and IL-1β mediated doxorubicin(DOX)-induced cytotoxicity in H9c2 cells. Mean±SEM.n=5.**P<0.01vscontrol;##P<0.01vsDOX.
圖7NF-κB和IL-1β介導DOX引起的心肌細胞毒性
討 論
近年,炎癥在DOX心肌毒性中的作用日益受到重視。本研究在DOX處理H9c2細胞的實驗模型中觀察到,DOX能引起心肌細胞炎癥反應,表現為前炎癥因子IL-1β、IL-6和TNF-α的分泌明顯增多,這與一些報道的結果一致[3,10]。有報道指出,DOX可能是激活癌細胞NF-κB通路的誘導者[11],因此,本研究觀察DOX對心肌細胞p-NF-κB p65表達的影響。NF-κB被認為是控制炎癥反應的核心因子。NF-κB家族主要由5個亞單位:即NF-κB1(p50)、NF-κB2(p52)、p65(RelA)、RelB和c-Rel構成[12]。其中p65是NF-κB發揮功能的必需亞單位。與前文[11]的結果相似,本研究觀察到,DOX能明顯地上調H9c2細胞p-NF-κB p65的表達水平,提示DOX能激活NF-κB通路。進一步的研究還發現,NF-κB抑制劑PDTC能抑制DOX對心肌細胞IL-1β、IL-6和TNF-α分泌的上調作用,提示激活NF-κB通路可能是DOX引起心肌細胞炎癥反應的機制之一。
IL-1β被認為是一種在免疫和炎癥反應調節中起重要作用的細胞因子,參與DOX對IL-6分泌的促進作用[3]。為了探討在DOX誘導的心肌細胞炎癥中,IL-1β與NF-κB之間是否存在相互作用,本研究觀察了IL-1β受體拮抗劑IL-1Ra對DOX引起NF-κB激活作用的影響。結果表明,IL-1Ra能拮抗DOX對p-p65表達的上調作用,結合上述的結果(PDTC抑制DOX對IL-1β分泌的促進作用),提示IL-1β與NF-κB之間可能存在正的相互作用。有報道指出,IL-1可持續地激活蛋白激酶,繼而導致NF-κB核轉移,引起細胞死亡[13]。Ing等[14]也報道,IL-1可通過促進一氧化氮的生成而引起心肌細胞死亡。因此,這種相互作用可加重DOX引起的心肌炎癥反應與損傷,可能是DOX誘發心肌細胞炎癥的一個新機制,今后需進一步深入研究。
H2S是繼一氧化碳和一氧化氮之后被發現的第3種內源性氣體信號分子。近年,越來越多的研究證實,H2S具有心肌保護作用[8,13-16]。值得注意的是,DOX能抑制心肌細胞內源性H2S的生成[8],外源性H2S能保護心肌細胞,對抗DOX引起的心肌毒性[8,15]。本研究進一步證實,NaHS在抑制DOX細胞毒性及細胞凋亡的同時,能阻斷DOX對IL-1β、IL-6和TNF-α分泌的上調作用,提示H2S能抑制DOX引起的心肌炎癥反應,并發現外源性H2S也能抑制DOX對NF-κB通路的激活作用,提示通過抑制NF-κB通路可能是H2S抑制DOX誘導的心肌炎癥的作用機制之一。最近,我們證實,H2S可通過其抗氧化作用抑制NF-κB通路,繼而抑制化學性缺氧引起的HaCat細胞炎癥[7]。因此,H2S是否通過抗氧化機制抑制NF-κB通路繼而抑制DOX引起的心肌細胞炎癥,尚需進一步探討。
[1] Scully RE, Lipshultz SE. Anthracycline cardiotoxicity in long-term survivors of childhood cancer[J]. Cardiovasc Toxicol, 2007, 7(2):122-128.
[2] Hrdina R, Gersl V, KlimtovI, et al. Anthracycline-induced cardiotoxicity[J].Acta Medica (Hradec Kralove) , 2000, 43(3):75-82.
[3] Sauter KA, Wood LJ, Wong J, et al. Doxorubicin and daunorubicin induce processing and release of interleukin-1beta through activation of the NLRP3 inflammasome[J]. Cancer Biol Ther, 2011,11(12):1008-1016.
[4] Riganti C, Doublier S, Costamagna C, et al. Activation of nuclear factor-κB pathway by simvastatin and RhoA silencing increases doxorubicin cytotoxicity in human colon cancer HT29 cells[J]. Mol Pharmacol, 2008, 74(2):476-484.
[5] Boland MP, Foster SJ, O’Neill LA. Daunorubicin activates NFκB and induces κB-dependent gene expression in HL-60 promyelocytic and Jurkat T lymphoma cells[J]. J Biol Chem, 1997,272(20):12952-12960.
[6] Shi Y, Moon M, Dawood S, et al. Mechanisms and management of doxorubicin cardiotoxicity[J].Herz, 2011,36(4):296-305.
[7] Yang C, Yang Z, Zhang M, et al.Hydrogen sulfide protects against chemical hypoxia-induced cytotoxicity and inflammation in HaCaT cells through inhibition of ROS/NF-κB/COX-2 pathway[J]. PLoS One, 2011,6(7):e21971.
[8] Wang XY, Yang CT, Zheng DD, et al. Hydrogen sulfide protects H9c2 cells against doxorubicin-induced cardiotoxicity through inhibition of endoplasmic reticulum stress[J]. Mol Cell Biochem, 2012,363(1-2):419-426.
[9] Byrne LS, Peng J, Sarkar S, et al. Interleukin-1 beta-induced up-regulation of opioid receptors in the untreated and morphine-desensitized U87 MG human astrocytoma cells[J]. J Neuroinflammation, 2012,9: 252.
[10] Riad A, Bien S, Westermann D, et al. Pretreatment with statin attenuates the cardiotoxicity of Doxorubicin in mice[J]. Cancer Res, 2009,69(2):695-699.
[11] Yu HG, Ai YW, Yu LL, et al. Phosphoinositide 3-kinase/Akt pathway plays an important role in chemoresistance of gastric cancer cells against etoposide and doxorubicin induced cell death[J]. Int J Cancer, 2008,122(2):433-443.
[12] Abd-El-Aleem SA, Ferguson MW, Appleton I, et al.Expression of cyclooxygenase isoforms in normal human skin and chronic venous ulcers[J]. J Pathol, 2001,195(5):616-623.
[13] Schreck R, Rieber P, Baeuerle PA. Reactive oxygen intermediates as apparently widely used messengers in the activation of the NF-kappa B transcription factor and HIV-1[J]. EMBO J,1991,10(8): 2247-2258.
[14] Ing DJ, Zang J, Dzau VJ, et al. Modulation of cytokine-induced cardiac myocyte apoptosis by nitric oxide, Bak, and Bcl-x[J]. Circ Res,1999,84(1): 21-33.
[15] 李建平, 楊春濤, 楊戰利, 等.CFTR氯通道在硫化氫誘導的心肌保護及細胞增殖中的作用[J].中國病理生理雜志, 2009, 25(6): 1070-1075.
[16] 蘇鈺雯, 杜軍保, 韓 薇, 等.硫化氫供體對阿霉素心肌病大鼠氧化應激作用的影響[J]. 中國病理生理雜志, 2008, 24(8): 1469-1474.
Hydrogensulfideinhibitsdoxorubicin-inducedinflammationandcytotoxicityinratcardiomyocytesbymodulatingactivationofNF-κBpathway
XU Wen-ming1, GUO Run-ming2, CHEN Jing-fu2, CHEN Gang1, GUO Rui-xian3, FENG Jian-qiang3, LIAO Xin-xue4,5
(1DepartmentofInternalMedicine,RegionofHuangpu,theFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510700,China;2DepartmentofCardiology,AffiliatedHospital,GuangdongMedicalCollege,Zhanjiang524001,China;3DepartmentofPhysiology,ZhongshanSchoolofMedicine,SunYat-senUniversity,Guangzhou510080,China;4DepartmentofCardiovasology,5DepartmentofHypertension&VascularDiseases,theFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510080,China.E-mail:liaoxinx@mail.sysu.edu.cn)
AIM: To investigate whether hydrogen sulfide (H2S) attenuates doxorubicin (DOX)-induced inflammation and cytotoxicity in rat cardiomyocytes (H9c2 cells) by modulating nuclear factor κB (NF-κB) pathway.METHODSThe expression of NF-κB p65 was measured by western blotting. The secretion levels of interleukin (IL)-1β, IL-6 and tumor necrosis factor α (TNF-α) were tested by enzyme-linked immunosorbent assay (ELISA). Cell viability was detected by Cell Counting Kit-8 (CCK-8) assay. Hoechst 33258 nuclear staining was used to detect the morphological changes and number of apoptotic cells.RESULTSTreatment of H9c2 cells with 5 μmol/L DOX significantly up-regulated the expression level of phosphorylated NF-κB p65 (p-p65), and induced inflammation and cytotoxicity, as evidenced by increases in secretion levels of IL-1β, IL-6 and TNF-α and number of apoptotic cells as well as a decrease in cell viability. Pretreatment of H9c2 cells with 400 μmol/L NaHS (a donor of H2S) for 30 min markedly depressed the up-regulation of p-p65 expression induced by DOX. In addition, NaHS pretreatment also reduced DOX-induced inflammatory response and injury, leading to decreases in IL-1β, IL-6 and TNF-α secretion and number of apoptotic cells as well as an increase in cell viability. Similar to the effect of NaHS, pretreatment with 100 μmol/L pyrrolidine dithiocarbamate (PDTC), an inhibitor of NF-κB, also blocked DOX-induced cardiac inflammation and cytotoxicity. Co-administration of IL-1 receptor antagonist (IL-1Ra) and DOX reduced DOX-induced activation of NF-κB and cytotoxicity in H9c2 cells.CONCLUSIONDuring the DOX-induced cardiomyocyte inflammation, there is positive interaction between NF-κB pathway and IL-1β. H2S may protect cardiomyocytes against DOX-induced inflammatory response and cytotoxicity by inhibiting NF-κB pathway.
Hydrogen sulfide; NF-kappa B; Doxorubicin; Cardiomyocytes; Inflammatory response
R363
A
1000- 4718(2013)09- 1561- 06
2013- 06- 24
2013- 08- 28
國家自然科學基金資助項目(No.81270296);廣東省科技計劃(No.2012B031800358)
△通訊作者 Tel: 020-87332628; E-mail: liaoxinx@mail.sysu.edu.cn
10.3969/j.issn.1000- 4718.2013.09.004

