PKCε信號通路介導槲皮素拮抗心肌細胞缺氧/復氧損傷*
湯 蕾, 彭易安, 胥甜甜, 易小清, 劉 瑛, 羅喻超, 尹 東, 何 明△
(1南昌大學食品科學與技術國家重點實驗室,江西 南昌330047; 2南昌大學藥學院藥理學與分子治療學教研室,江西 南昌 330006; 3南昌大學第二附屬醫院分子醫學中心實驗室,江西 南昌330006)
PKCε信號通路介導槲皮素拮抗心肌細胞缺氧/復氧損傷*
湯 蕾1,2, 彭易安1,2, 胥甜甜2, 易小清2, 劉 瑛2, 羅喻超2, 尹 東3, 何 明1,2△
(1南昌大學食品科學與技術國家重點實驗室,江西 南昌330047;2南昌大學藥學院藥理學與分子治療學教研室,江西 南昌 330006;3南昌大學第二附屬醫院分子醫學中心實驗室,江西 南昌330006)
目的探討槲皮素拮抗心肌細胞缺氧/復氧(A/R)損傷與蛋白激酶Cε(PKCε)之間的關系。方法培養新生大鼠原代心肌細胞,構建A/R模型,Western blotting檢測槲皮素對PKCε表達水平的調節。檢測A/R損傷后各組細胞乳酸脫氫酶活性、肌酸激酶活性、細胞存活率、活性氧(ROS)含量、線粒體膜電位、線粒體通透性轉換孔(mPTP)的開放和細胞凋亡。結果A/R前72 h加入40 μmol/L槲皮素可明顯上調心肌細胞PKCε蛋白表達水平,并顯著提高細胞存活率,減少ROS產生,維持線粒體膜電位,抑制mPTP開放,減少細胞凋亡(P<0.01)。同時經槲皮素和PKCε抑制劑εV1-2預處理后,則槲皮素的上述保護作用均明顯減弱或消失(P<0.01)。結論槲皮素可以上調心肌細胞PKCε蛋白表達水平,其抗心肌缺血再灌注損傷的保護作用機制可能依賴于PKCε途徑。
槲皮素; 蛋白激酶Cε; 心肌保護; 缺氧/復氧
心肌缺血/再灌注(ischemia/reperfusion, I/R) 損傷引起的心肌細胞凋亡或壞死是心力衰竭主要致死原因之一。在過去幾十年中,一些植物化學物如黃酮類物質被發現具有心肌保護作用。槲皮素(quercetin,Que)是自然界中含量最豐富的黃酮醇類化合物,動物實驗已證實槲皮素可以對抗心、腦、腎等多種組織器官的I/R引起的氧化應激損傷,一些流行病學研究也提出槲皮素的日常攝入量與冠心病發病和致死率之間的負相關[1]。雖然黃酮醇類物質對心血管系統的保護作用主要是源于其強大的抗氧化性,但已有研究發現,其具體機制可能還涉及某些細胞內信號路徑功能和特定蛋白質表達水平的調控[2-3]。
蛋白激酶Cε(protein kinase C epsilon,PKCε)是蛋白激酶C家族成員之一,其功能涉及多種病理生理過程,包括有絲分裂、應激狀況下的細胞存活、新陳代謝和轉錄調控等。大量的研究已證實,缺血預適應、缺血后適應等多種心肌保護機制均涉及PKCε信號路徑[4]。我們曾發現,槲皮素預處理可以上調心肌細胞PKCε蛋白表達水平。在本研究中,我們采用新生大鼠原代心肌細胞,建立急性缺氧/復氧(anoxia/reoxygenation, A/R)模型,確認槲皮素預處理上調PKCε蛋白表達水平的最佳時間和濃度;并選用特異性PKCε抑制物εV1-2,探討槲皮素抗心肌細胞A/R損傷作用與其對PKCε蛋白表達水平調節之間的關系。
材 料 和 方 法
1動物
出生1~3d的清潔級Sprague-Dawley(SD)大鼠,雌雄不拘,購自南昌大學實驗動物科學部。
2主要試劑
MEM培養基購自Gibco-BRL;胎牛血清購自杭州四季青生物工程材料有限公司;槲皮素購自中國食品藥品檢定研究院;RIPA裂解液購自碧云天生物技術有限公司;抗體購自Santa Cruz;PKCε特異性抑制劑εV1-2購自Anaspec;乳酸脫氧酶(lactate dehydrogenase,LDH)和肌酸激酶(creatine kinase,CK)檢測試劑盒購自南京建成科技有限公司;噻唑藍[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, MTT]購自Sigma;活性氧(reactive oxygen species,ROS)熒光染料DCFH-DA (2’,7’-dichlorodihydrofluorescein diacetate)和線粒體膜電位熒光探針JC-1(5,5’,6,6’-tetrachloro-1,1’,3,3’-tetraethylbenzi-midazolocarbocyanine iodide)購自Invitrogen;線粒體/胞質分離試劑盒購自BioVision;Annexin V/PI凋亡檢測試劑盒購自BD Biosciences。
3方法
3.1細胞培養及實驗分組 根據文獻[5]方法制備新生大鼠原代心肌細胞。取出SD乳鼠心臟,分離心室組織,用0.1%胰酶,37 ℃水浴消化數次。至組織消化完全后將全部細胞混懸液接種到100 mm培養皿,置于5%CO2、37 ℃培養箱1.5 h,進行差速貼壁除去成纖維細胞。按實驗需要分別將細胞接種于6孔板和96孔板。5%CO2、37 ℃培養24 h后,換培養液為含10% FBS的MEM(含0.1 mmol/L BrdU以抑制纖維細胞生長),2~3 d后開始可用于實驗處理。實驗分為對照組(常規培養,不經A/R處理)、A/R組(缺氧3 h后復氧2 h)、Que+A/R組(在A/R前72 h加入40 μmol/L槲皮素)、 Que +εV1-2+A/R組(A/R前72 h加入40 μmol/L槲皮素,A/R前30 min加入1 μmol/L抑制劑εV1-2)和 εV1-2+A/R組(A/R前30 min加入1 μmol/L抑制劑εV1-2)。
3.2A/R模型的建立 參照文獻方法[6],配制模擬缺氧液和模擬復氧液。A/R處理開始時,對培養心肌細胞換用預先經95% N2和5% CO2混和氣體飽和過的模擬缺氧溶液,置于持續95%N2-5%CO2平衡的A/R裝置(37 ℃)中缺氧孵育3 h后,再換用模擬再灌注溶液于95%O2-5%CO2(37 ℃)。復氧孵育2 h。對照組細胞于常規生長培養基中,5%CO2、37 ℃孵育5 h。
3.3Western blotting 檢測PKCε蛋白表達水平 各組細胞經A/R處理后,用RIPA 裂解液充分裂解細胞后,12 000 r/min,4 ℃離心15 min,取上清。加入上樣緩沖液98 ℃加熱變性5 min。各組取等量蛋白液進行SDS-PAGE凝膠電泳及轉膜。將膜置于含10% 脫脂牛奶的TBS-T封閉液中 2 h,與1∶500稀釋的抗PKCε Ⅰ抗室溫振蕩孵育1 h, TBS-T洗膜,再與1∶2 000稀釋的辣根過氧化物酶標記Ⅱ抗孵育1 h,TBS-T洗膜。 加化學發光劑于膜上反應1 min, X射線膠片曝光分析。
3.4LDH及CK活性檢測 實驗結束后,取各組細胞培養液用于檢測CK和LDH活性,具體操作按試劑說明書進行。
3.5細胞存活率檢測 采用MTT實驗來比較各組細胞經A/R處理后的細胞存活率變化。各組細胞按1×104cells/well的密度接種于96孔板,A/R處理后,去除培養基,加入MTT (5×10-3mg/L) 37 ℃ 孵育4 h后,棄上清,加入150 μL/well DMSO室溫振蕩10 min充分溶解結晶, 使用酶標儀測定各孔490 nm波長處的吸光度。結果以對照組吸光度的百分比表示。
3.6細胞內活性氧含量檢測 A/R后,收集各組心肌細胞用預冷的PBS洗2次,用配制好的10 μmol/L DCFH-DA溶液500 μL重懸細胞,37 ℃孵育30 min,800×g離心5 min,棄上清;預冷的PBS洗滌細胞2~3次,立即進行流式細胞儀(Becton Dickinson)檢測以488 nm為激發波長、530 nm為發射波長測各組的綠色熒光強度。
3.7線粒體膜電位檢測 A/R后,收集各組心肌細胞用預冷的PBS洗2次,分別加入10 μL JC-1(200 μmol/L),37 ℃孵育20 min,800×g離心5 min,棄上清;PBS洗滌細胞2~3次,制成108/L的懸液,立即進行流式細胞儀檢測,分別以488 nm為激發光波長,527 nm和590 nm為發射光波長測綠色和紅色熒光強度,以各組紅/綠熒光強度的比值反映線粒體膜電位水平。
3.8線粒體腫脹實驗檢測線粒體通透性轉換孔(mitochondrial permeability transition pore,mPTP)的開放 采用線粒體/胞質分離試劑盒分離新生大鼠原代心肌細胞線粒體。操作如下:收獲的細胞用預冷的PBS洗2次,用1.0 mL 1×Cytosol Extraction Buffer Mix重懸細胞,冰浴10 min;細胞移入勻漿器中,充分勻漿至70%~80%細胞破裂;轉移至離心管,4 ℃、700×g離心10 min, 收集上清至新的離心管,4 ℃、10 000×g離心30 min,上清為胞漿。線粒體沉淀中加入500 μL Swelling Buffer重懸,用于mPTP開放檢測。
根據文獻方法[7],采用Ca2+誘導的線粒體腫脹實驗檢測mPTP的開放。在520 nm 波長處測各組吸光度初值(A1),加200 μmol·L-1CaCl2誘導mPTP開放,每隔1~2 min測量數據變化,20 min后吸光度不再變化,記錄此時吸光度值(A2),△A=A1-A2。用ΔA/min×1 000表示mPTP開放程度,此數值越大,mPTP開放程度越大。預先加入30 nmol·L-1mPTP阻滯劑cyclosporin A作為陰性對照。
3.9細胞凋亡檢測 細胞凋亡的檢測采用Annexin V/PI凋亡檢測試劑盒。A/R后,收集各組心肌細胞用預冷的PBS洗2次后,用1×Binding Buffer重懸細胞,使細胞密度為約5×109cells/L。先后加入10 μL Annexin V-FITC 和 5 μL PI,輕度渦旋后,室溫避光孵育15 min,加入300 μL Binding Buffer,立即進行流式細胞儀檢測(激發光488 nm;發射光578 nm),各組陽性細胞百分率用于表示細胞凋亡水平。
4統計學處理
數據以均數±標準差(mean±SD)表示,采用SPSS 11.5進行方差齊性檢驗,組間均數比較采用單因素方差分析(One way-ANOVA),兩兩比較采用LSD法,以P<0.05為差異有統計學意義。
結 果
1槲皮素上調A/R處理的新生大鼠原代心肌細胞PKCε蛋白表達水平
經槲皮素預處理組的PKCε蛋白表達水平都有不同程度上調,其中72 h前預處理組的蛋白表達水平普遍高于24及48 h預處理組(結果未顯示)。在72 h預處理的各濃度組中,40 μmol/L槲皮素預處理組PKCε蛋白表達水平最高,與對照組及A/R組相比差異均有統計學意義(P<0.01),見圖1。在之后的實驗中,所有涉及槲皮素預處理的分組,其處理方式均為A/R前72 h加入40 μmol/L槲皮素。

Figure 1. Effect of quercetin(Que) on PKCε expression in rat primary cardiomyocytes exposed to A/R.Mean±SD.n=3.**P<0.01vscontrol group or A/R group.
圖1槲皮素對A/R處理的大鼠原代心肌細胞PKCε蛋白表達水平的影響
2槲皮素及εV1-2預處理對心肌細胞狀態及存活率的影響
如表1所示,與對照組相比,A/R組細胞培養液CK和LDH活性明顯升高(P<0.01),提示A/R損傷模型建立成功。但槲皮素預處理組的CK和LDH活性則明顯低于A/R組(P<0.01),說明槲皮素預處理可以保護心肌細胞免受A/R損傷。有趣的是,槲皮素加εV1-2預處理組CK和LDH活性明顯高于單純槲皮素預處理組(P<0.01),說明PKCε抑制劑εV1-2取消了槲皮素的心肌保護作用。而εV1-2+A/R組的結果與A/R組無明顯差異,說明此劑量的εV1-2不影響基礎狀態下的PKCε功能。與A/R組相比,槲皮素預處理組的細胞存活率明顯升高(P<0.01),額外加入εV1-2則呈現出較低的細胞活率 (P<0.01vsQue +A/R組)。同樣,εV1-2+A/R組細胞存活率與A/R組無明顯差異。
表1槲皮素或槲皮素加εV1-2預處理對A/R損傷后心肌細胞LDH、CK和細胞存活率及線粒體膜電位的影響
Table 1. The changes of LDH, CK, cell viability and mitochondrial membrane potential in cardiomyocytes pretreated with quercetin (Que) or Que plus εV1-2(Mean±SD.n=5)

GroupCellviability(%)LDHactivity(U/L)CKactivity(U/L)Mitochondrialmembranepotential(red/green)Control10060.00±2.9845.17±3.37 1.62±0.11 A/R31.72±2.35**144.00±7.97**132.00±8.72**0.63±0.09**Que+A/R88.65±4.78▲▲63.00±5.34▲▲71.79±4.67▲▲1.37±0.08▲▲Que+εV1-2+A/R40.30±3.99##129.00±6.01##120.89±5.55##0.76±0.12##εV1-2+A/R34.51±2.21135.23±8.37126.30±7.740.61±0.07
**P<0.01vscontrol group;▲▲P<0.01vsA/R group;##P<0.01vsQue+A/R group.
3槲皮素及εV1-2預處理對A/R誘導的心肌細胞ROS產生的影響
如圖2所示,A/R組ROS含量明顯高于對照組,槲皮素預處理可明顯抑制A/R導致的ROS產生(P<0.01vsA/R組)。槲皮素預處理后再加入εV1-2則使ROS含量明顯升高(P<0.01vsQue+A/R組),與A/R組水平接近。

Figure 2. Quercetin(Que) preconditioning decreased the ROS generation in cardiomyocytes induced by A/R, while this effect was abrogated by εV1-2. Mean±SD.n=5.**P<0.01vscontrol group;△△P<0.01vsA/R group;##P<0.01vsQue+A/R group.
圖2槲皮素或槲皮素加εV1-2預處理對A/R損傷后心肌細胞內ROS含量的影響
4槲皮素及εV1-2預處理對A/R引起的心肌細胞線粒體膜電位變化的影響
本實驗以紅/綠熒光的比值衡量線粒體膜電位水平。如表1所示,A/R組細胞的紅/綠熒光比值明顯低于正常對照組,表明A/R處理引起了線粒體膜電位的下降。而同樣經歷A/R的槲皮素預處理組,該比例卻明顯高于A/R組,說明槲皮素預處理可以減輕A/R引起的線粒體膜電位下降。在槲皮素加εV1-2預處理組,紅/綠熒光比值明顯低于單純槲皮素預處理組,說明εV1-2的加入取消了槲皮素對線粒體膜電位的保護作用。
5槲皮素及εV1-2預處理對A/R引起的mPTP開放的影響
如圖3所示,除加入cyclosporin A的陰性對照組外,各組吸光度均呈現出下降,說明我們所觀察到的吸光度變化是mPTP 開放特異性的。其中A/R組吸光度下降趨勢明顯強于正常對照組 (P<0.01),說明A/R損傷降低了線粒體膜對Ca2+的耐受性,增強了mPTP 的開放,而槲皮素預處理組的吸光度變化程度明顯低于A/R 組(P<0.01),說明槲皮素預處理可以抑制A/R引起的mPTP 開放。而槲皮素及εV1-2預處理組吸光度變化明顯大于單純槲皮素處理組(P<0.01),表明εV1-2取消了槲皮素抑制mPTP開放的作用。

Figure 3. Quercetin(Que) preconditioning suppressed the mPTP opening in cardiomyocytes induced by A/R, while this effect was abrogated by εV1-2. A: original traces were shown for Ca2+-dependent mitochondrial swelling, monitored by the decrease in absorbance; B: rate of mitochondrial swelling induced by 200 μmol/L CaCl2.Mean±SD.n=5.**P<0.01vscontrol group;△△P<0.01vsA/R group;##P<0.01vsQue+A/R group.
圖3槲皮素或槲皮素加εV1-2預處理對A/R損傷后心肌細胞mPTP開放的影響
6槲皮素及εV1-2預處理對A/R引起的心肌細胞凋亡的影響
如圖4所示,A/R組凋亡細胞百分率明顯高于正常對照組(P<0.01)。與之相比,槲皮素預處理組細胞凋亡水平則明顯降低(P<0.01),說明槲皮素預處理可以抑制A/R引起的心肌細胞凋亡,而槲皮素加εV1-2預處理組,凋亡水平則明顯高于單純槲皮素處理組(P<0.01),說明εV1-2減弱槲皮素的抗凋亡作用。
討 論
心肌I/R引起的心肌細胞死亡及功能損傷是各種缺血性心臟病患者死亡的主要原因。缺血組織再灌注時,氧的再次供給導致ATP的生成,但損壞的電子傳遞系統引起大量線粒體ROS生成以及各種氧化應激損傷。線粒體鈣超載和ROS含量的增加導致mPTP開放,離子穩態被破壞,線粒體膜電位進一步崩塌,凋亡信號因子進入胞漿啟動細胞凋亡,最終引起組織和器官的功能損傷[8]。槲皮素強大的抗氧化作用可以減輕肝、腎、心、腦等多種器官的缺血再灌注損傷,改善細胞功能[3,9]。Ikizler等[10]進行離體心臟灌流實驗發現,SD大鼠連續7 d進行50 mg/kg槲皮素灌胃或全心缺血前30 min進行15 mmol/L槲皮素灌注,都可明顯對抗隨后的I/R損傷。其中連續7 d處理組的差異更顯著。這提示我們槲皮素的心肌保護作用可能涉及相關蛋白質的表達調控。
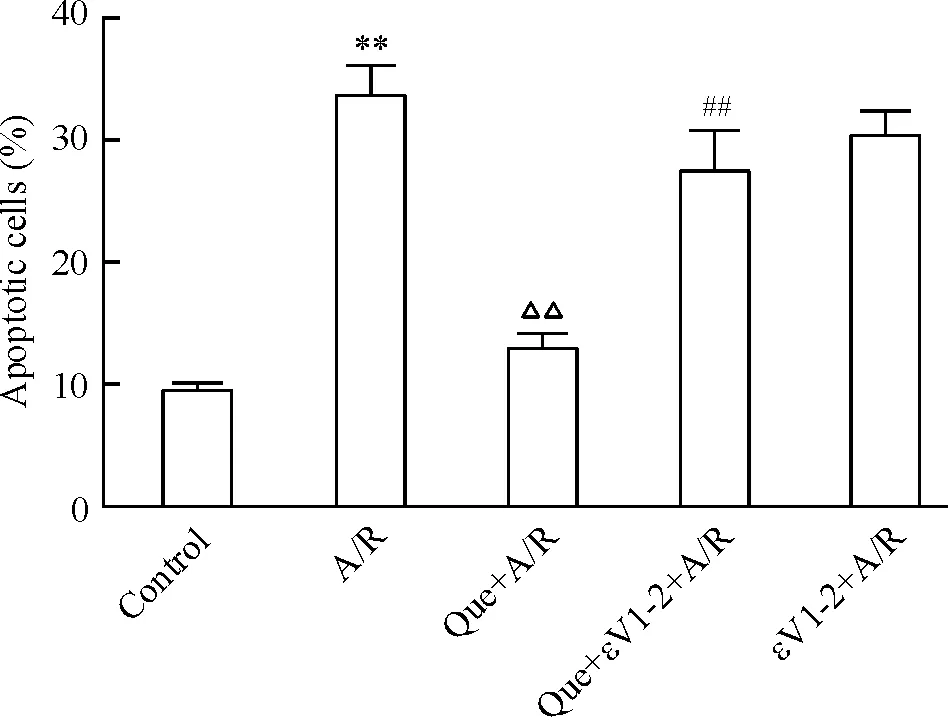
Figure 4. Quercetin(Que) preconditioning inhibited the apoptosis of cardiomyocytes induced by A/R, while this effect was abrogated by εV1-2.Mean±SD.n=5.**P<0.01vscontrol group;△△P<0.01vsA/R group;##P<0.01vsQue+A/R group.
圖4槲皮素或槲皮素加εV1-2預處理對A/R損傷后心肌細胞凋亡的影響
本研究首次證實槲皮素預處理可以明顯上調心肌細胞PKCε蛋白表達水平。為探討槲皮素的心肌保護作用是否依賴于其對PKCε蛋白表達水平的上調,我們采用了特異性的PKCε抑制劑εV1-2,在不影響基礎水平PKCε蛋白功能的濃度下,比較單純槲皮素預處理組和槲皮素加εV1-2預處理組心肌細胞在經A/R損傷后,細胞存活率、細胞內ROS含量、線粒體膜電位、mPTP開放及細胞凋亡的變化。結果表明在加入特異性PKCε抑制劑εV1-2后,槲皮素的各種抗A/R損傷保護作用包括提高細胞存活率、減少細胞內ROS產生,維持線粒體膜電位,抑制mPTP開放等,均有不同程度的減弱,甚至完全消失。這說明槲皮素上述心肌保護作用的實現涉及PKCε信號路徑的功能。
細胞凋亡是心肌I/R損傷的主要特征,也是其導致患者死亡的主要原因,因此減少細胞凋亡是各種心肌保護作用的關鍵。雖然槲皮素的抗腫瘤作用是源于其能夠促進卵巢癌、胰腺癌和食道癌等腫瘤細胞的凋亡[11-12],但也有研究發現,槲皮素可以抑制魚藤酮誘導的PC12細胞凋亡及腎、腦等組織I/R損傷引起的凋亡[13-14]。在本研究中,我們證實槲皮素預處理的確可以明顯減少A/R誘導的心肌細胞凋亡,并且該作用的實現也依賴于PKCε信號路徑,因為εV1-2的加入可明顯減弱槲皮素的抗心肌細胞凋亡作用。
綜上所述,我們認為,槲皮素的抗心肌缺血再灌注損傷保護作用的機制涉及PKCε路徑,并至少部分依賴于其對PKCε蛋白表達水平的上調。這一發現不僅使我們更深入了解槲皮素這一重要的植物化學物維護心血管健康的內在機制,也為我們探索心血管保護藥物提供了新的思路。
[1] Kelly GS. Quercetin. Monograph [J].Altern Med Rev, 2011, 16(2): 172-194.
[2] Kinaci MK, Erkasap N, Kucuk A, et al. Effects of quercetin on apoptosis, NF-κB and NOS gene expression in renal ischemia/reperfusion injury [J]. Exp Ther Med,2012, 3(2): 249-254.
[3] Jin HB, Yang YB, Song YL, et al. Protective roles of quercetin in acute myocardial ischemia and reperfusion injury in rats [J]. Mol Biol Rep,2012, 39(12): 11005-11009.
[4] Miura T, Tanno M, Sato T. Mitochondrial kinase signalling pathways in myocardial protection from ischaemia/reperfusion-induced necrosis [J]. Cardiovasc Res, 2010, 88(1): 7-15.
[5] Watkins SJ, Borthwick GM,Arthur HM. The H9C2 cell line and primary neonatal cardiomyocyte cells show similar hypertrophic responsesinvitro[J].InVitroCell Dev Biol Anim, 2010, 47(2): 125-131.
[6] Xu M, Wang Y, Hirai K, et al. Calcium preconditioning inhibits mitochondrial permeability transition and apoptosis [J]. Am J Physiol Heart Circ Physiol, 2001, 280(2): H899-H908.
[7] Javadov S, Choi A, Rajapurohitam V, et al. NHE-1 inhibition-induced cardioprotection against ischaemia/reperfusion is associated with attenuation of the mitochondrial permeability transition [J]. Cardiovasc Res, 2008, 77(2): 416-424.
[8] Murphy E, Steenbergen C. Mechanisms underlying acute protection from cardiac ischemia-reperfusion injury [J]. Physiol Rev, 2008, 88(2): 581-609.
[9] Kahraman A, Erkasap N, Serteser M, et al. Protective effect of quercetin on renal ischemia/reperfusion injury in rats [J]. J Nephrol, 2003, 16(2): 219-224.
[10] Ikizler M, Erkasap N, Dernek S, et al. Dietary polyphenol quercetin protects rat hearts during reperfusion: enhanced antioxidant capacity with chronic treatment [J]. Anadolu Kardiyol Derg, 2007, 7(4): 404-410.
[11] 鄧曉慧,宋海巖,孫春莉.槲皮素對人卵巢癌SKOV-3細胞增殖的影響[J]. 中國病理生理雜志,2013,29(1):99-102.
[12] Angst E, Park JL, Moro A, et al. The flavonoid quercetin inhibits pancreatic cancer growthinvitroandinvivo[J]. Pancreas, 2013, 42(2): 223-229.
[13] 畢 偉,朱麗紅,王傳明,等.槲皮素抑制魚藤酮誘導的PC12細胞凋亡[J]. 中國病理生理雜志, 2011, 27(1):82-85.
[14] Yao RQ, Qi DS, Yu HL, et al. Quercetin attenuates cell apoptosis in focal cerebral ischemia rat brain via activation of BDNF-TrkB-PI3K/Akt signaling pathway [J]. Neurochem Res,2012, 37(12): 2777-2786.
Protectiveeffectofquercetinonratcardiomyocytesagainstanoxia/reoxygenationinjuryismediatedbyPKCεsignalingpathway
TANG Lei1,2, PENG Yi-an1,2, XU Tian-tian2, YI Xiao-qing2, LIU Ying2, LUO Yu-chao2, YIN Dong3, HE Ming1,2
(1StateKeyLaboratoryofFoodScienceandTechnology,NanchangUniversity,Nanchang330047,China;2DepartmentofPharmacology&MolecularTherapeutics,SchoolofPharmaceuticalScience,NanchangUniversity,Nanchang330006,China;3JiangxiProvincialKeyLaboratoryofMolecularMedicine,theSecondAffiliatedHospitalofNanchangUniversity,Nanchang330006,China.E-mail:jxhm56@hotmail.com)
AIM: To investigate whether quercetin (Que) protects cardiomyocytes from anoxia/reoxygenation (A/R) injury through protein kinase C epsilon (PKCε) pathway.METHODSPrimary cardiomyocytes were isolated from neonatal SD rats and exposed to A/R (3 h of anoxia followed by 2 h of reoxygenation) as well as Que and/or εV1-2 (a selective PKCε inhibitor) preconditioning. The expression of PKCε in the cells was detected by Western blotting. The levels of lactate dehydrogenase (LDH) and creatine kinase (CK) in cell culture supernatants, the reactive oxygen species (ROS) and mitochondrial membrane potential in the cells, the opening of mitochondrial permeability transition pore (mPTP) and the cell viability and apoptosis were also measured.RESULTSThe expression of PKCε protein was significantly increased in the cardiomyocytes pretreated with 40 μmol/L Que 72 h before A/R (P<0.01vsA/R group). Meanwhile, Que preconditioning could increase cell survival rate, decrease ROS production and cell apoptosis, alleviate the loss of mitochondrial membrane potential and inhibit the opening of mPTP induced by A/R injury (P<0.01vsA/R group). However, pretreatment with Que and εV1-2 attenuated these protective effects of Que (P<0.01vsQue+A/R group).CONCLUSIONOne of the mechanisms underlying the cardioprotective effect of Que might be the increase in PKCε protein expression and the activation of its downstream pathway.
Quercetin; Protein kinase C epsilon; Cardioprotection; Anoxia/reoxygenation
R965.1
A
1000- 4718(2013)09- 1567- 06
2013- 05- 03
2013-07 - 09
國家973計劃項目(No.2009CB526405);國家自然科學基金資助項目(No.81260492)
△通訊作者 Tel: 0791-86362231; E-mail: jxhm56@hotmail.com
10.3969/j.issn.1000- 4718.2013.09.005

