惡性胸水中醛縮酶A的水平及其對人肺腺癌細胞增殖、遷移與侵襲能力的影響*
馮小鵬, 孫珍貴, 汪向海, 邢 敏, 陳興無
(皖南醫學院弋磯山醫院呼吸內科,安徽 蕪湖 241001)
惡性胸水中醛縮酶A的水平及其對人肺腺癌細胞增殖、遷移與侵襲能力的影響*
馮小鵬#, 孫珍貴, 汪向海, 邢 敏, 陳興無△
(皖南醫學院弋磯山醫院呼吸內科,安徽 蕪湖 241001)
目的比較肺癌患者伴惡性胸水(MPE)和結核性胸膜炎患者胸水(TBPE)中醛縮酶A(ALDOA)的表達水平及其與癌胚抗原(CEA)和乳酸脫氫酶(LDH)的相關性,探討ALDOA對肺腺癌A549細胞增殖、遷移及侵襲的影響。方法ELISA和化學發光法檢測65例MPE和35例TBPE中ALDOA、CEA和LDH水平;以不同濃度的ALDOA作用于A549細胞,分別采用MTT 法、劃痕及體外侵襲實驗研究ALDOA對A549細胞增殖、遷移和侵襲的影響。結果MPE中ALDOA濃度[(46.8±21.4) μg/L]明顯高于TBPE[(23.9±17.2) μg/L](P<0.01),其中腺癌[(71.7±32.1) μg/L]明顯高于鱗癌[(21.3±14.6) μg/L](P<0.05);MPE中CEA和LDH水平[(82.2±56.6) μg/L和(755.8±382.5) U/L]也明顯高于TBPE[(12.6±9.7)μg/L和(388.4±163.9) U/L](P<0.01)。2組患者胸水中ALDOA與CEA和LDH均呈正相關關系(P<0.01或P<0.05)。不同濃度ALDOA刺激A549細胞后,細胞增殖增強且遷移、侵襲加快,并呈濃度依賴性。結論肺癌患者MPE中ALDOA表達水平明顯高于TBPE中的水平,其中肺腺癌胸水ALDOA水平明顯高于鱗癌;ALDOA與CEA和LDH水平高度正相關;ALDOA濃度依賴性地增強肺腺癌A549細胞增殖、遷移和侵襲。
醛縮酶A; 胸水; 肺腫瘤; 細胞增殖; 細胞遷移; 腫瘤侵襲
肺癌是全球最常見的惡性腫瘤及死亡的首要原因,非小細胞肺癌(non-small-cell lung cancer,NSCLC)是最常見的類型[1],尤其肺腺癌的發病率迅速增加,占全部肺癌的40%左右[2]。盡管診斷、治療取得較大進展,NSCLC長期生存率仍不能令人滿意,5年存活率低于15%[3]。早期蔓延或轉移是其5年生存率低的主要原因[4]。轉移到胸膜形成惡性胸水(malignant pleural effusion,MPE)是一種常見的并發癥[5],部分患者甚至是就診的首發表現。顯微鏡下,可見胸膜表面有眾多的腫瘤浸潤病灶,表明癌細胞具高度侵襲性,但癌細胞進入胸膜腔以及促進胸膜轉移灶蔓延的機制仍有待進一步探討。
癌細胞侵襲和轉移的重要標志是持續性增殖和運動性增強,許多介質發揮了重要作用。細胞周圍微環境營養缺乏、pH變化和氧合不足誘導代謝和增殖狀態的改變,有利于癌細胞在轉移部位的生存。MPE提供癌癥細胞生存的微環境和有關介質,可促進癌細胞在胸膜腔的生長和遷移[6]。
缺氧是實體腫瘤組織內廣泛存在的現象,此時癌細胞氧利用率高,糖酵解增強。醛縮酶A(果糖1,6-二磷酸醛縮酶,fructose 1,6-bisphosphate aldolase A, ALDOA)是糖酵解過程的關鍵酶之一,催化果糖-1,6-二磷酸裂解為3-磷酸甘油醛和磷酸二羥丙酮。已證明該酶在肺癌和肺癌MPE中[7-8]高表達,并且可通過某些生長因子如表皮生長因子結合于細胞骨架,促進細胞遷移、加快損傷修復[9]。
我們推測肺癌患者MPE中ALDOA水平升高,可能增進癌細胞增殖、遷移與侵襲。本研究觀察肺癌(包括腺癌和鱗癌)MPE和結核性胸水(tuberculous pleurisy,TBPE)中ALDOA水平差異,比較ALDOA與診斷MPE有較高特異性的2種腫瘤標志物[癌胚抗原(carcinoembryonic antigen, CEA)和乳酸脫氫酶(lactate dehydrogenase, LDH)]的相關性;通過MTT、劃痕和Transwell小室實驗,觀察ALDOA對人肺腺癌細胞株A549增殖、遷移和侵襲的影響,旨在探討ALDOA在肺腺癌細胞轉移、侵襲及MPE形成中的作用。
材 料 和 方 法
1研究對象
選擇皖南醫學院弋磯山醫院呼吸內科2010年7月~2011年6月間確診為肺癌合并胸水的住院患者(MPE組)65例[男27,女38例,平均年齡(57.8±15.3)歲]和結核性胸水患者(TBPE組)35例[男20、女15例,平均年齡(49.9±13.6)歲]。所有患者簽知情同意書。MPE診斷標準:(1)患者影像學顯示原發性支氣管肺癌合并MPE;(2)胸腔積液中找到肺癌細胞和(或)胸膜活檢標本病理學確診為轉移性肺癌。TBPE診斷標準:胸水為滲出液,腺苷脫氨酶>40 U/L,胸膜活檢示結核性肉芽腫[10]。
2胸水采集和存儲
收集患者入院后首次胸腔穿刺抽取的胸水20 mL,經3 000 r/min離心分離,留取上清等份分裝于離心管、-20 ℃凍存備用。
3胸水上清ALDOA濃度測定
ELISA法測定ALDOA濃度,操作步驟參照試劑盒(上海豪森生物有限公司)說明書進行。檢測靈敏度下限為23.5 ng/L。
4LDH和CEA水平測定
應用全自動生化儀、電化學發光免疫分析技術定量檢測LDH和CEA,操作按照儀器和試劑(拜耳集團診斷部)說明書進行。
5細胞株及主要試劑
人肺腺癌細胞株A549由中國科技大學中心實驗室惠贈,RPMI-1640培養基、胰蛋白酶(Gibco), 胎牛血清(杭州四季清公司),ALDOA(ProSpec),MTT試劑(Sigma),Transwell小室(Corning),Matrigel凝膠(北京威格拉斯生物技術有限公司)。
6A549細胞培養
A549細胞常規培養于含10%胎牛血清、1×105U/L青霉素以及100 mg/L鏈霉素的RPMI-1640培養基中,于37 ℃、5%CO2孵箱中培養。取對數生長期細胞,胰酶消化后進行細胞傳代,分別根據實驗需要種于不同的培養板(皿)中。
7細胞增殖實驗
將A549細胞以1×108/L接種于96孔培養板, 培養24 h后,加入含不同濃度ALDOA(0、5、25、50 μg/L)的無血清培養液作用24 h。然后每孔加入10 μL MTT(5 g/L),繼續培養4 h。終止反應后棄上清液,每孔加入100 μL DMSO, 振蕩10 min, 至藍色結晶完全溶解,于全自動酶標儀570 nm處測定吸光度(A)。每組設3個復孔,實驗重復3次。
8細胞劃痕實驗
l×108/L A549細胞接種于24孔培養板,完全融合后,無血清培養液繼續培養24 h。用10 μL加樣槍槍頭尖端在細胞板上劃痕,PBS漂洗2次,每孔加入400 μL含不同濃度ALDOA(5、25、50 μg/L)的無血清培養液,分別于0 h、24 h在倒置相差顯微鏡下觀察、拍照,每條劃痕隨機取3處用NIH Image圖像分析軟件(ImageJ)測量劃痕寬度,取平均值計算其遷移距離,遷移距離(μm)=0 h的劃痕寬度-24 h的劃痕寬度。
9Transwell小室遷移實驗
采用Transwell小室法,將生長良好的A549細胞重懸于無血清培養液,取l×108/L細胞懸液200 μL接種于Transwell上室,下室加入500 μL含ALDOA(0、5、25、50 μg/L)的無血清培養液,培養24 h。取
出Transwell小室,棄培養液,甲醇固定20 min,將小室適當風干,0.1%結晶紫染色20 min;自來水洗3遍,棉簽擦盡上室面細胞,光學顯微鏡下隨機選取3個視野,計數小室下室面的細胞數,每組設3個復孔,取平均值。
10細胞侵襲實驗
實驗方法與9類似,但侵襲小室上室面濾膜用5 g/L Matrigel 100 μL覆蓋,風干后用于實驗。
11統計學處理
數據以均值±標準差(mean±SD)表示,采用SPSS 13.0進行統計學分析,兩組間均數比較采用獨立樣本t檢驗,雙變量相關分析采用Pearson相關性分析。以P<0.05為差異有統計學意義。
結 果
1兩組患者胸水中ALDOA、CEA和LDH水平
肺癌MPE組和TBPE組胸水中ALDOA濃度分別為(46.8±21.4)μg/L和(23.9±17.2)μg/L,MPE組明顯高于TBPE組(P<0.01)。CEA濃度分別為(82.2±56.6)μg/L和(12.6±9.7)μg/L;LDH濃度分別為(755.8±382.5)U/L和(388.4±163.9)U/L;MPE組均明顯高于TBPE組(P<0.01),見圖1。

Figure 1. Comparison of ALDOA (A),CEA (B) and LDH (C) levels in malignant pleural effusion (MPE) and tuberculous pleural effusion (TBPE).Mean±SD.n=3.**P<0.01vsTBPE.
圖1兩組患者胸水中ALDOA、CEA和LDH水平的比較
2肺腺癌和鱗癌MPE中ALDOA水平
肺腺癌和鱗癌患者MPE中ALDOA濃度分別為:(71.7±32.1)μg/L和(21.3±14.6)μg/L,腺癌組明顯高于鱗癌組(P<0.05),見圖2。

Figure 2. Comparison of ALDOA in MPE from adenocarcinoma and squamous-cell carcinoma patients.Mean±SD.n=3.*P<0.05vssquamous-cell carcinoma.
圖2肺腺癌和鱗癌患者MPE中ALDOA水平的比較
3MPE和TBPE中ALDOA與CEA和LDH的相關性
MPE中ALDOA與CEA和LDH顯著正相關(r=0.8672,P<0.01;r=0.4963,P<0.05),TBPE中ALDOA與CEA和LDH也分別呈現正相關關系(r=0.6783,P<0.01;r=0.4676,P<0.05)。
4ALDOA對A549細胞增殖的影響
MTT 實驗表明,低濃度ALDOA(5 μg/L)對A549細胞增殖無明顯影響(P>0.05),但25和50 μg/L ALDOA明顯促進A549細胞增殖(P<0.05),見圖3。
5ALDOA對A549細胞遷移的影響
細胞劃痕后經不同濃度ALDOA刺激24 h,細胞遷移距離分別為(17.3±5.2)μm、(44.8±12.7)μm和(73.3±14.6)μm;與對照組[(13.00±4.95)μm]比較,低濃度ALDOA(5 μg/L)對A549細胞遷移無明顯影響(P>0.05),但25和50 μg/L ALDOA組細胞遷移距離明顯增加(P<0.05),見圖4。

Figure 3. Effect of ALDOA on A549 cell proliferation.Mean±SD.n=3.*P<0.05vs0 μg/L.
圖3ALDOA對A549細胞增殖的影響
利用Transwell小室遷移實驗,發現ALDOA組穿透的細胞增多,并且濃度越大穿透的細胞越多。鏡下計數顯示,ALDOA組細胞穿過Transwell小室數分別為20.0±4.8、58.0±7.3和107.0±15.6;與對照組(11.0±1.5)相比,低濃度ALDOA(5 μg/L)對A549細胞遷移無明顯影響(P>0.05),另2種濃度ALDOA組細胞穿過Transwell小室的細胞數均明顯增加(P<0.05),而且濃度越高穿過Transwell小室的細胞數越多,見圖5。

Figure 4. Effect of ALDOA on A549 cell migration(×200). A:control;B:ALDOA (5 μg/L);C:ALDOA (25 μg/L); D:ALDOA (50 μg/L).
圖4ALDOA對A549細胞遷移的影響
6ALDOA對A549細胞侵襲的影響
ALDOA作用于A549細胞,24 h后光鏡下計數穿過Transwell聚碳酸酯膜的細胞數分別為76.6±13.9、101.1±11.9和127.4±14.6,對照組為67.3±14.3;與對照組比較,ALDOA組細胞侵襲數增多;而50 μg/L組細胞侵襲數明顯多于5 μg/L和25 μg/L組(P<0.05),見圖6。
討 論
異常生長和轉移被視為癌細胞重要的生物學特性,幾個步驟調節轉移的發生(局部浸潤、進入血管、外滲、啟動、腫瘤微轉移灶形成、血管發生),其中癌細胞浸潤是最重要和特征性步驟,而癌細胞浸潤過程中細胞的遷移和侵襲起著至關重要作用[11]。闡明細胞運動、遷移和侵襲的分子機制對了解肺癌及MPE的發展非常重要。癌細胞直接侵襲胸膜組織蔓延并持續增殖和胸膜通透性增強可能是MPE發生的最主要機制。
越來越多的研究表明腫瘤微環境對腫瘤惡性進展的臨床意義[6]。MPE含有多種源于炎癥、上皮細胞和癌細胞釋放的血漿濾出蛋白,提供癌細胞生長、侵襲和脈管播散的微環境和有關介質。迄今, 一些生物標志物如CEA、LDH等已應用于胸腔積液的病因分析。這些介質也可能特異維持癌細胞在胸膜腔生存和侵襲,用作研究胸水形成機制的工具。
癌細胞增殖和侵襲需有足夠的能量供應,代謝重編程有益于癌細胞生存[12]。癌細胞糖酵解作用增強,醛縮酶在其中起重要作用,通過裂解己糖磷酸果糖1,6-二磷酸C3和C4鍵,催化磷酸果糖1,6-二磷酸轉換為3-磷酸甘油醛和磷酸二羥丙酮,進而影響腫瘤細胞糖代謝和細胞增殖。惡性腫瘤患者血清中醛縮酶升高,尤以同工酶ALDOA最突出。已證明ALDOA與人類許多疾病如腫瘤包括肺癌[7]、肝癌、自身免疫性疾病的發生發展有重要關系。癌組織ALDOA濃度明顯高于癌旁組織,其濃度的高低對患者化療藥物選擇、治療效果及預后均有指導意義。肺癌患者血清ALDOA與其自體抗體蛋白水平升高,其上調的機制尚不清楚。Lin等[8]發現ALDOA等糖代謝酶異常還與MPE形成有關,免疫組化和免疫熒光分析MPE和胸膜轉移病灶發現腫瘤細胞特異性表達ALDOA。

Figure 5. Effect of ALDOA on A549 cell migration detected by Transwell assay(×200). A:control;B:ALDOA (5 μg/L);C:ALDOA (25 μg/L); D:ALDOA (50 μg/L).Mean±SD.n=3.*P<0.05vsA.
圖5Transwell小室檢測ALDOA對細胞遷移的影響
本研究中,我們發現ALDOA在MPE中的濃度明顯高于結核性胸水,而且以肺腺癌胸水升高最明顯;提示MPE特別是肺腺癌相關的MPE存在能量供給和利用異常,而且ALDOA還可能與MPE形成有關。MPE患者胸水中ALDOA水平上調可能與缺氧誘導因子1α[13]和腫瘤壞死因子α誘導表達有關。這種糖代謝異常不僅對腫瘤發生,而且對MPE中癌細胞胸膜侵襲、增殖和血管內皮生長因子分泌均十分重要[8]。
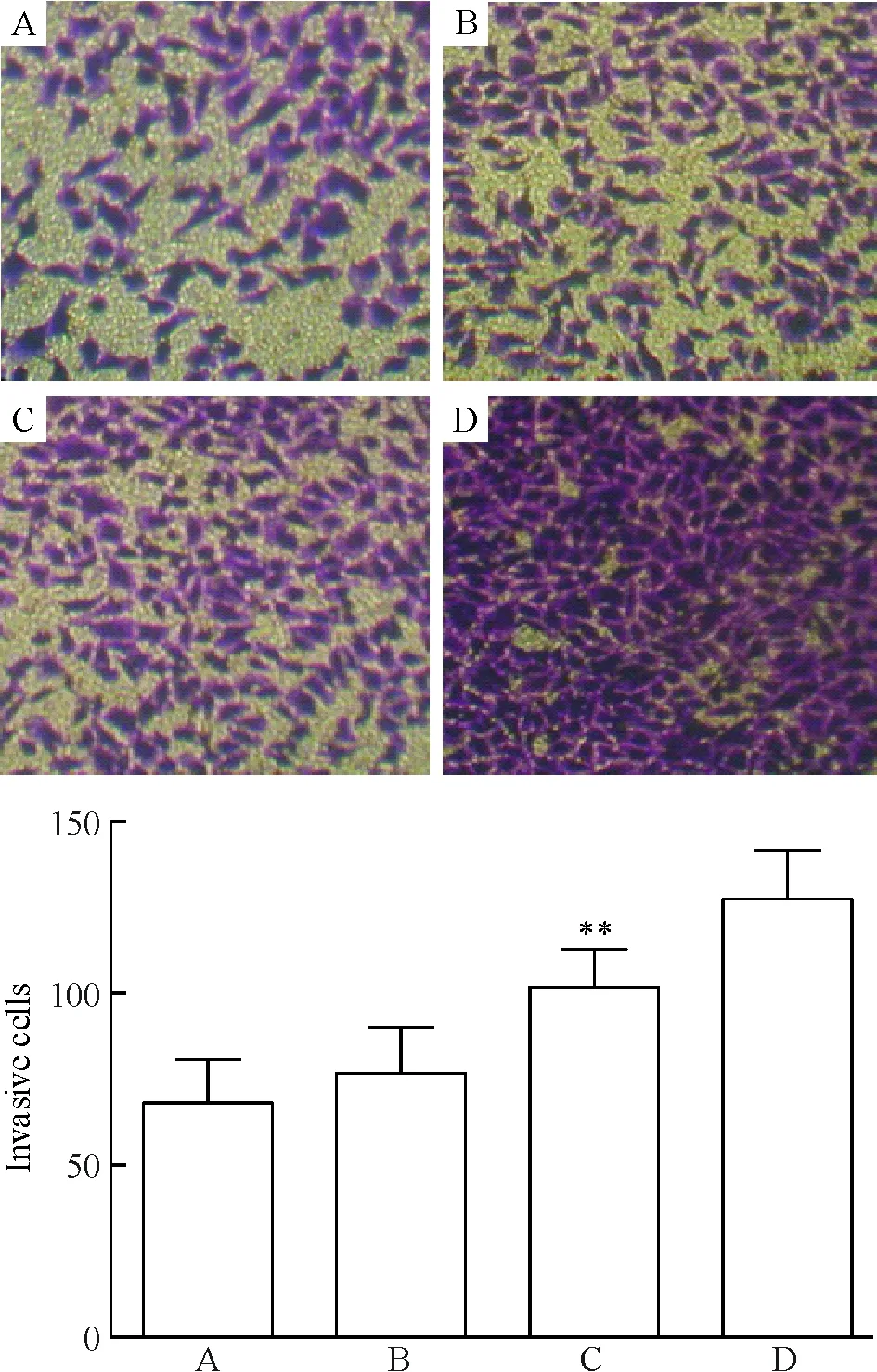
Figure 6. Effect of ALDOA on A549 cell invasion(×200). A:control;B:ALDOA (5 μg/L);C:ALDOA (25 μg/L); D:ALDOA (50 μg/L).Mean±SD.n=3.**P<0.01vsA.
圖6ALDOA對A549細胞侵襲的影響
CEA是最特異性的癌胚蛋白之一,反映腫瘤的存在,其mRNA水平也被用于檢測微播散或微轉移(灶)。胸水CEA是MPE的一個有用診斷工具,也有助于鑒別惡性胸膜間皮瘤和轉移性肺癌[14];而且是不能由細胞檢測的胸膜亞臨床微轉移的一個有用指標[15]。MPE中CEA水平升高可能與癌細胞阻塞淋巴管及胸膜浸潤、CEA產生后不易進入血循環,在胸腔內積聚有關。本實驗觀察到MPE較結核性胸水CEA水平升高,并且以肺腺癌MPE中濃度最高;相關性分析表明胸水CEA與ALDOA高度相關。MPE中癌細胞CEA基因表達激活,可促進細胞黏附、抑制細胞死亡、介導信號轉導及激發腫瘤免疫,因此CEA在MPE癌細胞生長、遷移和侵襲過程中可能有重要作用。MPE中CEA與ALDOA的共同上升趨勢提示兩者在MPE發生過程中可能有協同作用,兩者是否存在共同的生成誘導因子或具有促進關系則不甚清楚。LDH也是一種糖酵解酶,為NAD+的中間產物;人胸膜間皮細胞和巨噬細胞具有強陽性LDH細胞化學反應。癌組織中無氧酵解增強,促使糖酵解關鍵酶LDH升高。本研究中,我們觀察到MPE和中LDH與ALDOA也呈正相關關系,可能與這兩種糖酵解酶有共同的生成誘導因子有關。
糖酵解酶除了影響能量生成,還對細胞某些功能有調控作用:腫瘤組織乏氧環境及糖酵解過程增強均有利于觸發血管內皮生長因子生成;糖酵解的代謝產物乳酸也刺激血管生成,糖酵解率高的癌細胞呈優勢生長。有研究發現ALDOA在增殖的細胞中表達上調[13],提示其與細胞增殖相關。在結腸癌,ALDOA參與細胞生長調節,刺激癌細胞擴散[16]。本研究發現ALDOA濃度依賴性地刺激A549增殖,提示ALDOA可通過調節糖酵解而影響腫瘤細胞生長增殖。
除了參與糖酵解途徑與細胞生存、增殖,ALDOA可通過某些生長因子如EGF結合細胞骨架,促進細胞遷移、加快損傷修復[9]。在人角質形成細胞(HaCaT)中,ALDOA沿皺膜和偽足高表達, 與偽足一起定位于肌動蛋白細胞骨架。通過劃痕實驗,觀察到轉染ALDOA siRNA的HaCaT細胞機械劃傷后傷口修復明顯減慢,偽足形成細胞也減少;EGF刺激后,傷口修復區和ALDOA及其mRNA水平增加[9]。本實驗應用細胞劃痕實驗觀察ALDOA對細胞遷徙的影響,發現在ALDOA作用下A549細胞遷徙加快,且這種促進作用呈明顯劑量依賴性;進一步通過Transwell小室檢測ALDOA對A549細胞穿透的影響,發現ALDOA刺激的A549細胞穿過Transwell小室的細胞數較對照組明顯增多,并且也呈濃度依賴性;提示ALDOA增強肺癌細胞A549遷徙及穿透并呈濃度依賴性。此外,我們發現ALDOA促進A549細胞與Matrigel膠的黏附,ALDOA刺激的A549細胞穿過聚碳酸酯膜的細胞數明顯增多,并且ALDOA濃度越高,穿透的細胞越多;提示ALDOA增強肺癌細胞A549黏附及侵襲并呈濃度依賴性。
總之,受滲透壓、缺氧、酸堿性等多種理化因素的影響,胸水中ALDOA、CEA和LDH表達水平增高,尤其在肺腺癌伴胸膜轉移的患者中ALDOA增高明顯。ALDOA促進A549細胞增殖、遷移、粘附和侵襲,提示ALDOA在肺癌特別是腺癌細胞轉移、MPE形成中起著重要的作用。
[1] Archontogeorgis K, Steiropoulos P, Tzouvelekis A, et al. Lung cancer and interstitial lung diseases:a systematic review[J].Pulm Med,2012,2012:315918.
[2] Hanagiri T, Baba T, So T, et al. Time trends of surgical outcome in patients with non-small cell lung cancer[J].J Thorac Oncol,2010,5(6):825-829.
[3] Kadara H, Kabbout M, Wistuba II.Pulmonary adenocarcinoma: a renewed entity in 2011[J].Respirology,2012,17(1):50-65.
[4] Molina JR, Yang P, Cassivi SD, et al.Non-small cell lung cancer: epidemiology, risk factors, treatment, and survivorship[J].Mayo Clin Proc,2008,83(5):584-594.
[5] Heffner JE, Klein JS. Recent advances in the diagnosis and management of malignant pleural effusions[J]. Mayo Clin Proc,2008,83(2):235-250.
[6] Lorusso G, Rüegg C. The tumor microenvironment and its contribution to tumor evolution toward metastasis[J].Histochem Cell Biol,2008,130(6):1091-1103.
[7] Rho JH, Roehrl MH,Wang JY.Glycoproteomic analysis of human lung adenocarcinomas using glycoarrays and tandem mass spectrometry: differential expression and glycosylation patterns of vimentin and fetuin A isoforms[J].Protein J,2009,28(3-4):148-160.
[8] Lin CC, Chen LC, Tseng VS,et al. Malignant pleural effusion cells show aberrant glucose metabolism gene expression[J].Eur Respir J,2011,37(6):1453-1465.
[9] Tochio T, Tanaka H, Nakata S, et al. Fructose-1,6-bisphosphate aldolase A is involved in HaCaT cell migration by inducing lamellipodia formation[J].J Dermatol Sci,2010,58(2):123-129.
[10] Light RW.Update on tuberculous pleural effusion[J]. Respirology,2010,15(3):451-458.
[11] 張 潔,陳俊杰,陳成水,等.STAT1和ICAM-1在非小細胞肺癌中的表達及其臨床意義[J].中國病理生理雜志,2012,28(8):1378-1382.
[12] Kroemer G, Pouyssegur J.Tumor cell metabolism: cancer’s Achilles’ heel[J]. Cancer Cell,2008,13(6):472-482.
[13] Hamaguchi T,Iizuka N, Tsunedomi R, et al. Glycolysis module activated by hypoxia-inducible factor 1α is related to the aggressive phenotype of hepatocellular carcinoma[J].Int J Oncol,2008,33(4):725-731.
[14] Shi HZ, Liang QL, Jiang J, et al. Diagnostic value of carcinoembryonic antigen in malignant pleural effusion: a meta-analysis[J]. Respirology,2008,13(4):518-527.
[15] Tomita M, Shimizu T, Matsuzaki Y, et al.Prognostic significance of carcinoembryonic antigen level in pleural lavage fluid for patients with lung adenocarcinoma[J].Ann Thorac Surg,2005,80(1):276-281.
[16] Tammali R, Ramana KV, Srivastava SK. Aldose reductase regulates TNF-α-induced PGE2 production in human colon cancer cells[J]. Cancer Lett,2007,252(2):299-306.
AldolaseAlevelinmalignantpleuraleffusionanditseffectsonproliferation,migrationandinvasionofhumanlungadenocarcinomacells
FENG Xiao-peng, SUN Zhen-gui, WANG Xiang-hai, XING Min, CHEN Xing-wu
(DepartmentofRespiratoryDisease,YijishanHospitalofWannanMedicalCollege,Wuhu241001,China.E-mail:cxw0028@126.com)
AIM: To investigate the levels of aldolase A (ALDOA), carcinoembryonic antigen (CEA) and lactate dehydrogenase (LDH) in malignant pleural effusion (MPE) from patients with lung cancer and tuberculous pleural effusion (TBPE) from patients with tuberculous pleurisy, and to explore the effects of ALDOA on the proliferation, migration and invasion of human lung adenocarcinoma A549 cells.METHODSPleural effusion samples including 65 cases of MPE and 35 cases of TBPE were collected, and the levels of ALDOA, CEA and LDH were detected by ELISA and chemiluminescence assay. After A549 cells were treated with different concentrations of ALDOA, the proliferation, migration and invasion of the cells were investigated by MTT assay, scratch test, Matrigel assay and Transwell invasion assay.RESULTSThe levels of ALDOA, CEA and LDH in MPE were (46.8±21.4) μg/L, (82.2±56.6) μg/L and (755.8±382.5) U/L, respectively, which were significantly higher than those in TBPE [(23.9±17.2) μg/L, (12.6±9.7) μg/L and (388.4±163.9) U/L, respectively;P<0.01]. The concentration of ALDOA in MPE from adenocarcinoma patients [(71.7±32.1) μg/L] was significantly higher than that in MPE from squamous-cell carcinoma patients [(21.3±14.6) μg/L,P<0.05]. The concentrations of ALDOA in MPE and TBPE were positively correlated with the concentrations of CEA and LDH (P<0.01 orP<0.05). ALDOA enhanced the proliferation, migration and invasion of A549 cells in a concentration-dependent manner.CONCLUSIONThe expression level of ALDOA in MPE is significantly higher than that in TBPE, especially in MPE from lung adenocarcinoma patients. There are highly positive correlations between ALDOA and CEA, ALDOA and LDH in pleural effusion. ALDOA concentration-dependently promotes the proliferation, migration and invasion of A549 cells.
Aldolase A; Pleural effusion; Lung neoplasms; Cell proliferation; Cell migration; Neoplasm invasiveness
R363
A
1000- 4718(2013)09- 1662- 06
2013- 04- 28
2013- 07- 09
弋磯山醫院引進人才專項科研基金資助項目(No.YR201012)
△通訊作者 Tel: 0553-5739320; E-mail: cxw0028@126.com
# 現工作單位:廣東省惠州市第一人民醫院重癥醫學科
10.3969/j.issn.1000- 4718.2013.09.022

