四乙胺對Aβl-40致傷的神經干細胞的存活及其Caspase-3表達的影響
盛寶英 田嘉瑩 田國忠 齊志國 熊慶華
·論著·
四乙胺對Aβl-40致傷的神經干細胞的存活及其Caspase-3表達的影響
盛寶英 田嘉瑩 田國忠 齊志國 熊慶華
目的探討鉀通道阻滯劑四乙胺(tetraethy-lammonium, TEA)在Aβl-40致傷的神經干細胞增殖及凋亡中的作用。方法Aβl-40與神經干細胞共孵育,誘導神經干細胞損傷,以 TEA作用于Aβl-40致傷的神經干細胞,利用MTT 法和比色法分別檢測神經干細胞在不同的時間點的存活率及Caspase-3活性。結果Aβl-40可使神經干細胞的存活率降低,呈時間依賴性; Aβl-40與神經干細胞在不同的時間點共孵育后,Caspase-3活性逐漸增加,在24 h達到高峰;加入TEA后,Aβl-40致傷的神經干細胞的存活率增加,Caspase-3活性表達下降。結論Aβl-40對神經干細胞的致傷作用可能與鉀通道的激活相關,TEA能夠降低Aβl-40對神經干細胞的致傷作用,減少神經干細胞的凋亡為治療阿爾茨海默病提供了新的方法。
阿爾茨海默病;四乙胺;β-淀粉樣多肽;神經干細胞
阿爾茨海默病(Alzheimer’s disease, AD)是與衰老相關, 以嚴重的高級認知功能障礙為特征的隱襲性、逐漸性進展的退行性腦病[1,2]。AD 發病機制極其復雜, 主要病理學特點是β-淀粉樣多肽(Aβ)聚集形成的老年斑(SP) 和神經原纖維纏結 (NFT) 的形成, 伴腦皮質層神經元減少[3,4]。在研究中發現,AD患者常伴發大腦海馬區的萎縮和神經干細胞的減少。同時也證實Aβ具有神經元毒性作用[5]和誘導神經干細胞的凋亡[6],Aβ誘導的神經元凋亡的同時均伴隨鉀通道激活,尤其是延遲整流鉀電流增強[7]。TEA是鉀通道阻滯劑,研究證實心肌細胞凋亡中鉀通道阻滯劑能起到保護和抑制的作用[8]。本研究以鉀離子通道阻滯劑TEA作用于Aβl-40誘導的神經干細胞,觀察神經干細胞存活和Caspase-3活性的變化,探討Aβ致傷的神經干細胞凋亡時鉀通道阻滯劑TEA在其中的作用。
1 資料與方法
1.1實驗動物、主要試劑及儀器 雄性 Wistar 大鼠(<24 h),由佳木斯大學動物中心提供;DMEM/F12(Gibco); 四乙胺(tetraethylammonium,TEA)、四甲基偶氮唑藍(MTT)、多聚賴氨酸 (Sigma公司);胎牛血清(北京中杉金橋公司);酶標計數儀ELX800(Bio-TEK公司);Aβ1-40(Biosouxee公司);Caspase分析試劑盒(美國Promega公司)。Nestin(北京博奧森生物技術有限公司);IBE2003倒置熒光顯微鏡(重慶光學儀器廠)。
1.2大鼠海馬區神經干細胞的分離與傳代培養及鑒定 新生的Wistar 大鼠(<24 h),無菌操作打開顱腔并取海馬組織,用Hank’s液進行漂洗,將組織剪成1 mm3左右的小塊加入培養液(DMEM/F12 1 ∶ 1,2%B27,bFGF 20 μg/L,表皮生長因子20 μg/L)5 ml,細滴管輕輕吹打后,制成單細胞懸液,調整一定濃度后接種于培養瓶中,將其放入5%CO2培養箱中,每3 d換半量培養液一次,每7 d傳代一次,方法同上。取傳代培養的神經球涂布在0.01%多聚賴氨酸的無菌蓋玻片上,37℃,5%CO2培養箱培養2 h后,用0.01 mPBS漂洗,吹干后行Nestin細胞免疫化學檢測。
1.3實驗分組 實驗共分四組:Aβ1-40組:在傳三代后的神經干細胞加入Aβ1-405 μM;Aβ1-40+TEA組:在Aβ1-405 μM孵育前30 min加入TEA 5 mM;空白對照組:加入等量的培養液的神經干細胞培養組;TEA對照組:神經干細胞加入TEA 5 mM。上述各組分別在0 h,12 h,24 h和48 h個時間點行細胞活性及凋亡檢測。
1.4MTT法檢測神經干細胞的存活率 四組傳代后的神經干細胞經不同處理后,停止培養前4 h將每孔加入MTT溶液(5 mg/ml)20 μl使終濃度為 1 mg/ml,放置37℃培養箱繼續培養4 h,用翻板法將96孔板內的培養基棄去,在每孔中加入溶解液 DMSO 150 μl,振蕩 10 min使其充分溶解結晶產物。在酶標儀上以波長570nm檢測每孔的OD值。所檢測OD值的大小可反映細胞代謝活性的強弱。每組設3個孔,實驗重復3次,細胞存活率的計算:細胞存活率=試驗組光吸收值/對照組光吸收值×100%。
1.5比色法檢測神經干細胞Caspase-3的表達 將不同處理組的神經干細胞,用PBS在細胞表面漂洗兩次,然后收集到EPPendoff管內,450×g,4℃離心10 min收集細胞。放于冰上,用冰冷的PBS漂洗一次,然后懸浮在100 μl細胞裂解緩沖液中。以液氮-常溫的方式裂解細胞,然后在冰上孵育 15 min。15,000×,4℃離心 20 min后收集上清液。用Bradford方法測蛋白的濃度。按試劑盒依次在96孔板內依次加樣。加2 μl DEVD-pNA底物(10 mM)到96孔板內。用parafilm封口膜將板子封嚴,37℃孵育4 h。在405nm測量吸光度。計算Caspase-3特異性活性。
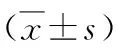
2 結果
2.1神經干細胞培養及Nestin抗原表達 新生大鼠海馬區新鮮分離的單個神經干細胞呈透亮的圓形(見圖1),傳代培養至第三代可見培養液中形成較大的神經球(見圖2),神經干細胞標記性蛋白Nestin傳代培養神經球的表達(見圖3)。
2.2TEA對Aβ1-40誘導的神經干細胞存活率的影響 加入Aβ1-40后,神經干細胞在不同的時間點,細胞存活明顯減少(P<0.05),且隨時間延長,細胞存活減少的愈加明顯。Aβ1-40+TEA組較Aβ1-40組細胞存活明顯增加(P<0.05),而空白對照組和TEA對照組神經干細胞存活無明顯改變(P>0.05),且細胞數明顯增加。鏡下可見細胞形態無明顯示變化。(見表1)
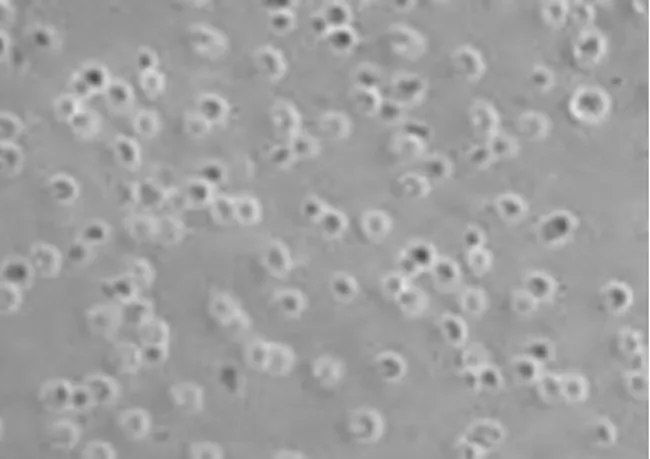
圖1 新鮮分離的NSCs(×100)
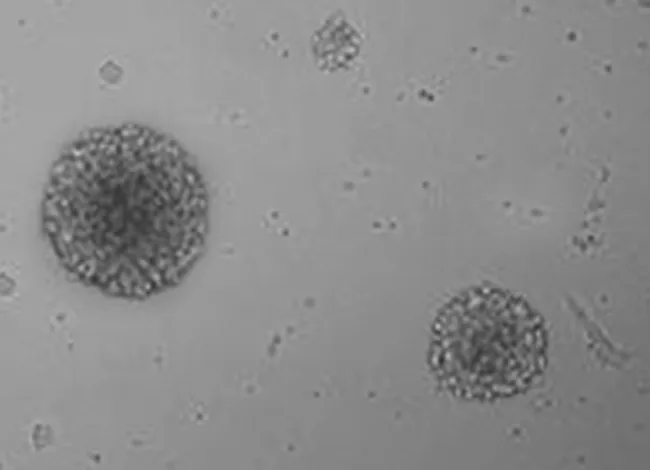
圖2 傳至第三代的NSCs(×200)
圖3 NSCs呈Nestin陽性
2.3TEA對Aβ1-40誘導神經干細胞caspase-3活性的變化 Aβ1-40分別孵育后上述各時間點, Caspase-3活性逐漸增加(P<0.05),在24 h達到高峰(P<0.01)。與Aβ1-40+TEA組在各時間點均可降低Caspase-3的表達(P<0.05),特別在24 h這種趨勢更為明顯(P<0.01),而空白對照組和TEA對照組在0 h,12 h,24 h和48 hCaspase-3特異性活性未發生明顯改變(見表2)
表1 不同培養時間各組神經干細胞存活率的變化
注:1.Aβ1-40組與空白對照組相比,aP<0.05;2.Aβ1-40+TEA組與Aβ1-40處理組相比,bP<0.05;

表2 不同時間點各組神經干細胞Caspase-3活性的變化
注:Aβ1-40組與空白對照相比,aP<0.05;12 h Aβ1-40組與24 hAβ1-40組相比,bP<0.01;48 h Aβ1-40組與24 h Aβ1-40組相比,cP<0.01;Aβ1-40+TEA組與Aβ1-40組相比,dP<0.05;24 hAβ1-40組與24 hAβ1-40+TEA組相比,eP<0.01
3 討論
正常腦組織中在室管膜下區、海馬和脈絡膜叢存在大量的神經干細胞,這些細胞增生活躍,特別在缺血缺氧情況下,可刺激這些區域神經干細胞的增殖、遷移并分化。研究表明,AD患者的上述各區神經干細胞數目明顯減少,且分化不良。其具體的致病原因還不十分清楚。本實驗研究發現,Aβ1-40致傷后神經干細胞增殖減速,且凋亡增加,可能是導致其中的致病機體發病原因之一。以往研究表明AD患者神經元減少,凋亡明顯[9]。在本實驗中可見與Aβ1-40共同培養后,神經干細胞的存活減少,凋亡增加,這也可能是AD患者神經干細胞無法分化成為神經元,而導致神經元缺失增多的原因。
凋亡,是能量依賴細胞內程序性死亡。在通常情況下,組織細胞發育和細胞更新,進而保持組織細胞的動態平衡中,凋亡起到相當重要的作用。但是在一些化學、物理、環境或遺傳學等方面的損傷因素作用下可介導病理性自主性有序性的細胞死亡[10]。
凋亡不僅由基因調控,凋亡的啟動有多種機制,特別是細胞內的離子穩態尤其是K+的穩態調控在凋亡中起重要作用。有研究發現,將神經元培養液中加入一定濃度的Aβ1-40后,神經元細胞膜鉀通道被異常激活,同樣膽堿能干細胞株SN56神經元與Aβ共培養也得到相同的結果,TEA抑制Aβ1-40毒性68%以上[11]。本研究發現將鉀通道阻滯劑TEA加入Aβ1-40致傷的神經干細胞后,可將神經干細胞的存活率增加,而凋亡率下降。這說明鉀通道在Aβ1-40致傷神經干細胞,調控凋亡中起到一定的作用。在對AD患者中的研究也同樣發現,延遲整流鉀通道異常激活,電流密度增加,神經元存活減少,鉀通道阻滯劑TEA阻斷此通道或者高K+均可抑制外向電流,延長動作電位時程,升高細胞內[Ca2+]濃度,從而抑制神經元的Aβ1-40毒性[12]。該結果與本實驗的神經干細胞被Aβ1-40致傷后TEA發揮的作用基本相似。
凋亡信號起動Caspase-3活化[13],活化的Caspase-3作用于底物蛋白,促進底物分解,引起凋亡[14]。因此,通過 檢測Caspase-3 的活性大小即可了解細胞凋亡的變化。本實驗中,Aβ1-40致傷神經干細胞后,Caspase-3活性增加,且其活性與時間呈正比,當達到一定時間后這種比例關系破壞,即Caspase-3活性不會因時間延長而增加,而是保持相當的活性水平。這種作用在被TEA所阻斷,外源性鉀離子通道阻滯劑TEA能夠降低Aβl-40對神經干細胞的致傷作用,減少神經干細胞的凋亡。雖然神經干細胞Aβ1-40致傷后鉀通道通過什么途徑激活神經干細胞凋亡,其機制還不是十分清楚,但神經干細胞鉀通道阻滯劑TEA在AD患者中的變化對研究AD的發病機制和藥物干預提供新的思路。
[1] Villaflores OB, Chen YJ, Chen CP, et al.Curcuminoids and resveratrol as anti-Alzheimer agents. Taiwanese journal of obstetrics & gynecology,2012 Dec;51(4):515-525.
[2] Baenekow A, Jahn R, Seheller M. Synaptophysin: A substrate for the Protein tyrosine kinase PP60 csrc in intact synaptic vesicles. oneogene,1990,5(6):1019-1024.
[3] Bailey JA, Lahiri DK, et al. Neuronal differentiation is accompanied by increased levels of SNAP-25 protein in fet al rat primary cortical neurons:implications in neuronal plasticity and Alzheimer’s disease.Annals of the New York Academy of Sciences,2006,Nov,1086:54-65.
[4] Vescovi AL, Parati EA. Gritti A, et al.Isolation and cloning of multi-potential stem cells from the embryonic human CNS an establishment of transplantable human neural stem cell lines byepigenetic stimulation. Exp Neurol,1999,156(1):71-83.
[5] Liu YH, Giunta B, Zhou HD, Tan J, et al. Immunotherapy for Alzheimer disease-the challenge of adverse effects. Nature reviews. Neurology,2012,8(8):465-469.
[6] He P, Shen Y, et al. Interruption of beta-catenin signaling reduces neurogenesis in Alzheimer’s disease. the official journal of the Society for Neuroscience, 2009, 20; 29 (20):6545-6557.
[7] Yu HB, Li ZB, Zhang HX, et al. Role of potassium channels in Abeta(1-40)-activated apoptotic pathway in cultured cortical neurons. neuroscience research,2006,84 (7):1475-1484.
[8] Nishikawa S, Tatsumi T, Shiraishi J, et al.Nicorandil regulates Bcl-2 family proteins and protects cardiac myocytes against hypoxia-induced apoptosis.Mol Cell Cardiol,2006,Apr;40(4):510-519.
[9] Yagi T, Ito D, Okada Y, et al. Modeling familial Alzheimer’s disease with induced pluripotent stem cells. Clinical neurology,2012; 52 (11):1134-6.
[10] Verweij FJ, Middeldorp JM, Pegtel DM, et al. Intracellular signaling controlled by the endosomal-exosomal pathway. Communicative & integrative biology,2012, 5(1):88-93.
[11] Yu SP, Farhangrazi ZS, Ying HS, et al. Enhancement of outward potassium current may participate in β-amyloid peptide-induced cortical neuronal death. Neurobiol Dis, 2007, 5:81-88.
[12] Yu SP, Yeh CH, Gottron F, et al. Role of the outward delayed rectifier K+current in ceramide-induced caspase activation and apoptosis in cultured cortical neurons.J Neurochem, 2008, 73:933-941.
[13] Hughes Jr FM, Bortner CD, Purdy GD, et al. Intracellular K+suppresses the activation of apoptosis in lymphoeytes.J Biol Chem, 2001, 272:30567-30576.
[14] Ho TC, Chen SL, Yang YC, et al. Cytosolic phospholipase A2-{alpha} is an early apoptotic activator in PEDF-induced endothelial cell apoptosis. American journal of physiology. Cell physiology, 2009, 296 (2):273-284.
Theeffectsoftetraethyl-lammoniumtothesurvivalandCaspase-3expressionofAβl-40-inducedneuralstemcells
SHENGBao-ying,TIANJia-ying,TIANGuo-zhong,etal.
ObjectiveUsing tetraethyl-lammonium (TEA), this acts as a potassium channel blocker, to interfere the Aβl-40-injured neural stem cells (Aβl-40-NSCS),and observing the survival and Caspase-3 expression of Aβl-40-NSCS, we wants to know the effects of potassium channels blocker TEA in the proliferation and apoptosis of Aβl-40-NSCS.MethodsWe incubated neural stem cells with Aβl-40(TEA), which were known as the Aβl-40-injured neural stem cells (Aβl-40-NSCS). Then the Aβl-40-NSCS were dealt with TEA. We measured the survival and Caspase-3 activity of Aβl-40-NSCS at different time points by MTT and colorimetric methods.ResultsA certain concentration of Aβl-40can reduce the survival of NSCS, which was time dependent. The Caspase-3 activity of the Aβl-40-NSCS gradually increased and reached the peak at 24 h Caspase-3 activity. Treated with TEA, the survival rates of the Aβl-40-NSCS increased and the expression of Caspase-3 activity decreased.ConclusionAβl-40 can induce the injury of NSCS, resulting in decreased proliferation, survival and increased apoptosis of NSCS. The TEA, which acts as a potassium channel blocker, can reduce the injury effects of Aβl-40to NSCS and apoptosis of NSCS. Therefore, the injury effects of Aβl-40to NSCS may be related with the activation of pstassium ion channels, and the TEA may be a new molecule target of Alzheimer’s disease.
Alzheimer’s disease; Tetraethy-lammonium; Aβ; Neural Stem Cells(NSCs)
黑龍江省佳木斯大學研究生創新科研項目資金(項目編號:YJSCX2011-021JD);黑龍江省科學技術研究項目(項目編號:2012772)
154000 佳木斯大學

