自體熒光技術在早期腸癌診斷中的應用*
劉麗娜,李步洪,謝樹森
(醫學與光電科學與技術教育部重點實驗室,福建省光子技術重點實驗室,福建師范大學,福建福州 350007)
腸癌的發病率和死亡率居世界第三,在我國其發病率僅次于胃癌和食道癌,并且呈逐年上升趨勢,威脅著人們的生命健康[1]。早期發現和切除癌變組織是有效預防腸癌發展,降低死亡率的關鍵。白光內鏡(WLE)檢查是當前臨床診斷腸癌的主要方法,醫生根據反射白光圖像對形態或顏色發生變化的可疑病灶進行活檢取樣和病理分析,但往往難以發現粘膜下的病變組織和早期原位癌微小病灶,容易誤診或漏診,從而導致錯過最佳的治療時間[2]。為了提高早期腸癌的診斷率,人們一直致力于尋找一種能有效地正確指導或替代手術活檢的診斷方法。經過多年的研究與發展,出現了如色素內鏡(CE)[3]、放大內鏡(ME)[4]、窄帶成像內鏡(NBI)[5]、熒光內鏡(AF)[6-8]、共聚焦激光內鏡(CLE)[9]等新型消化內鏡,這些內鏡可以觀察WLE尚無法判斷的特殊微小結構變化,甚至觀察到細胞水平的變化,使早期診斷內鏡向微觀化方向發展。目前,熒光內鏡以無損、實時和靈敏度高等優點已成為早期腸癌診斷的研究熱點[10-12]。
人體組織自體熒光主要來源于基質或細胞中的氨基酸、結構蛋白、酶和輔酶、脂肪、維生素和卟啉等五大類物質。如圖1所示,在特定波長光的激發下,人體組織自體熒光光譜是多種不同物質成分同時誘發產生的光譜疊加,其強度和形狀不僅取決于組織的生化特性和形態結構,還受到組織吸收和散射的影響。組織在癌變過程中,細胞新陳代謝的變化將引起熒光物質的濃度、血液濃度、細胞核大小和上皮層厚度等發生變化,因此可根據組織自體熒光特性的差異區分正常和癌變組織[13-17]。
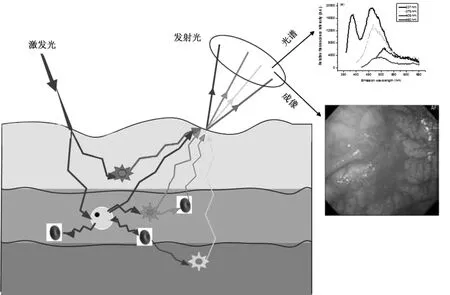
圖1 自體熒光光譜與成像診斷癌變組織的示意圖Fig.1 Autofluorescence spectroscopy and imaging for cancer diagnosis
為了揭示腸道組織癌變過程中自體熒光特性改變的機制,相關的主要研究工作包括:(1)分別開發自體熒光光譜和成像系統,測量腸道離體或活體正常與病變組織的自體熒光光譜和圖像,并利用組織形態學、病理學以及生化學等研究腸道正常與癌變組織的自體熒光差異機制;(2)采用熒光顯微技術監測腸道組織病變過程中各層組織結構和自體熒光強度分布的變化,從微觀層次分析比較正常與癌變組織的差異;(3)應用逐步回歸、判決分析、強度比值等算法對自體熒光光譜或圖像數據進行處理與分析,進一步提高診斷的靈敏度和特異性,更加有效地鑒別不同類型的癌變組織;(4)采用Monte Carlo模擬方法,深入研究組織的厚度、樣品的大小、激發光的入射角度和熒光收集角度等參數對自體熒光光譜測量結果的影響。本文總結了自體熒光光譜技術在早期腸癌診斷應用中的研究進展,重點闡述了熒光激發波長的選擇,熒光光譜數據處理方法,以及正常和癌變腸道組織光譜差異的來源。在分析腸道組織中內源性熒光物質及其分布的基礎上,回顧了自體熒光成像系統的臨床應用進展。最后指出自體熒光光譜與成像技術在早期腸癌診斷中的應用和發展趨勢。
1 自體熒光光譜技術
1.1 激發波長的選擇
激發波長的選擇是開發自體熒光光譜診斷系統的關鍵參數之一。優化選取激發波長應綜合考慮熒光物質激發效率、穿透深度等因素,使之能夠有效地激發組織的熒光物質,最大限度地反映不同類型組織熒光光譜之間的差異。如表1所示,各研究小組選擇的激發波長主要在紫外光到藍綠光范圍,這些激發波長都采用了現有商業化激光器的激光輸出波長。與藍綠光相比,紫外光波長在組織中穿透深度較小,如337 nm的穿透深度約200μm,而442 nm的穿透深度約為600μm[18],但紫外光可激發的物質成分較多,當激發波長在325 nm-370 nm波段時,主要的熒光峰出現在390 nm和460 nm附近,同時還可能出現630 nm 和690 nm 的卟啉發射峰[17,19-23]。Chwirot等指出激發波長(325 nm-337 nm)的微小變化對內源性熒光物質的激發沒有顯著的影響,但各激發波長的有效穿透深度不同[24]。Cothren等則認為與短波長相比,370 nm能夠更加有效地激發熒光信息,特別是 680 nm 的熒光[21,25]。Eker等指出應用337nm激發自體熒光光譜可較好地區別腸道正常和癌變組織,而采用405 nm和436 nm激發的正常和癌變組織自體熒光光譜均沒有顯著差異,區分組織的效果不理想[17]。采用近紅外光也可以激發腸道腺瘤性息肉和增生組織的熒光,與紫外和可見光相比,近紅外光更安全且在組織中的穿透深度更深[11,26]。特別需要指出的是,最佳的激發波長的選擇可以通過測量腸道組織的自體熒光激發-發射矩陣(EEM)來實現。Richards-Kortum等利用250 nm-500 nm的光激發腸道組織的自體熒光,分析15個樣品(4個正常組織,11個腺瘤組織)的EEM的比值圖和差值圖獲得最佳激發波長為330±10 nm、370±10 nm和430±10 nm,并采用370 nm作為激發光,利用480 nm的熒光強度區分正常與腺瘤組織的靈敏度和特異性分別為100%和93%,但研究病例數較少[15]。Wang等認為300 nm,320 nm,330 nm和340 nm是腸道組織的最佳激發波長,以330 nm為激發波長,區分正常和癌變組織的靈敏度和特異性分別為85%和90%[27]。李步洪等采用260 nm-540 nm,步長20 nm的激發光對腸道組織的自體熒光光譜進行檢測,并將所獲得的系列熒光光譜轉換為EEM,比較正常和腺癌組織在某些特定波長激發下的熒光光譜確定結腸癌診斷的最佳激發波長為340 nm,380 nm,460 nm和 540 nm[12]。
1.2 光譜數據的處理方法
如何正確提取光譜的有效信息是提高早期腸癌自體熒光光譜診斷準確率的關鍵。目前,應用于組織自體熒光光譜處理的方法主要有:逐步回歸分析、主成分分析法、雙峰比值法、人工神經網絡判別法和模式識別法等。
1.2.1 逐步回歸分析 逐步回歸是一種從眾多變量篩選重要變量的多元線性回歸,它按照變量對因變量影響的顯著程度從大到小地將變量逐個引入回歸方程并剔除影響不顯著的變量,因此該方法的計算量比較大。Schomacker等采用選取12個熒光發射波長的熒光強度值作為參量,采用逐步回歸分析,對91個腸道瘤性和非瘤性組織樣品進行區分的靈敏度和特異性分別為80%和92%。Kapadia等對325 nm激發的腸道組織自體熒光光譜選取6個熒光發射波長的熒光強度值進行逐步回歸分析,區分正常粘膜、增生性組織和腺瘤性組織的準確率分別為100%、94%和100%[16]。Marchesini等采用410 nm激光激發83例離體樣品,對450 nm-800 nm范圍的自體熒光光譜提取9個熒光發射波長處的光強或光強比值作為參數進行逐步回歸分析,區分癌變與正常組織的靈敏度和特異性分別為80.6%和90.5%,而區分腺瘤與正常組織的靈敏度和特異性分別為88.2%和95.2%[28]。
1.2.2 主成分分析法(PCA)PCA是一種降低維數的多元統計分析方法,可從全譜數據中提取少數幾個波長或波段作為綜合指標,實現對組織類型的區分。PCA的不足在于:選取主成分時容易漏掉一些相關性很小的有用變量,使得預測模型可靠性下降。此外,承載有效信息的主成分往往多于3個,不易于直接計算靈敏度和特異性,因此主成分分析法常被作為數據壓縮的手段,與其它分類算法相結合進行組織類型的區分[22]。
1.2.3 雙峰比值法 雙峰比值法則根據光譜的形狀選取某兩個特定波段,通過計算比值獲得鑒別不同組織的閾值,是一種簡單的分析方法。與比值法相比,基于全譜的數據處理方法如多元回歸分析等對光譜局部的變化比較敏感,可移植性不如比值法[24]。Mayinger等采用雙峰比值法I(500-549)/I(657-700)診斷腺癌的靈敏度和特異性分別為96%和93%,診斷腺瘤伴異常增生的靈敏度和特異性分別為98%和 89%[10]。
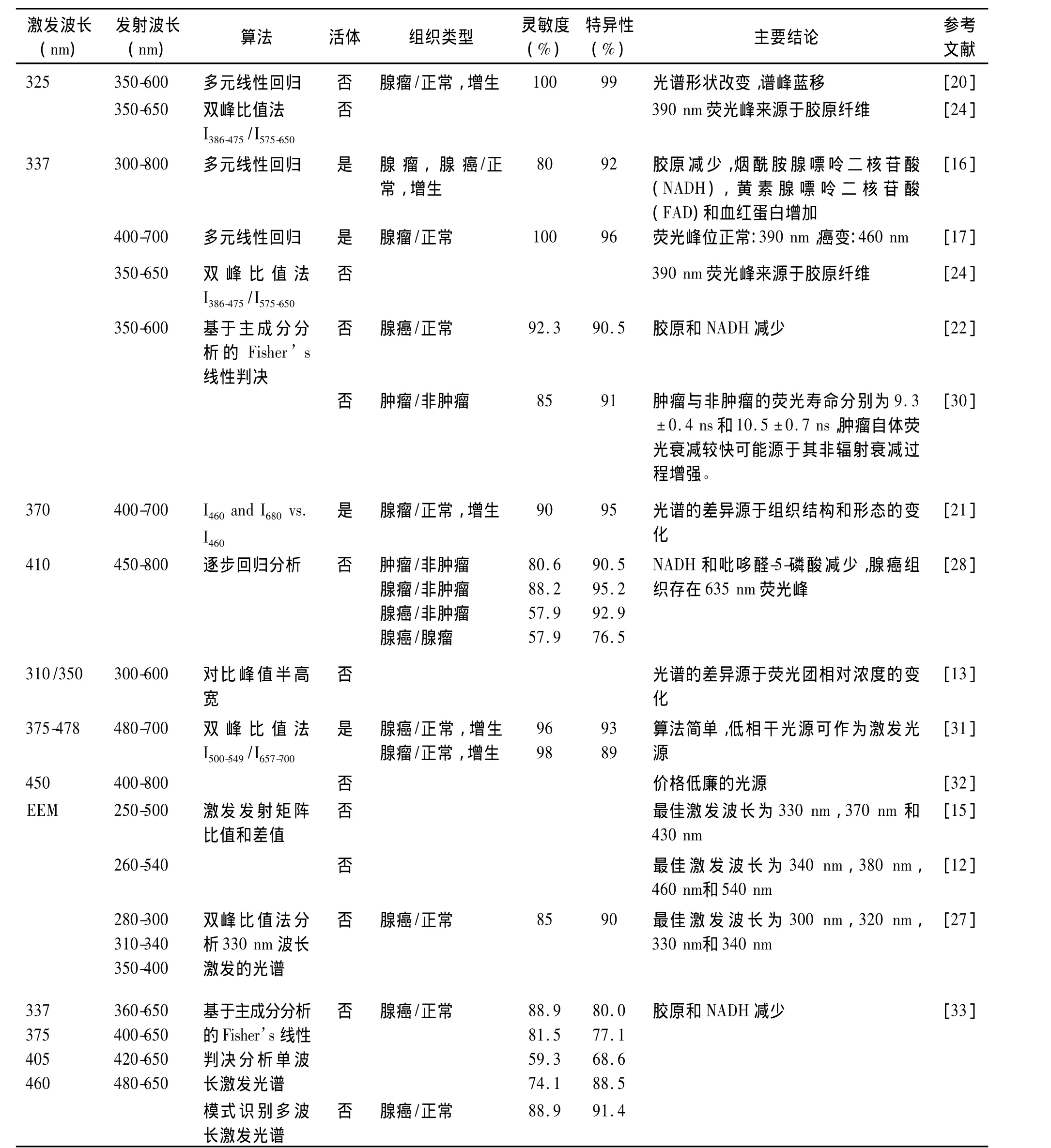
表1 不同激發波長的腸癌自體熒光光譜診斷結果Tab.1 Autofluorescence spectroscopy for the diagnosis of colorectal cancer using different excitation wavelengths
1.2.4 人工神經網絡法(ANN) ANN是一種用來模擬人腦思維過程的計算模型。神經網絡是由大量的、功能比較簡單的神經元互相連接而成的復雜網絡系統,每個神經元從其鄰近神經元接受和發送信息。整個網絡的信息處理通過這些神經元的相互作用完成。神經網絡識別法具有解決模糊問題的優勢,容錯性比較好,但這種算法要求通過大量樣本的訓練以完成鑒別任務。羅湘健等應用PCA結合ANN法對結直腸的自體熒光光譜進行分析,區分結直腸腺癌和正常組織的靈敏度和特異性分別為100%和90%[29]。
1.2.5 模式識別多波長激發光譜 截止目前,各種光譜處理算法主要針對單波長激發的熒光光譜進行分析,盡管有研究指出EEM比單波長激發的光譜具有更豐富的診斷信息[34],但是并未見其在腸道組織診斷中應用的報道,主要是因為EEM檢測與數據處理比較耗時,難以完成實時檢測。為了充分利用多波長激發熒光光譜的豐富信息,又盡可能縮短檢測的時間,我們優化選取337 nm、375 nm、405 nm和460 nm作為激發波長,并對所獲得的熒光光譜應用基于特征提取的模式識別法進行綜合處理。如圖2所示,結腸正常和腺癌組織的自體熒光光譜存在顯著差異。如圖3所示,采用模式識別法分析多波長激發的光譜區分腸道正常和腺癌的靈敏度、特異性和準確率分別為 88.9%、91.4%和 90.3%,與單一采用337 nm激發波長獲得的靈敏度相同,但特異性和準確率均有所提高。
1.3 腸道正常和癌變組織自體熒光差異的來源
1.3.1 組織結構的改變 Schomacker等采用337 nm作為激發波長發現正常和腺癌組織均有390 nm和460 nm兩個熒光峰以及425 nm的血液吸收,但390 nm處正常組織的熒光強度比較高,而630 nm和690 nm是腺瘤組織特有的熒光峰。他們認為390 nm和460 nm熒光峰分別來自腸壁的膠原和NADH,僅有不到5%的熒光來自FAD。組織癌變后粘膜層厚度增加使粘膜下層的膠原熒光產出減少,因此組織形態結構改變是自體熒光光譜改變的主要原因[16]。
1.3.2 內源性熒光物質含量的改變 Banerjee等測量了腸道正常、異型增生和腫瘤組織的自體熒光光譜以及熒光物質純品的光譜,發現不同癌變階段的腸道組織自體熒光光譜形狀沒有差異,但熒光物質的相對濃度不同導致熒光峰值強度不同,同時指出新陳代謝較快的組織細胞較密集,細胞核質較多,而結締組織的密度較低(如膠原變少)。將腸道組織光譜的四個熒光峰(331 nm、365 nm、385 nm、453 nm)與各熒光物質純品熒光峰的峰值強度和半高寬進行比較分析,認為331 nm熒光峰來自色氨酸,365 nm熒光峰主要來自膠原蛋白,同時有彈性蛋白、酪氨酸的貢獻,385 nm熒光峰主要來自IV型膠原,同時有苯丙氨酸、彈性蛋白的貢獻,453 nm熒光峰最有可能來自NADH,苯丙氨酸、維生素B6和IV型膠原[13]。
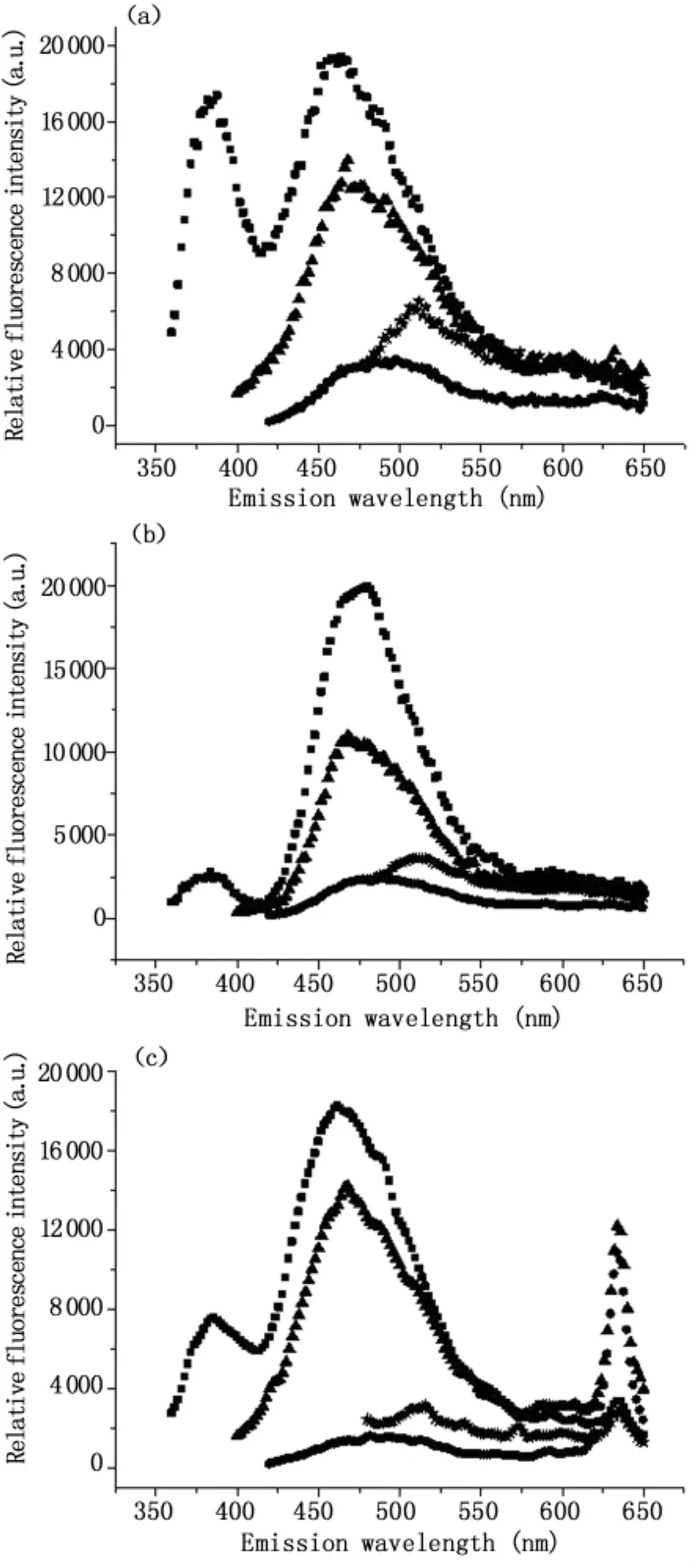
圖2 多波長激發的人體結腸自體熒光光譜(a)正常組織(b)腺癌組織(c)含630 nm熒光峰的腺癌組織。激發波長分別為:337 nm(■),375 nm(▲),405 nm(★),460 nm(●)Fig.2 Autofluorescence spectra of human colonic tissues(a)normal(b)adenocarcinoma(c)adenocarcinoma with 630 nm fluorescence peak.Excitation wavelengths:337 nm(■),375 nm(▲),405 nm(★),460 nm(●)
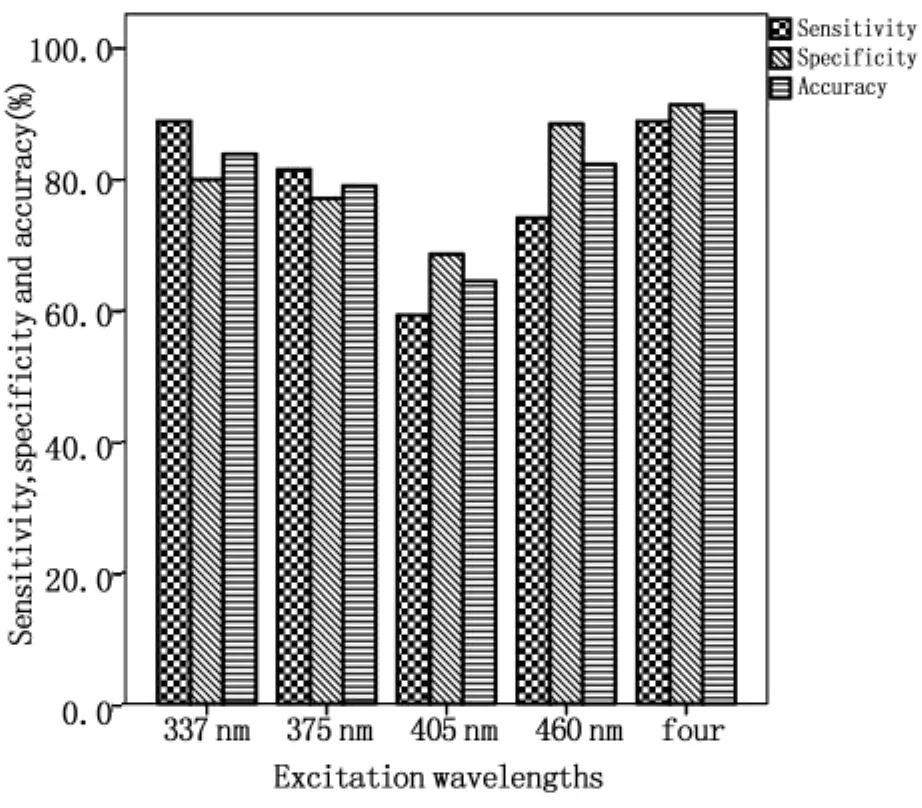
圖3 多波長激發區分結腸正常和腺癌組織的靈敏度、特異性和準確率Fig.3 Sensitivity,specificity and accuracy achieved by monoexcitation and multiple-wavelength excitation for the classification of colonic normal and adenocarcinoma tissues,respectively
我們的前期研究表明部分腸癌患者的腸道組織特異地積聚有PpIX。如圖2(c)所示。李步洪等采用時間分辨光譜技術研究發現正常和癌變組織635 nm熒光發射峰的平均壽命分別為4.32±0.12 ns和 18.45 ±0.05 ns,具有顯著差異,表明腸癌組織中PpIX含量比正常組織高[35]。腫瘤組織中亞鐵螯合酶(FECH)不足或活性降低[36,37]、膽色素原脫氫酶和FECH的失衡[38]、血紅素合成過程中二價鐵離子的不足或者PepT1表達高于正常組織[39]均有可能導致PpIX選擇性積聚,但確切的分子機制尚有待于未來的進一步研究。
1.3.3 組織結構和內源性熒光物質含量改變Richards-Kortum等認為正常和癌變組織的光譜差異不僅取決于組織結構的差異,還可能源于癌變過程中組織的NADH和維生素B6的含量減少[15]。Mayinger等發現正常與癌組織自體熒光光譜均有綠色(480 nm-570 nm)和紅色(600 nm-700 nm)兩個特征峰,正常組織綠色熒光峰的強度明顯高于癌組織,紅色熒光峰的強度則低于腺瘤與結直腸癌。Brigitte認為綠色熒光可能來自膠原,而紅色熒光則可能來自內源性卟啉。癌變組織粘膜厚度增加、粘膜下層被癌細胞取代使粘膜下層膠原的熒光發射減少以及正常和癌細胞中色氨酸和NADH的熒光強度比值不同,從而導致正常與癌變組織的熒光光譜存在差異,此外新陳代謝、炎癥和血紅素的含量及血液的吸收都會對熒光強度產生影響[31]。
2 自體熒光成像技術
2.1 內源性熒光物質在組織中的分布
如圖4所示,不同病變階段腸道組織的結構和病理特征存在顯著差異。采用熒光顯微系統可以觀察到病變過程中各層組織結構和自體熒光強度分布情況,從分子水平上揭示腸癌與正常組織的差異。表2總結了離體腸道正常和病變組織的內源性熒光物質來源,以及正常組織與病變組織熒光差異及潛在原因。一般而言,正常與癌變組織熒光特性差異的主要因素包括:正常組織結構完整,而癌變組織或者結構不完整,粘膜厚度增加或者層結構被破壞。與正常組織相比,癌變組織的上皮層腺窩形狀改變,杯狀細胞減少,細胞核增大,細胞核質比發生變化。內源性熒光物質在正常和癌變組織中的分布存在較為顯著的差異。
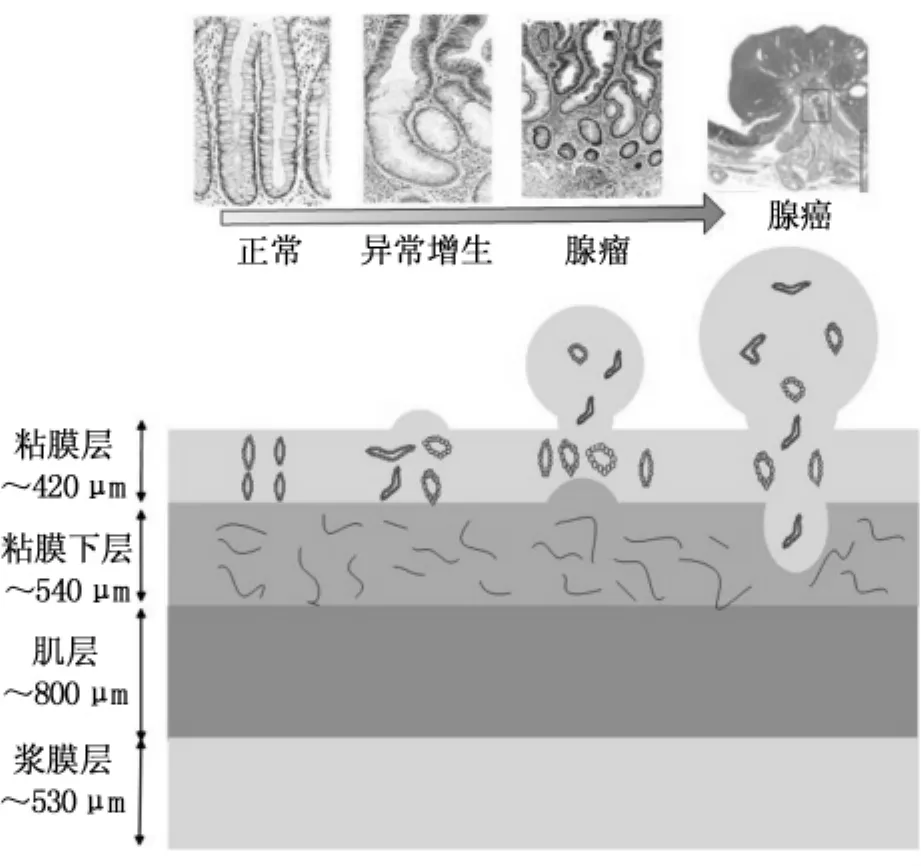
圖4 不同病變階段腸道組織的結構和病理特征Fig.4 The structure and histopathologic characteristics of colorectal tissues during neoplastic progress
2.2 自體熒光成像系統的臨床應用
應用于臨床的商業化腸道內鏡熒光成像系統包括:(1)Xillix-LIFE-GI(Xillix Technologies Corp,Richmond,BC,Canada)(激發波長 400 nm-450 nm,中心波長437 nm);(2)D-light System(Karl Storz,Tuttlingen,Germany)(激發波長 375 nm-440 nm);(3)WavSTAT,Optical biopsy system(SpectraScience,San Diego,USA)(激發波長337 nm-410 nm);(4)Evis Lucera Spectrum或AFI(Olympus,Japan)(激發波長395-475 nm)。這些系統兼有熒光內鏡和WLI兩種診斷模式,并可以在兩種模式之間實時切換。前三個系統通過內窺鏡的活檢通道實現激發光的傳輸和熒光收集,而Olympus的AFI則是白光與熒光同光路的視頻內鏡,采用兩個CCD分別采集白光和熒光圖像。Xillix-LIFE-GI系統分別檢測綠色和紅色熒光,根據紅綠熒光強度的比值進行組織類型的區分。D-light系統主要用于腸癌的藥物熒光診斷研究。新型的AFI可在普通白光、自體熒光和窄帶成像模式之間快速切換,不僅可以實現大面積的組織熒光檢查,還可以通過共焦微探頭獲得顯微圖像[52]。表3總結了這些自體熒光成像系統的臨床診斷應用結果,表明自體熒光技術能夠反映人體組織中內源性熒光物質和形態結構的微小變化,提高早期腸癌診斷的靈敏度。

表2 離體腸道組織的自體熒光物質來源和差異Tab.2 The origination and characteristics of autofluorescence for ex vivo colorectal tissues
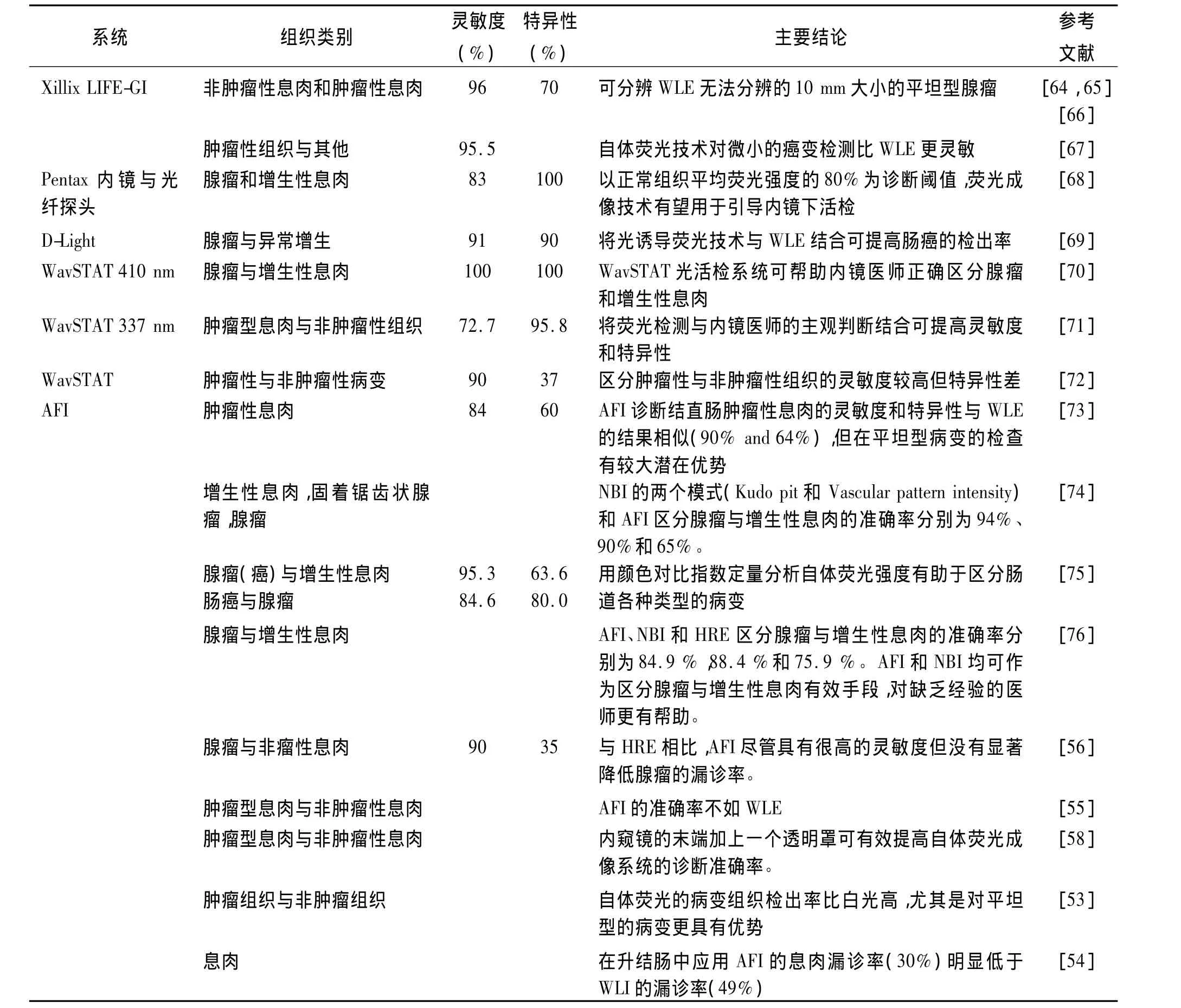
表3 自體熒光成像系統診斷腸癌的臨床應用Tab.3 Autofluorescence imaging system for clinical diagnosis of colorectal cancer
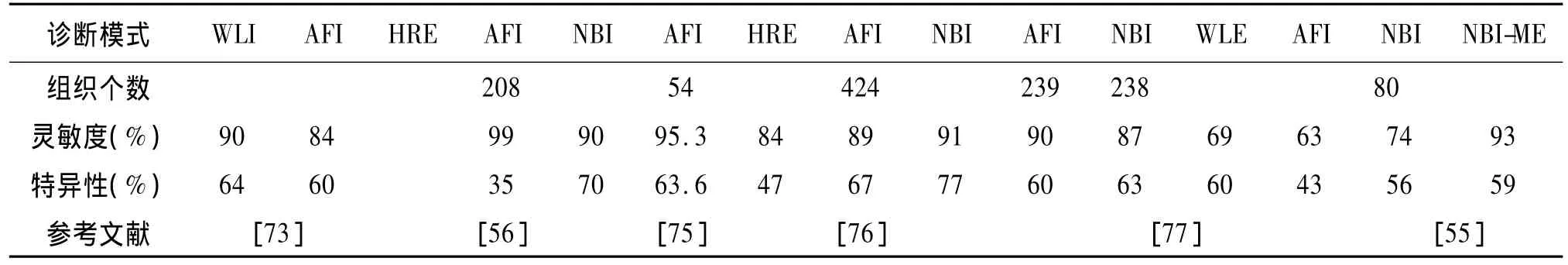
表4 自體熒光成像與其它光學技術診斷早期腸癌的性能比較Tab.4 Diagnostic sensitivity and specificity of AFI and other emerging optical modalities
應用AFI與WLI等系統診斷腸道癌變和非癌變組織的結果對比如表4所示。一些研究報道稱AFI的病變組織檢出率比WLI高,尤其是對平坦型的病變更具有優勢[53],且對升結腸的息肉漏診率(30%)明顯低于 WLI(49%)[54]。然而另有研究表明 AFI在腸道病變組織的檢測中并不占優勢[55-58]。van den Broek等認為與高分辨內鏡(HRE)相比,AFI雖具有高靈敏度,但并沒有顯著降低腺瘤的漏診率[56]。應用一定的算法把AFI和NBI的信息相結合則可獲得較高的診斷準確率,而且經驗不同的醫師診斷結果也比較一致[57]。Takeuchi等[58]認為各個研究小組應用AFI診斷腸癌的結果不一致可能由于所檢查的部位差異引起的。與升結腸相比,乙狀結腸的腸腔比較彎曲且狹窄,AFI的成像質量不如WLI,因此在這些部位進行檢查時,沒有明顯的優勢。為了改善AFI在狹窄的腸腔處的診斷效果,他們在內窺鏡的末端加上一個透明罩,使內窺鏡末端與粘膜表面保持足夠的距離,確保CCD可以接收組織表面的自體熒光。研究結果表明加上透明罩后,AFI的病變診出率明顯提高,且明顯優于WLI。
3 自體熒光技術的應用和發展趨勢
自體熒光技術能夠反映人體組織中內源性熒光物質和形態結構的微小變化,對于提高早期腸癌診斷的靈敏度具有十分重要的臨床意義。其次,自體熒光技術在臨床上的另外一個重要應用是引導手術,在患者實施腫瘤切除的手術過程中實時地確定病灶組織的邊界,有效避免組織切除的盲目性,同時降低病灶的術后復發率[59]。最后,隨著熒光分子探針及高分辨分子成像技術的發展,熒光標記分子成像技術在臨床中的應用也備受關注。研究表明將熒光標記的抗體或肽等外源性探針靶向到癌組織的過表達生物分子,應用熒光成像系統可觀察組織病變的生物過程,如上調生長因子、蛋白質水解酶和細胞粘附分子的表達等,可實現個性化的診斷和治療,大大提高平坦型腸道腫瘤的診斷率和腫瘤邊界定位精確度[60]。在該項技術中,人體組織自體熒光成為檢測熒光標記分子探針信號的主要噪聲來源。根據組織的自體熒光特性,對所檢測的信號進行實時去噪,最大限度地提高熒光標記分子探針的檢測信噪比,是開發早期腫瘤“熒光標記分子探針”診斷技術的前提。因此,揭示正常和癌變腸道組織的自體熒光光譜差異,以及內源性物質來源對于開展“熒光標記分子探針”也具有十分重要的研究意義和應用價值。
但是,由于自體熒光信號比較微弱,而且臨床醫生對顏色判別存在主觀性等客觀原因,自體熒光技術對早期腸癌的診斷特異性較低(<67%),這是制約該技術在臨床上應用推廣的瓶頸之一。光譜技術如自體熒光光譜、漫反射光譜可給出組織內源性熒光物質的變化、光學特性、形態結構和血的含量及其氧合特性等信息,具有較高的診斷特異性,將自體熒光成像技術與光譜技術相結合是提高早期腸癌診斷靈敏度和特異性的發展趨勢之一[61]。應用多波長激發和圖像處理算法提高熒光圖像的對比度是提高早期腸癌診斷靈敏度和特異性的另一發展趨勢。將325 nm波長激發的色氨酸熒光圖像除以555 nm綠光的反射圖像,突出血管的微小變化以及腫瘤部位的不均勻性,可大大提高內鏡成像的對比度[62]。Imaizumi等研制了雙波長激發的成像系統,連續采集由365 nm和405 nm激發的自體熒光圖像并計算二者的強度比值從而減少血紅蛋白吸收的影響,提高了腸道微小型腺瘤的診斷率[63]。與此同時,如何把快速、超分辨率顯微技術引入現有的熒光成像內鏡系統,以實現細胞以及亞細胞水平的顯微診斷是自體熒光技術發展的新趨勢[78]。
[1]A JEMAL,F BRAY,M M CENTER,et al.Global cancer statistics[J].CA:A Cancer Journal for Clinicians,2011,61(2):69-90.
[2]F JENKINSON and R STEELE.Colorectal cancer screeningmethodology[J].The Surgeon,2010,8(3):164-171.
[3]K TOGASHI,D G HEWETT,G L RADFORD-SMITH,et al.The use of indigocarmine spray increases the colonoscopic detection rate of adenomas[J].Journal of Gastroenterology,2009,44(8):826-833.
[4]S KATO,T FUJII,I KOBA,et al.Assessment of colorectal lesions using magnifying colonoscopy and mucosal dye spraying:Can significant lesions be distinguished?[J].Endoscopy,2001,33(4):306-310.
[5]S OBA,S TANAKA,Y SANO,et al.Current status of narrowband imaging magnifying colonoscopy for colorectal neoplasia in Japan[J].Digestion,2011,83(3):167-172.
[6]T MATSUMOTO,S NAKAMURA,T MORIYAMA,et al.Autofluorescence imaging colonoscopy for the detection of dysplastic lesions in ulcerative colitis:A pilot study[J].Colorectal Disease,2010,12(10 Online):e291-e297.
[7]T MATSUMOTO,M ESAKI,R FUJISAWA,et al.Chromoendoscopy,narrow-band imaging colonoscopy, and autofluorescence colonoscopy for detection of diminutive colorectal neoplasia in familial adenomatous polyposis[J].Disease of Colon & Rectum,2009,52(6):1160-1165.
[8]T MATSUMOTO,T MORIYAMA,T YAO,et al.Autofluorescence imaging colonoscopy for the diagnosis of dysplasia in ulcerative colitis[J].Inflammatory Bowel Disease,2007,13(5):640-641.
[9]X XIE,C LI,X ZUO,et al.Differentiation of colonic polyps by confocal laser endomicroscopy[J].Endoscopy,2011,43(2):87-93.
[10]B MAYINGER,M JORDAN,P HORNER,et al.Endoscopic light-induced autofluorescence spectroscopy for the diagnosis of colorectal cancer and adenoma[J].Journal of Photochemistry and Photobiology B:Biology,2003,70(1):13-20.
[11]X SHAO,W ZHENG,Z HUANG.In vivo diagnosis of colonic precancer and cancer using near-infrared autofluorescence spectroscopy and biochemical modeling[J].Journal of Biomedical Optics,2011,16(6):067005.
[12]B LI,S XIE.Autofluorescence excitation-emission matrices for diagnosis of colonic cancer[J].World Journal of Gastroenterology,2005,11(25):3931-3934.
[13]B BANERJEE,B MIEDEMA,H R CHANDRASEKHAR.E-mission spectra of colonic tissue and endogenous fluorophores[J].The American Journal of the Medical Sciences,1998,316(3):220-226.
[14]T J ROMER,M FITZMAURICE,R M COTHREN,et al.Laser-induced fluorescence microscopy of normal colon and dysplasia in colonic adenomas:Implications for spectroscopic diagnosis[J].The American Journal of Gastroenterology,1995,90(1):81-87.
[15]R RICHARDS-KORTUM,R P RAVA,R E PETRAS,et al.Spectroscopic diagnosis of colonic dysplasia[J].Photochemistry and Photobiology,1991,53(6):777-786.
[16]K T SCHOMACKER,J K FRISOLI,C C COMPTON,et al.Ultraviolet laser-induced fluorescence of colonic tissue:Basic biology and diagnostic potential[J].Lasers in Surgery and Medicine,1992,12(1):63-78.
[17]C EKER,S MONTAN,E JARAMILLO,et al.Clinical spectral characterisation of colonic mucosal lesions using autofluorescence and δ aminolevulinic acid sensitisation[J].Gut,1999,44(4):511-518.
[18]Z HUANG,W ZHENG,S XIE,et al.Laser-induced autofluorescence microscopy of normal and tumor human colonic tissue[J].International Journal of Oncology,2004,24(1):59-63.
[19]C R KAPADIA,F W CUTRUZZOLA,K M O’Brien,et al.Laser-induced fluorescence spectroscopy of human colonic mucosa.Detection of adenomatous transformation[J].Gastroenterology,1990,99(1):150-157.
[20]P YAKSHE,R BONNER,R PATTERSON,et al.Laser induced fluorescence spectroscopy(LIFS):Can it be used in the diagnosis and treatment of colonic malignancy?[J].The A-merican Journal of Gastroenterology,1989,84:1199(abstract).
[21]R M COTHREN,M V SIVAK Jr,J VAN DAM,et al.Detection of dysplasia at colonoscopy using laser-induced fluorescence:A blinded study[J].Gastrointestinal Endoscopy,1996,44(2):168-176.
[22]L LIU,B LIU,W LI,et al.Discriminant analysis for classification of colonic tissue autofluorescence spectra[C].Proceedings of SPIE,2010,7845,78450P.
[23]張陽德,萬小平,范春,等.大腸早癌自體熒光檢測系統研究 ⅰ.大腸癌自體熒光光譜診斷研究[J].中國內鏡雜志,1995,1(1):6-8.ZHANG Yangde.WAN Xiaoping,FANG Chun,et al.Research on diagnosis of large intestine carcinoma with autofluorescence spectra analysis[J].China Journal of Endoscopy,1995,1(1):6-8.
[24]B W CHWIROT,M KOWALSKA,N PLOCIENNIK,et al.Variability of spectra of laser-induced fluorescence of colonic mucosa:Its significance for fluorescence detection of colonic neoplasia[J].Indian Journal of Experimental Biology,2003,41(5):500-510.
[25]R M COTHREN,R RICHARDS-KORTUM,M V SIVAK Jr.et al.Gastrointestinal tissue diagnosis by laser-induced fluorescence spectroscopy at endoscopy[J].Gastrointestinal Endoscopy,1990,36(2):105-111.
[26]X SHAO,W ZHENG,Z HUANG.Near-infrared autofluorescence spectroscopy for in vivo identification of hyperplastic and adenomatous polyps in the colon[J].Biosensors and Bioelectronics,2011,30(1):118-122.
[27]C Y WANG,J K LIN,H K CHIANG.Autofluorescence spectroscopy to identify normal and cancerous colorectal tissues[C].Proceedings of the 20th Annual International Conference of the IEEE,Engineering in Medicine and Biology Society.1998,967-969.
[28]R MARCHESINI,M BRAMBILLA,E PIGNOLI,et al.Lightinduced fluorescence spectroscopy of adenomas,adenocarcinomas and non-neoplastic mucosa in human colon.I.in vitro measurements[J].Journal of Photochemistry and Photobiology B:Biology,1992,14(3):219-230.
[29]X J LUO,B ZHANG,J G LI,et al.Autofluorescence spectroscopy forevaluating dysplasia in colorectaltissues[J].Zeitschrift für Medizinische Physik,2012,22(1):40-47.
[30]M A MYCEK,K T SCHOMACKER,N S NISHIOKA.Colonic polyp differentiation using time-resolved autofluorescence spectroscopy[J].Gastrointestinal Endoscopy,1998,48(4):390-394.
[31]B MAYINGER,P HORNER,M JORDAN,et al.Light-induced autofluorescence spectroscopy for tissue diagnosis of GI lesions[J].Gastrointestinal Endoscopy,2000,52(3):395-400.
[32]L HORAK,J ZAVADIL,V DUCHAC,et al.Auto-fluorescence spectroscopy of colorectal carcinoma:ex vivo study[J].Journal of Optoelectronics and Advanced Materials,2006,8(1):396.
[33]L LIU,Y NIE,L LIN,et al.Pattern recognition of multiple excitation autofluorescence spectra for colon tissue classification[J].Photodiagnosis and Photodynamic Therapy,2012.http://dx.doi.org/10.1016/j.pdpdt.2012.07.003
[34]R A ZANGARO,L SILVEIRA,R MANOHARAN,et al.Rapid multiexcitation fluorescence spectroscopy system for in vivo tissue diagnosis[J].Applied Optics,1996,35(25):5211-5219.
[35]B LI,Z ZHANG,S XIE.Steady state and time-resolved autofluorescence studies of human colonic tissues[J].Chinese Optics Letters,2006,4(6):348-350.
[36]R VAN HILLEGERSBERG,J W VAN DEN BERG,W J KORT,et al.Selective accumulation of endogenously produced porphyrins in a liver metastasis model in rats[J].Gastroenterology,1992,103(2):647-651.
[37]H A DAILEY,A SMITH.Differential interaction of porphyrins used in photoradiation therapy with ferrochelatase[J].Biochemical Journal,1984,223(2):441-445.
[38]P HINNEN,F W DE ROOIJ,M L VAN VELTHUYSEN,et al.Biochemical basis of 5-aminolaevulinic acid-induced protoporphyrin ix accumulation:A study in patients with(pre)malignant lesions of the oesophagus[J].British Journal of Cancer,1998,78(5):679-682.
[39]C M ANDERSON,M JEVONS,M THANGARAJU,et al.Transport of the photodynamic therapy agent 5-aminolevulinic acid by distinct H+-coupled nutrient carriers coexpressed in the small intestine[J].Journal of Pharmacology and Experimental Therapeutics,2010,332(1):220-228.
[40]K IZUISHI,H TAJIRI,T FUJII,et al.The histological basis of detection of adenoma and cancer in the colon by autofluorescence endoscopic imaging[J].Endoscopy,1999,31(7):511.
[41]G BOTTIROLI,A C CROCE,D LOCATELLI,et al.Natural fluorescence of normal and neoplastic human colon:A comprehensive“ex vivo”study[J].Lasers in Surgery and Medicine,1995,16(1):48-60.
[42]B W CHWIROT,M KOWALSKA,N SYPNIEWSKA,et al.Spectrally resolved fluorescence imaging of human colonic adenomas[J].Journal of Photochemistry and Photobiology B:Biology,1999,50(2):174-183.
[43]B W CHWIROT,Z MICHNIEWICZ,M KOWALSKA,et al.Detection of colonic malignant lesions by digital imaging of uv laser-induced autofluorescence[J].Photochemistry and photobiology,1999,69(3):336-340.
[44]G I ZONIOS,R M COTHREN,J T ARENDT,et al.Morphological model of human colon tissue fluorescence[J].IEEE Transactions on Biomedical Engineering,1996,43(2):113-122.
[45]T D WANG,J VAN DAM,J M CRAWFORD,et al.Fluorescence endoscopic imaging of human colonic adenomas[J].Gastroenterology,1996,111(5):1182-1191.
[46]G S FIARMAN,M H NATHANSON,A B WEST,et al.Differences in laser-induced autofluorescence between adenomatous and hyperplastic polyps and normal colonic mucosa by confocal microscopy[J].Digestive Diseases Sciences,1995,40(6):1261-1268.
[47]H W WANG,J WILLIS,M CANTO,et al.Quantitative laser scanning confocal autofluorescence microscopy of normal,premalignant,and malignant colonic tissues[J].IEEE Transactions on Biomedical Engineering,1999,46(10):1246-1252.
[48]R S DACOSTA,L D LILGE,J KOST,et al.Confocal fluorescence microscopy,microspectrofluorimetry,and modeling studies of laser-induced fluorescence endoscopy(LIFE)of human colon tissue[C].Proceedings of SPIE,Laser-Tissue Interaction VIII,1997,2975,98.
[49]張陽德,劉蔚東,楊川,等.結腸早癌自體熒光內鏡診斷系統研究ⅰ.結腸組織顯微自體熒光圖像分析[J].中國內鏡雜志,2000,6(1):77-79.ZHANG Yangde,LIU Weidong,YANG Chuan,et al.A study on autofluorescence endoscopic diagnostic system for early colonic cancer i.microscopic autofluorescence imaging of colonic tissues[J].China Journal of Endoscopy,2000,6(1):77-79.
[50]S ZHUO,J YAN,G CHEN,et al.Label-free monitoring of colonic cancer progression using multiphoton microscopy[J].Biomedical Optics Express,2011,2(3):615-619.
[51]M YING,S ZHUO,G CHEN,et al.Real-time noninvasive optical diagnosis for colorectal cancer using multiphoton microscopy[J].Scanning,2012,34(3):181-185.
[52]H AIHARA,H TAJIRI AND T SUZUKI.Application of autofluorescence endoscopy for colorectal cancer screening:Rationale and an update[J].Gastroenterology Research and Practice,2012,971383.
[53]K INOUE,N WAKABAYASHI,Y MORIMOTO,et al.Evaluation of autofluorescence colonoscopy for diagnosis of superficial colorectal neoplastic lesions[J].International Journal of Colorectal Disease,2010,25(7):811-816.
[54]T MATSUDA,Y SAITO,K I FU,et al.Does autofluorescence imaging videoendoscopy system improve the colonoscopic polyp detection rate?-a pilot study[J].The American Journal of Gastroenterology,2008,103(8):1926-1932.
[55]A IGNJATOVIC,J EAST,T GUENTHER,et al.What is the most reliable imaging modality for small colonic polyp characterization?Study of white-light,autofluorescence,and narrowband imaging[J].Endoscopy,2011,43(2):94.
[56]F J C VAN DEN BROEK,P FOCKENS,S VAN EEDEN,et al.Clinical evaluation of endoscopic trimodal imaging for the detection and differentiation of colonic polyps[J].Clinical Gastroenterology and Hepatology,2009,7(3):288-295.
[57]F J C VAN DEN BROEK,E J VAN SOEST,A H NABER,et al.Combining autofluorescence imaging and narrow-band imaging for the differentiation of adenomas from non-neoplastic colonic polyps among experienced and non-experienced endoscopists[J].The American Journal of Gastroenterology,2009,104(6):1498-1507.
[58]Y TAKEUCHI,N UEDO,M HANAFUSA,et al.Endoscopic diagnosis of colorectal neoplasms using autofluorescence imaging[J].Intestinal Research,2012,10(2):142-151.
[59]A PROBST,D GOLGER,H ARNHOLDT,et al.Endoscopic submucosal dissection of early cancers,flat adenomas,and submucosal tumors in the gastrointestinal tract[J].Clinical Gastroenterology and Hepatology,2009,7(2):149-155.
[60]T D WANG.Targeted imaging of flat and depressed colonic neoplasms[J].Gastrointestinal Endoscopy Clinics of North America,2010,20(3):579-583.
[61]K LIN,W ZHENG,Z HUANG.Integrated autofluorescence endoscopic imaging and point-wise spectroscopy for real-time in vivo tissue measurements[J].Journal of Biomedical Optics,2010,15(4):040507.
[62]B BANERJEE,T RENKOSKI,L R GRAVES,et al.Tryptophan autofluorescence imaging of neoplasms of the human colon[J].Journal of Biomedical Optics,2012,17(1):016003.
[63]K IMAIZUMI,Y HARADA,N WAKABAYASHI,et al.Dualwavelength excitation of mucosal autofluorescence for precise detection of diminutive colonic adenomas[J].Gastrointestinal Endoscopy,2012,75(1):110-117.
[64]J HARINGSMA,G N TYTGAT,H YANO,et al.Autofluorescence endoscopy:feasibility of detection of GI neoplasms unapparent to white light endoscopy with an evolving technology[J].Gastrointestinal Endoscopy,2001,53(6):642-650.
[65]J HARINGSMA,G N TYTGAT.The value of fluorescence techniques in gastrointestinal endoscopy:better than the endoscopist’s eye?I:the european experience[J].Endoscopy,1998,30(4):416-418.
[66]M VAN LERLAND-VAN LEEUWEN,G TYTGAT.Detection of dysplasia using fluorescence in vivo using the Xillix-LIFE-GI system[J].Endoscopy,1996,28 S44-45.
[67]W CEBULA,W ZIELEZNIK,A SIERON,et al.Laser-induced fluorescent endoscopy(LIFE)in detection of malignant lesions of the colon[C].Proceedins of SPIE,2001,4156,272-276.
[68]T D WANG,J M CRAWFORD,M S FELD,et al.In vivo identification of colonic dysplasia using fluorescence endoscopic imaging[J].Gastrointestinal Endoscopy,1999,49(4):447-455.
[69]S BRAND,H STEPP,T OCHSENKüHN,et al.Detection of colonic dysplasia by light-induced fluorescence endoscopy:A pilot study[J].International Journal of Colorectal Disease,1999,14(1):63-68.
[70]Z BENES,Z ANTOS.Optical biopsy system distinguishing between hyperplastic and adenomatous polyps in the colon during colonoscopy[J].Anticancer Research,2009,29(11):4737-4739.
[71]C SCHMIDT,I PETERSEN,A STALLMACH.Su1488 laserinduced fluorescence to distinguish adenomatous from non-adenomatous colorectal polyps[J].Gastrointestinal Endoscopy,2012,75(4):AB350.
[72]T KUIPER,Y A ALDERLIESTE,K M TYTGAT,et al.Sa1601 differentiation of small colorectal lesions;laser-induced autofluorescence using the wavstat[J].Gastrointestinal Endoscopy,2012,75(4):AB216.
[73]N UEDO,K HIGASHINO,R ISHIHARA,et al.Diagnosis of colonic adenomas by new autofluorescence imaging system:A pilot study[J].Digestive Endoscopy,2007,19(s1):S134-S138.
[74]K S BOPARAI,F J C VAN DEN BROEK,S VAN EEDEN,et al.Hyperplastic polyposis syndrome:A pilot study for the differentiation of polyps by using high-resolution endoscopy,autofluorescence imaging,and narrow-band imaging[J].Gastrointestinal Endoscopy,2009,70(5):947-955.
[75]K ARITA,K MITSUYAMA,H KAWANO,et al.Quantitative analysis of colorectal mucosal lesions by autofluorescence endoscopy:Discrimination of carcinomas from other lesions[J].Oncology Reports,2011,26(1):43-48.
[76]R SATO,M FUJIYA,J WATARI,et al.The diagnostic accuracy of high-resolution endoscopy,autofluorescence imaging and narrow-band imaging for differentially diagnosing colon adenoma[J].Endoscopy,2011,43(10):862.
[77]T KUIPER,F J C VAN DEN BROEK,A H NABER,et al.Endoscopic trimodal imaging detects colonic neoplasia as well as standard video endoscopy[J].Gastroenterology,2011,140(7):1887-1894.
[78]R SHUKLA,W ABIDI,R RICHARDS-KORTUM,et al.Endoscopic imaging:How far are we from real-time histologhy[J].World Journal of Gastrointestinal Endoscopy,2011,3(10):183-194.

