不同加樣方式對抗-HCV ELISA檢測結果的影響
任忠國
目前國內血站檢測抗-HCV的方法,多為間接ELISA法。間接ELISA檢測獻血者血漿的加樣量僅10 μl,加樣量非常小,這就要求我們的加樣系統必須十分精確,以保證檢測結果的準確性。在實際工作中,我們多采用自動化設備來檢測,而自動化儀器加樣的方式也可以分為兩種,一種是直接將標本加注到HCV稀釋液中,另一種是將標本加注到稀釋液后,再采用反復吸打的方式進行混合,筆者發現采用不同的加樣方式,對檢測抗-HCV的結果有著較大的影響,現報告如下。
1 材料與方法
1.1 材料 陰性標本:經本站兩家試劑檢測的抗-HCV陰性獻血者標本。弱陽性標本:采用抗-HCV質控品(0.5NCU/ml),北京康徹思坦公司,批號:201105003。
ELISA抗-HCV試劑:廈門新創試劑,批號:2011115824。
1.2 儀器 全自動酶免分析系統:AT PLUS2、FAME24/20瑞士哈米爾頓公司。
1.3 方法 采用同一廠商試劑,采用不同的加樣方式進行加樣,在同一臺FAME后處理中進行檢測。
加樣方式:混合方式:吸取10 μl標本,加入相應的酶標孔HCV稀釋液中,并反復吸打一次。每板加40份陰性標本和40份弱陽性標本。未混合方式:吸取10 μl標本,直接加入相應的酶標孔HCV稀釋液中。每板加40份陰性標本和40份弱陽性標本。
1.4 統計學方法 產生數據采用SPSS 17.0統計分析,配對資料采用t檢驗,P<0.05為差異,有統計學意義。
2 結果
不同加樣方式檢測結果比較,見表1
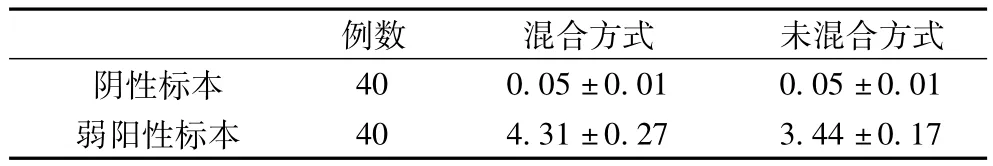
表1 不同加樣方式檢測結果比較(S/CO值)。
3 討論
兩種加樣方式中,對于確定為陰性的標本,結果并無影響(P>0.05),但對于弱陽性標本,本文中主要以0.5NCU/ml的質控品代替弱陽性標本進行試驗,結果差異顯著(P<0.01)。這種差異的出現,筆者認為可能原因如下:①混合加樣方式,使標本在稀釋液中得到充分混合,減少了標本在稀釋液中自由擴散達到混勻的時間。②加樣過程中,處理器加樣針尖處可能由于液體的表面張力的作用而存在液滴,在不采用混合加樣模式下,該存留的液滴將使相對加樣誤差達到0.4%以上[1]。由于血漿與水具有不同的粘滯系數,所以在加入血漿等粘滯系數較大的液體時,這種誤差會更加明顯,正是這種誤差造成了檢測結果的差異。經筆者深入試驗發現,如果采用未混合加樣方式,加樣量12 μl約可達到混合加樣方式檢測結果的S/CO值。
有學者的研究結果表明,血站篩檢獻血者血液時,應將抗HCV ELISA的陽性判斷值下限20%,即0.8,這對于減少HCV的經輸血傳播有重要意義[2]。也就是說,對于ELISA檢測接近cut-off值的,會有“灰區”標本的存在。對于這種標本,如采用未混合加樣方式檢測抗-HCV,很可能會判斷為陰性,而采用混合加樣方式則有可能檢出。所以對于弱陽性標本,尤其是灰區標本來講,混合加樣方式會比未混合加樣方式增加檢出率。
對于ELISA檢測實驗中試劑的平衡時間、溫度、洗板等原因對檢測結果的影響,多見諸文獻報導[3],但對于加樣方式對間接ELISA法檢測抗-HCV結果的影響未見深入探討。
HCV主要經血液途徑傳播,PTH 90%是 HCV[4]。抗-HCV的檢測已成為重要的防止HCV經輸血傳播的手段之一。目前國內血站系統檢測抗-HCV多為第三代ELISA間接法試劑,該種試劑采用樣本量10 μl加入到100 μl樣本稀釋液中,加入樣本量較小。建議如有可能,在抗-HCV檢測過程中,應采用加入標本后并進行混合的加樣方式,以增加弱陽性標本的檢出。
[1]李金明.臨床酶免疫測定技術.北京:人民軍醫出版社,2006:140.
[2]鄧巍,王露楠,李金明.丙型肝炎病毒抗體酶聯免疫吸附試驗陽性判斷值在獻血員血液篩檢中的意義.中華檢驗醫學雜志,2004,27(10):664.
[3]閔志軍,張力超,張建偉,等.試劑盒平衡時間對抗-HCV檢測結果的影響因素分析.臨床血液學雜志,2010,23(12):713-715.
[4]馬現君,陳元鋒,楚中華,等.無償獻血者不同人群抗HCV流行情況調查研究.臨床血液學雜志,2008,21(4):195-196.

