Phadia250全自動熒光免疫分析系統性能驗證
馮霞 劉子杰 何成祿 徐從瓊 李婭 何增品 謝瓊
Phadia250全自動體外檢測系統是由瑞典Phadia公司研制,基于熒光酶聯免疫分析法原理,以提供過敏、氣喘及自體免疫疾病的臨床診斷和監控為目的,集反應、檢測和數據分析為一體的全自動熒光免疫分析系統。ImmunoCAP特異性IgE定量是檢測人血清或血漿中過敏原特異性IgE的體外實驗方法,是用羊抗人IgE抗體包被的ImmunoCAP,捕獲血清中存在的人體受食物和空氣中變應原攻擊后所產生的特異性IgE抗體,再以熒光標記的發展液與之結合,熒光強度的大小與待檢特異性IgE的含量呈正相關。以WHO標定的IgE標準品含量的對數做橫坐標,以熒光強度為縱坐標,繪制半對數曲線,由該曲線可以確定不同的熒光強度所對應的特異性IgE含量。PhadiaImmunoCAP檢測過敏原的方法被認為是國際過敏原檢測的公認標準,其他任何一種方法都要與其進行比較。我科于2011年購買了一臺該型號的儀器,我們對該儀器的準確性、穩定性、重復性、線性等相關性能的進行了評價,現將檢測結果報告如下。
1 儀器與方法
1.1 儀器 瑞典Phadia AB公司生產的Phadia 250全自動體外熒光免疫分析系統。
1.2 試劑ImmunoCAP特異性IgE質控品、ImmunoCAP特異性IgE校準品(條)0-100、ImmunoCAP特異性IgE酶標二抗、清洗液、底物液以及終止液等。所用試劑及質控品均為Phadia AB公司原裝進口。
1.3 加樣精度 分別對樣本(sample)、發展液(development)和終止液(stop solution)加樣量進行測試,按IDM軟件中虛擬Immuno反應盤提示,將20個已稱重量(G1)的檢測Immuno-CAP放入反應盤中的正確位置,選擇“Replicate”為20次。執行加樣操作后,將檢測CAP小心取出,并立刻稱重(G2)。加樣重量(G)按G=G2-G1。計算20次加樣的均值和CV%,CV%應小于廠家聲明的加樣2%。
1.4 精密度 該方案在EP-5文件的關于精密度方案的基礎上進行改良,取足夠量的特異性IgE項目兩個濃度(低值0.35 kUA/L、高值100kUA/L)的陽性質控品,每天做2批實驗,批間的時間相差不少于2 h,每批的樣品做雙份檢測,共做5 d實驗。一共20個結果,每對結果間的差是每批的批內差。一天中每批雙份結果的均值之間的差表示這一天的批間差。對這些批間差統計后,減去其中的批內差,成為真正的批間不精密度[1]。并按公式(1)計算變異系數(CV,%),變異系數應符合廠商聲明的要求,批內精密度(CV,%)≤5%,批間批間精密度(CV,%)≤5%。
1.5 準確性 ①陽性質控品:測試特異性IgE項目三個濃度的陽性質控品(0.35 kUA/L、17.5 kUA/L、100 kUA/L),每個質控品測試2次,分別計算平均值,平均值應在標稱范圍內。并分別計算絕對偏差=測定值-靶值,相對偏差=絕對偏差/靶值×100%,因國際及廠家均無此項有關偏倚的聲明,參照美國臨床實驗室修正法規(CLIA'88)規定的總允許誤差[2]。允許偏倚設為15%。②陰性質控品:測試樣本稀釋液和0.35 kUA/L陽性質控品各2次,分別計算熒光響應值平均值,稀釋液熒光響應平均值應<0.35 kUA/L陽性質控品熒光響應值。
1.6 線性 將特異性IgE濃度為90kUA/L的標本(H),混合均勻后,用專用 Diluent稀釋液(L)按 H、1 h+5 L、2 h+4 L、3 h+3 L、4 h+2 L、5 h+1 L、L進行稀釋,按濃度由高到低的順序進行檢測后,在按濃度由低到高的順序進行檢測。取各濃度水平的平均值。以稀釋濃度(預期值)為自變量,以測定結果均值(實測值)為因變量求出線性回歸方程,計算線性回歸的相關系數。
1.7 攜帶污染率 取高濃度特異性IgE質控品(100kUA/L)和低濃度質控品(0.35kUA/L)各一份,先測定高值3次(H 1、H2、H 3),再測定3 次低次(L1、L2、L3); 同樣先測定高值3 次(H 1、H2、H3),再測定3 次低值(L1、L2、L3)。按公式:K=[(L1-L3)/(H 3-L3)]計算攜帶污染率。按廠家聲明,攜帶污染率應<10-4。
1.8 報告范圍 按照CLSI EP9-A2文件,隨機選取無過敏史及風濕免疫性疾病史的健康體檢志愿者20例(男、女各10例)作為參考個體,比較小樣本參考區間和廠家提供參考區間之間的可比性。如果20例參考個體中不超過2例(或10%的結果)的觀察值在廠家提供的參考區間之外,廠家提供的95%參考區間可以接受,也就是說,可以直接引用廠家提供的參考區間[3]。
2 結果
2.1 加樣精密度 進入儀器“PIPETTE DISPENSING TEST”界面,分別選擇樣本(sample)、發展液(development)和終止液(stop solution)測試,按IDM軟件中虛擬Immuno反應盤提示,將20個已稱重量(G1)的檢測ImmunoCAP放入反應盤中的正確位置,選擇“Replicate”為20次。執行加樣操作后,將檢測CAP小心取出,并立刻稱重(G2)。加樣重量(G)按G=G2-G1。計算20次加樣的均值和CV%。
樣本(sample)、發展液(development)和終止液(stop solution)三種加樣量的加樣精度驗證結果見表1。均小于廠家聲明的加樣CV% <2%。

表1 加樣精度
2.2 精密度 按預定方案進行精密度驗證,低值和高值定值質控精密度見表2和表3。
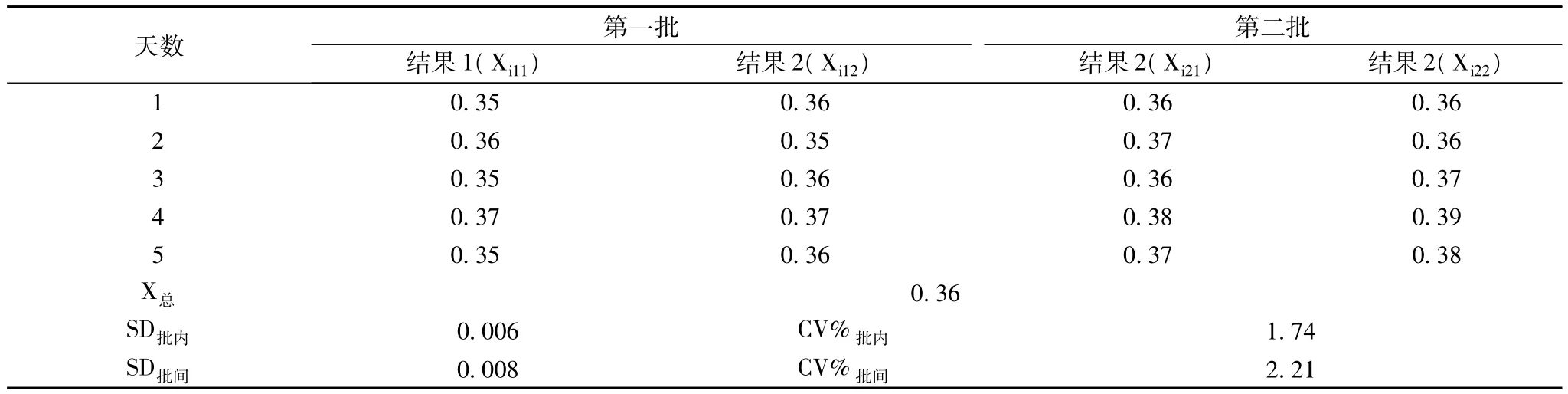
表1 低值(0.35kUA/L)精密度
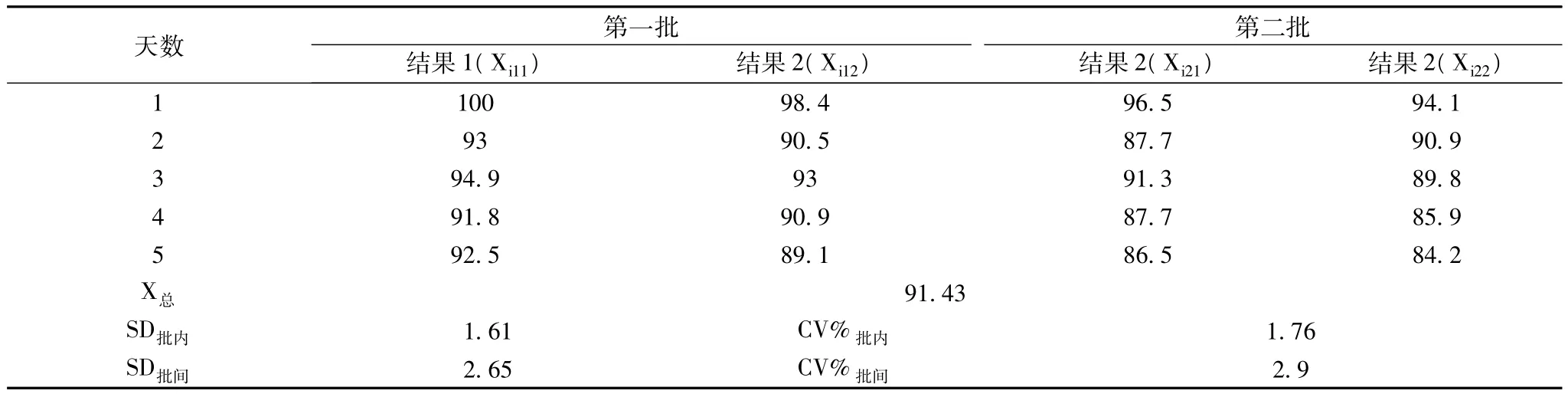
表2 高值(100kUA/L)精密度
2.3 準確度 陽性定值質控準確度結果見表4。
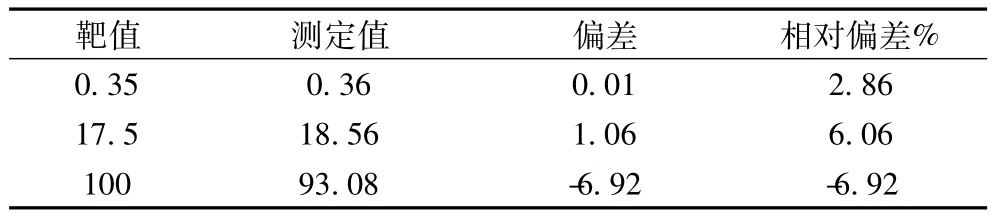
表4 陽性定值質控驗證結果
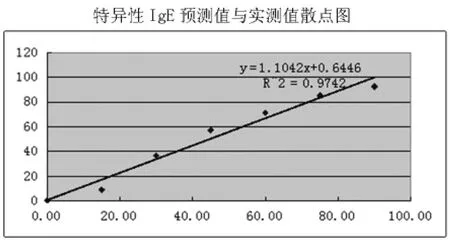
2.4 線性 將特異性IgE濃度為100的患者血清用專用“dilution”稀釋后,按預定方案測定2次,各點平均濃度分別為0.35、8.99、36.6、57.3、71.3、85.3 和 92.5 kUA/L,其測定值與理論值的直線相關系數為0.987,R2=0.974,特異性IgE預測值與實測值散點圖見下圖。
2.5 攜帶污染率 高值和低值各次的平均值為:96.5 kUA/L、97.4 kUA/L、100 kUA/L、0.35 kUA/L、0.35 kUA/L、0.36 kUA/L。根據公式K=(L1-L3)/(H3-L3)計算攜帶污染率。特異性IgE的攜帶污染率為0.1×10-4。符合廠家聲明相符。
2.6 報告范圍 隨機選取無過敏史及風濕免疫性疾病史的健康體檢志愿者20名,采空腹血5 ml,測定血清中特異性IgE水平,0.35 kUA/L質控品的平均熒光響應值143。健康志愿者該項目熒光響應值除1例為174,其余均低于143,最小響應值為21。廠家提供的特異性IgE參考范圍為<0.35 kUA/L,20名志愿者中,有19例測定值在該范圍之內。
3 結論
根據美國臨床和實驗室標準化協會(clin ica l and laboratory standards institute,CLSI)在 EP19-P中的注釋,驗證(demonstrat ion)是由醫學檢驗部門進行,驗證所使用系統獲得預期性能方面的能力,并且驗證實驗的實驗方案要求簡便、實用、易于操作[4]。本實驗除進行了精密度、準確度、線性范圍及參考區間的驗證外,還對儀器的加樣精度、攜帶污染進行了驗證,并以制造商儀器說明書和試劑說明書中聲明的性能指標為驗證目標或標準來判斷驗證實驗的成功與否。
Phadia 250全自動熒光免疫系統由于其基于ImmunoCAP的特殊固相免疫反應設計。其加樣精度的驗證不同于其他免疫系統或全自動生化分析系統,必須依賴于檢測ImmunoCAP進行稱重。儀器右側的加樣針只進行40ul的樣本或酶液的吸取,左邊的加樣針僅進行50ul的development和200ul的stop solution的吸取。并對相應體積進行了固定。本實驗中,各種液體的加樣量均符合相應要求。
Phadia250全自動體外檢測系統是瑞典生產并提供試劑的全封閉性系統,提供了歐美人群的特異性IgE參考區間,所以只需要選擇20個參考個體的樣本進行驗證,20例樣本特異性IgE的熒光響應值僅有1例超出參考范圍下限0.35的熒光響應值,其余均在此范圍內,可以引用此參考區間作為本實驗室特異性IgE的參考區間。
綜上所述,Phadia250全自動體外檢測系統測定特異性IgE的精密度、準確度、分析測量范圍及參考范圍性能均與廠家聲明一致;此驗證方案和實驗方法簡便可行,可用于其他項目的性能驗證。
[1]馮仁峰.臨床檢驗質量管理技術基礎.第1版.上海科學技術文獻出版社,2003:42.
[2]張秀明,溫冬梅,袁勇.臨床生物化學檢驗質量管理與標準操作程序.北京:人民軍醫出版社,2007:103.
[3]王凡,蔣紅君.羅氏2010免疫分析儀檢測甲胎蛋白的性能驗證. 現代預防醫,2012,39(15):3911-3914.
[4]張莉,吳炯,郭瑋,等.醫學檢驗檢測系統應用前的性能評價.檢驗醫,2006,21(6):560-563.

