西洛他唑與氯吡格雷對ACS患者抗炎作用研究
李曉英,陳還珍,鄭嫻勇,王兆宏,劉國英
抗血小板藥物可能通過抗炎作用預防動脈粥樣硬化,促進斑塊穩(wěn)定[1]。本研究觀察氯吡格雷、西洛他唑對急性冠脈綜合征(ACS)患者血清白細胞(WBC)計數、血脂和炎性因子水平的影響,探討二者對ACS患者斑塊穩(wěn)定性和炎癥抑制的作用、機制及與他汀類藥物的協(xié)同作用。
1 資料與方法
1.1 研究對象 選擇ACS患者82例,男性44例,女性38例;年齡28歲~79歲(60.5歲±9.4歲)。ACS診斷依據 WHO標準,其中65例經冠狀動脈造影確診。排除:感染、腫瘤、結核、自身免疫性疾病、家族性高膽固醇血癥、甲狀腺疾病、肝腎疾病、他汀類過敏、血小板減少等抗凝,抗血小板聚集治療禁忌證。入選前均未正規(guī)調脂,未服用西洛他唑或氯吡格雷。
1.2 分組 根據入院先后順序將82例ACS患者隨機分成3組。A組(常規(guī)用藥+阿托伐他汀)20例,B組(氯吡格雷+常規(guī)用藥)32例,C組(西洛他唑+常規(guī)用藥)30例。3組年齡、性別、病種、伴發(fā)疾病、心血管危險因素(如肥胖指數、高血壓、高血脂、高血糖、吸煙)無統(tǒng)計學意義。
1.3 治療方法 入院后均行冠心病常規(guī)治療:阿司匹林、低分子肝素、硝酸酯類、β受體阻滯劑等藥物,均包括阿托伐他汀(立普妥,Godecke GmbH生產,輝瑞制藥有限公司分裝,國藥準字:J20030048)每20mg。B組加用氯吡格雷(波立維,Sanofi Withrop Industrie生產,杭州賽諾菲圣德拉堡制藥有限公司分裝,國藥準字:J2004006)每早75mg。C組加用西洛他唑(培達,日本大冢制藥有限公司研制,浙江大冢制藥有限公司生產,國藥準字:H10960014)50mg,2次/天。共服用3周。
1.4 觀察指標 臨床療效:觀察胸痛發(fā)作次數、程度、持續(xù)時間、緩解情況、發(fā)生心血管事件情況等。治療前后hs-CRP和TNF-α、IL-1β水平的變化。檢測血脂、血常規(guī),觀察 WBC計數及血脂各項水平的變化。觀察用藥期間藥物不良反應,密切監(jiān)測相關指標。
1.5 檢測方法 治療前及治療3周后清晨空腹采取肘靜脈血5mL。hs-CRP采用酶聯免疫吸附法,試劑盒購自美國DSL公司(批號為RD1029)。TNF-α、IL-1β采用放射免疫法,試劑盒均購自北京北方生物技術研究所(批號分別為20060901A、20060820),TNF-α、IL-1β檢測的敏感度分別為6fmol/mL、0.1 ng/mL;批內CV<10%、12%,批間CV<15%、13%。
1.6 統(tǒng)計學處理 采用SPSS11.5處理,組內用配對t檢驗,用均數±標準差(x±s)表示;組間用單因素方差分析和SNK-q檢驗,α=0.05;相關分析采用直線相關分析。
2 結 果
2.1 3組各項檢測指標變化(見表1~表3)

表1 3組治療前后血脂水平比較(x±s) mmol/L
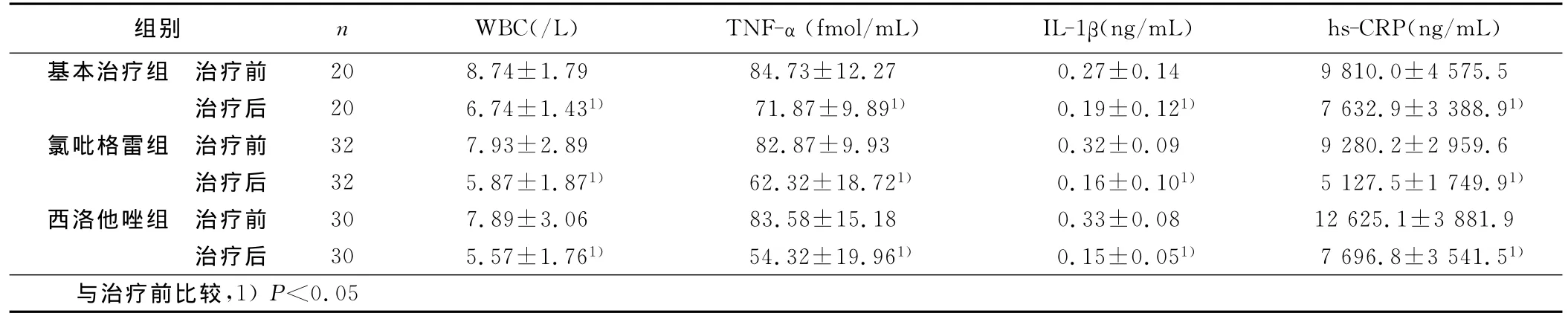
表2 3組TNF-α、IL-1β等水平比較(x±s)
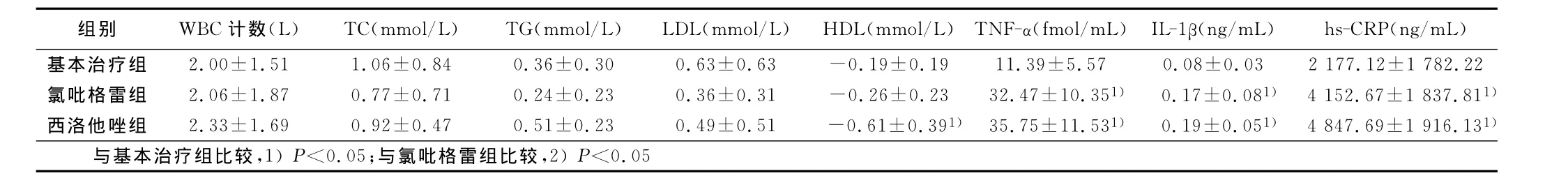
表3 3組治療后血脂及炎性因子等下降幅度比較(x±s)
2.2 相關性分析 西洛他唑組治療前后hs-CRP下降幅度與TNF-α、IL-1β下降幅度呈正相關(r=0.380,P=0.038;r=0.376,P=0.040),治療前后 HDL-C變化值與TNF-α、IL-1β的變化值呈負相關(r=-0.38,P=0.04;r=-0.39,P=0.03)。
2.3 安全性觀察 氯吡格雷、西洛他唑兩組胸痛程度較基本治療組減輕,發(fā)作次數及持續(xù)時間明顯少于基本治療組。觀察期間基本治療組有2例發(fā)生心臟性死亡退出研究,氯吡格雷、西洛他唑兩組均無心性死亡病例。2例有輕度惡心,1例1月后出現GPT輕度升高<2倍正常值,1例服用氯吡格雷1周后出現皮膚局部出血點外。兩組患者肝腎功能均無明顯變化,未發(fā)現嚴重出血及其他不良反應。
3 討 論
動脈粥樣硬化(AS)是一種涉及血小板、白細胞等多種炎癥細胞和因子的慢性炎癥反應[2,3]。ACS患者循環(huán)血炎性細胞因子水平升高,細胞因子間通過合成分泌的相互調節(jié),受體表達的相互調控,生物學效應的相互影響而形成復雜的細胞因子網絡影響炎癥過程。其中,TNF-α、IL-1β是兩種重要的促炎因子,主要來源于單核或巨噬細胞,TNF-α是細胞因子網絡的關鍵部分,它可誘導IL-1β等的釋放,IL-1β、TNF-α可活化內皮細胞,逆轉其正常生理功能,引起細胞死亡、LDL氧化、白細胞黏附、血小板聚集、血栓形成、平滑肌細胞(SMC)增生、基質金屬蛋白酶(MMPs)表達增加[4]、影響脂代謝,促動脈粥樣硬化;另外,IL-1β、TNF-α還可進一步活化單核或巨噬細胞、T淋巴細胞、SMC,加強斑塊內炎癥,促進MMPs纖溶酶原激活物的釋放,加速細胞外基質的降解,誘發(fā)ACS的發(fā)生[5]。CRP是反映粥樣硬化炎癥進程的敏感指標,又與血小板活化密切相關[6],它與LDL-C相互作用損害細胞膜,激活補體系統(tǒng),促進炎癥反應,刺激炎性介質的釋放和表達。Hs-CRP被認為是急性心血管事件最強的炎性標記物[7],而且其水平變化與ACS的發(fā)生、發(fā)展及病變嚴重度密切相關。因此有效降低患者TNF-α、IL-1β、炎癥細胞和Hs-CRP水平可以作為判定療效指標及藥物發(fā)揮抗炎作用的機制之一。
血小板作為一種炎癥細胞,在AS的發(fā)生發(fā)展中起著重要的作用[8]。臨床試驗證實抗血小板藥物在冠心病(CHD)、ACS等AS相關疾病中能夠明顯降低血管事件的發(fā)生率和病死率,傳統(tǒng)觀念認為這主要得益于抗血小板藥物抑制血小板聚集和血栓形成的作用。抗血小板藥物不僅減少血栓形成,還減輕局部炎癥反應[9],抑制AS斑塊進展[10],通過抗炎作用起到預防動脈粥樣硬化,促進斑塊穩(wěn)定的作用,但其作用機制并不十分明確。近年來,人們認識到新型二磷腺苷(ADP)受體阻斷劑氯吡格雷和磷酸二酯酶Ⅲ抑制劑西洛他唑在抗血小板聚集和血栓形成過程中起著重要作用,此外西洛他唑不僅具有抗血栓和血管擴張作用,還能抑制血管平滑肌細胞的增殖等。而且,目前二者已廣泛用于治療冠心病(CHD)、ACS,以及預防經皮冠狀動脈介入治療(PCI)術后再狹窄,降低心血管事件的發(fā)生[11-13]。
本研究察氯吡格雷和西洛他唑對hs-CRP、TNF-α和IL-1β的作用,結果顯示在常規(guī)用藥基礎上阿托伐他汀加用氯吡格雷治療的ACS患者和阿托伐他汀加用西洛他唑治療的ACS患者治療3周后血清hs-CRP、TNF-α和IL-1β水平均明顯降低,與單用阿托伐他汀組比較差異顯著(P<0.05),這證實氯吡格雷和西洛他唑均都可通過降低ACS患者TNF-α、CRP等致炎因子水平來抑制炎癥、促進斑塊穩(wěn)定。而氯吡格雷和西洛他唑兩組間下降幅度無明顯差異,說明二者在抗血小板聚集的同時又具有相似的抗炎作用。氯吡格雷和西洛他唑對炎癥細胞的影響,研究結果中顯示,三組治療后白細胞計數水平雖均有下降趨勢,組間卻無顯著差異,可能是因為不少患者觀察期間應用抗生素治療所致。有資料顯示[14],他汀類藥物可降低ACS患者TNF-α、CRP水平。本研究也觀察到基本治療組治療3周后,血清TNF-α、IL-1β、Hs-CRP均降低,說明包含他汀類藥物的基本治療也可通過降低炎性細胞因子水平起到抑制炎癥的作用。但基本治療組血清TNF-α、IL-1β、Hs-CRP降低的幅度低于氯吡格雷、西洛他唑兩聯合用藥組,可見在他汀類藥物治療基礎上聯用氯吡格雷或西洛他唑可進一步降低致炎因子濃度,抑制血小板活化,促進斑塊穩(wěn)定,這為臨床ACS患者應用和選擇抗血小板藥提供進一步的理論依據。本研究中,3組在治療3周后血清血脂水平改善(P<0.05)。Elam等[15]報道西洛他唑可以降低動脈硬化患者血清TG水平,升高HDL-C水平,在2周時對HDL-C作用明顯,4周時對TG的作用明顯。本研究中也觀察西洛他唑治療3周后可顯著升高HDL-C,而對TG的影響無統(tǒng)計學意義,可能與用藥時間短及心梗后血脂水平應激性下降有關。西洛他唑組治療前后TNF-α、IL-1β變化值與HDL-C變化值呈負相關。而HDL可通過抑制LDL氧化、減少TNF-α和IL-1β等炎癥細胞因子的釋放及抑制轉錄因子NF-κB的激活來減輕炎癥反應[16,17],這也可能是上述指標呈負相關的原因。觀察期間內未發(fā)生心血管惡性事件;3周也無嚴重出血、肝腎功能損害等副作用。
氯吡格雷和西洛他唑均為具有多重生物學活性的抗血小板藥物,對于ACS患者在常規(guī)治療基礎上,阿托伐他汀聯用氯吡格雷或西洛他唑較單用阿托伐他汀均可進一步降低致炎因子水平,抑制血小板活化,即通過多重機制促進斑塊穩(wěn)定,減少心臟事件,且二者具有相似的抗炎作用;其中西洛他唑還可通過升高高密度脂蛋白,與他汀類藥物發(fā)揮更好的協(xié)同作用;聯用后方便可行,安全可靠。
[1] Cyrus T,Sung S,Zhao L,et al.Effect of low-dose aspirin on vascular inflammation,plaque stability,and atherogenesis in low-density lipoprotein receptor deficient mice[J].Circulation,2002,106(10):1282-1287.
[2] Libby P,Ridker PM,Maseri A.Inflammation and atherosclerosis[J].Circulation,2002,105(9):1135-1143.
[3] 李艷,黃從新.重要炎性因子在冠心病病理過程中的作用[J].微循環(huán)學雜志,2004,14(1):47-49.
[4] Ferreios ER,Boissonnet CP,Pizarro R,et al.Independent prognostic value of elevated C-reactive protein in unstable angina[J].Circulation,1999,100(19):1958-1963.
[5] Prediman K,Shah MD.Plaque disruption and thrombosis:Potential role of inflammation and infection[J].Cardiol Rev,2000,8(3):32-39.
[6] Muir KW,Weir CJ,Alwan W,et al.C-reactive protein and outcome after ischemic stroke[J].Stroke,1999,30(5):981-985.
[7] Rosenson RS,Koenig W.High-sensitivity C-reactive protein and cardiovascular risk in patients with coronary heart disease[J].Curr Opin Cardiol,2002,17(4):325-331.
[8] Huo Y,Schober A,Forlow SB,et al.Circulating activated platelets exacerbate atherosclerosis in mice deficient in apolipoprotein E[J].Nature Medcine,2003,9(1):61-67.
[9] 顧晴,陳紀林,阮英茆,等.阿司匹林、氯吡格雷及合用對兔動脈粥樣硬化病變進展的抑制作用[J].中國醫(yī)學科學院學報,2004,27(1):87-91.
[10] 唐熠達,陳紀林,阮英茆,等.不同劑量阿司匹林對兔動脈粥樣硬化斑塊進展的抑制作用[J].中華心血管病雜志,2003,31(8):609-612.
[11] Douglas JS,Weintraub WS,Holmes D.Rationale and design of the randomized,multicenter,cilostazol for restenosis(CREST)trial[J].Clin Cardiol,2003,26(10):451-454.
[12] Park SW,Lee CW,Kim HS,et al.Effects of cilostazol on angiographic restenosis after coronary stent placement[J].Am J Cardiol,2000,86(5):499-503.
[13] 王長華,胡大一.氯吡格雷在缺血性心臟病中的應用[J].心血管病進展,2005,26(1):52-55.
[14] Musial J,Undas A,Gajewski P,et al.Anti-inflammatory effects of simvastatin in subjects with hypercholesterolemia[J].Int J Cardiol,2001,77(2-3):247-253.
[15] Elam MB,Heckman J,Crouse JR,et al.Effect of the novel antiplatelet angent cilostazol on plasma lipoprteins in patients with intermittent claudication[J].Arterioscler Thromb Vasc Biol,1998,18(12):1942-1947.
[16] Cockerill GW,Huehns TY,Weerasinghe A,et al.Elevation of plasma high-density lipoprotein concentration reduces interleukin-1induced expression of E-selectin in an in vivo model of acute inflammation[J].Circulation,2001,103(1):108-112.
[17] Randolph GJ,Beaulieu S,Lebecque S,et al.Differentiation of monocytes into dendritic cells in a model of transendothelial trafficking[J].Science,1998,282(5388):480-483.

