miR-155反義寡核苷酸轉染對甲狀腺癌細胞遷移、侵襲和MMP-13表達的影響
王娟,俞力,范鈺
(1.江蘇大學附屬醫院輸血科,江蘇鎮江212001;2.江蘇大學附屬醫院內分泌科,江蘇鎮江212001;3.江蘇大學附屬人民醫院腫瘤研究所,江蘇鎮江212002)
近年來,甲狀腺癌發病率逐漸增高,由于發現較晚,部分患者確診時甲狀腺癌出現轉移,給臨床治療帶來了一定困難。檢測腫瘤分子標志物并探討其相關致病分子機制,將有效改善甲狀腺癌診斷的整體水平。
越來越多的研究表明,多種人類腫瘤的發生發展都與微小RNAs的異常表達有著密切關系[1-3]。微小RNAs是RNA信號傳導通路中一個極其重要的調控分子,可通過不同表達方式調控腫瘤細胞的增殖、分化及凋亡等[1]。近年來,很多研究者發現,miR-155在多種實體瘤組織或細胞中高表達,如乳腺癌、大腸癌、宮頸癌、胰腺導管腺癌(PDAC)等[4-7],且與癌細胞增殖有關。但有關 miR-155在人甲狀腺癌體外細胞中的作用研究甚少[8],本課題利用反義寡核苷酸(antisense oligodeoxyribonucleotides,AS)下調miR-155的表達,觀察反義寡核苷酸對人甲狀腺癌BCPAP細胞系生長侵襲的影響,探討miR-155在甲狀腺癌發病中可能的作用機制。
1 材料與方法
1.1 材料
人甲狀腺癌BCPAP細胞系購自南京凱基生物科技發展有限公司,本院組織細胞生物庫凍存;DMEM及胎牛血清(美國Gibco公司);細胞培養板和Transwell板(美國Coring公司);細胞裂解緩沖液及發光底物(美國Promega公司);基質膠(美國BD公司)。人基質金屬蛋白酶-13(MMP-13)ELISA試劑盒(美國Calbiochem公司)。
1.2 反義寡脫氧核苷酸轉染
使用DMEM培養液在37℃,5%CO2的常規條件下培養人甲狀腺癌BCPAP細胞。AS-miR-155序列:5'-TCCCCTATACACGATTAGCATTAA-3';無義寡核苷酸(oligodeoxyribonucleotides,ODN)序列:5'-ATCTCATACTACACTTGAACACT-3',依據轉染試劑說明書操作,加入等體積PBS以建立空白對照組。
1.3 實時熒光定量PCR法檢測miR-155 mRNA的表達
抽提細胞總RNA并精制,反轉錄為cDNA。定量 PCR(miR-155)上游引物:5'-CGCGCTTAATGCTAATCGTGA-3';下游引物:5'-GTGCAGGGTCCGAGGT-3',長度為 62 bp。GAPDH(作為內參)上游引物:5'-CATCTTCTTTTGCGTCGCCA-3';下游引物:5'-TTAAAAGCAGCCCTGGTGACC-3',長度為115 bp。反應循環條件及計算方法參照文獻[9]進行。
1.4 劃痕法檢測癌細胞遷移能力
①先在細胞培養板背后均勻地劃橫線,大約每隔1 cm一道,橫穿過孔。②培養細胞至對數生長期,消化并計數、使用培養基配制成濃度為8×105個/mL的細胞懸液。培養板中每孔加入1 mL細胞懸液,置于37℃,5%CO2培養箱中培養直至細胞鋪滿單層;③ 用100 μL移液槍頭沿培養板底部呈“一”字形劃線;④棄去培養基,用PBS洗細胞3次,去除劃下的細胞;⑤ 細胞培養板置于37℃,5%CO2培養箱中培養24 h后拍照,計算間距。
1.5 Transwell檢測癌細胞侵襲力
參照文獻[9]的方法,使用倒置顯微鏡(×100)觀察穿過聚碳酸酯膜微孔的細胞數,在每張膜的中央及周圍部分隨機取3個視野,計數每個視野內的穿膜細胞數。
1.6 ELISA法檢測癌細胞MMP-13含量
收集各組細胞上清液,采用MMP-13 ELISA試劑盒通過夾心酶聯免疫方法測定MMP-13含量,具體步驟參照說明書。
1.7 統計學方法
2 結果
2.1 各組轉染效果的比較
AS-miR-155組轉染后,BCPAP細胞miR-155 mRNA表達水平明顯低于空白對照組和無義ODN組(P<0.05)。結果顯示,所構建的反義寡核苷酸明顯下調了BCPAP細胞中miR-155 mRNA水平(圖1)。
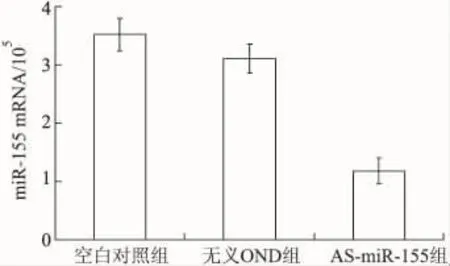
圖1 miR-155反義寡核苷酸轉染對miR-155 mRNA表達的影響
2.2 As-miR-155轉染對癌細胞遷移力的影響
劃痕試驗結果顯示,空白對照組和無義ODN組間距分別為(532±26)μm 和(518±22)μm,而轉染AS-miR-155組間距為(785±28)μm,AS-miR-155組間距明顯大于對照組和無義ODN組(F=172.461,P=0.000)。結果提示AS-miR-155組細胞遷移速度明顯變慢。
2.3 AS-miR-155轉染對癌細胞侵襲的影響
應用Transwell檢測癌細胞侵襲能力,結果顯示平均每個視野穿膜細胞數空白對照組為43.8±2.6,無義 ODN 組為43.6 ±2.2,而轉染 AS-miR-155組為18.9±1.8。AS-miR-155組穿膜細胞數明顯少于對照組和無義 ODN 組(F=598.212,P=0.000)。結果提示,下調miR-155表達后癌細胞的侵襲力受到明顯抑制。見圖2。
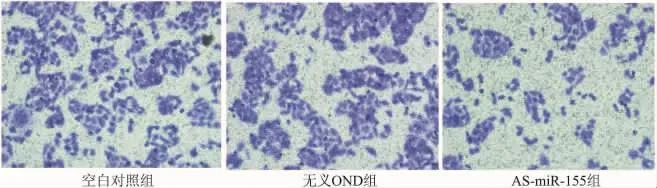
圖2 miR-155反義寡核苷酸轉染對癌細胞侵襲的影響(×100)
2.4 AS-miR-155轉染對癌細胞MMP-13水平的影響
ELISA結果顯示,空白對照組和無義ODN組MMP-13含量分別為(85.2±2.8)pg/mL和(84.8±2.5)pg/mL,而轉染 As-miR-155組 MMP-13含量為(35.6±1.5)pg/mL。AS-miR-155 組 MMP-13含量明顯小于對照組和無義ODN組(F=689.28,P=0.000)。結果提示,下調miR-155的表達可明顯抑制MMP-13的水平。
3 討論
微小RNAs是一類單鏈小分子RNA,長約20~24 nt。其特點為短序列、非編碼且具有調控力[1],其對基因表達的反向調控主要是通過與靶基因完全或不完全互補結合完成。大量研究表明,多種腫瘤的發生發展都與微小RNAs的異常表達有關[1-3]。微小RNAs的發現和應用為乳腺癌、大腸癌、甲狀腺癌、宮頸癌等惡性腫瘤的基因診斷和治療提供了一個新的靶點。
侵襲、遷移與增殖是轉移性甲狀腺癌治療失敗及預后不佳的最常見原因,也是腫瘤細胞遠處轉移的重要步驟。因此,積極尋求與甲狀腺癌遷移和侵襲能力相關的分子標志物,探討其內在發生及發展機制,對甲狀腺癌的診療水平的提高有極大幫助。研究數據已經發現,miR-155高表達與許多實體瘤如乳腺癌、大腸癌、宮頸癌、胰腺導管腺癌等[4-7]的生物學表型密切相關。但在甲狀腺癌細胞遷移、侵襲中miR-155所起作用目前尚有待進一步明確。
本研究通過反義寡核苷酸下調miR-155的表達,結果顯示miR-155表達下調后的BCPAP細胞遷移速度變慢,穿過Transwell小室聚碳酸酯膜的能力明顯下降,與空白對照組及無義ODN組比較,差異有統計學意義。
細胞外基質(extracellular matrix,ECM)成分的降解是腫瘤的浸潤與轉移的關鍵過程。研究顯示,基質金屬蛋白酶(matrix metalloproteinases,MMPs)能降解ECM。按照底物特異性,人類MMPs主要分為明膠酶、間質膠原酶、基質溶解素、基質溶解因子、基質金屬蛋白質酶及其他6類。MMPs主要功能是降解一種或多種ECM成分;調控血管形成;通過與整合素的相互活化而加強細胞間的黏附作用。MMP-13是MMPs重要成員,許多學者發現,MMP-13在許多惡性腫瘤包括甲狀腺癌細胞中高表達[10-11],且與甲狀腺癌侵襲有關[12]。本研究采用ELISA檢測發現,AS-miR-155轉染組MMP-13含量明顯低于空白對照組和無義ODN組。
本研究表明,下調miR-155表達水平,可使甲狀腺癌細胞的遷移和侵襲能力得到明顯抑制。而MMP-13被抑制是miR-155調控甲狀腺癌細胞遷移和侵襲能力的重要機制之一。因此,miR-155在人甲狀腺癌細胞遷移侵襲過程中發揮著重要作用,有望成為甲狀腺癌基因治療中頗具前景的候選靶點。
[1] Tricoli JV,Jacobson JW.MicroRNA:Potential for Cancer Detection,Diagnosis,and Prognosis[J].Cancer Res,2007,67(10):4553 -4555.
[2] Leeman MF,McKay JA,Murray GI.Matrix metalloproteinase 13 activity is associated with poor prognosis in colorectal cancer[J].J Clin Pathol,2002,55(10):758 -762.
[3] Lederle W,Hartenstein B,Meides A,et al.MMP13 as a stromal mediator in controlling persistent angiogenesis in skin carcinoma[J].Carcinogenesis,2010,31(7):1175-1184.
[4] Pellegrino L,Jacob J,Roca-Alonso L,et al.Altered expression of the miRNA processing endoribonuclease Dicer has prognostic significance in human cancers[J].Expert Rev Anticancer Ther,2013,13(1):21 -27.
[5] Faraoni I,Antonetti FR,Cardone J,et al.miR-155 gene:a typical multifunctional microRNA[J].Biochim Biophys Acta,2009,1792(6):497 -505.
[6] Tili E,Croce CM,Michaille JJ.miR-155:on the crosstalk between inflammation and cancer[J].Int Rev Immunol,2009,28(5):264 -284.
[7] Mattiske S,Suetani RJ,Neilsen PM,et al.The oncogenic role of miR-155 in breast cancer[J].Cancer Epidemiol Biomarkers Prev,2012,21(8):1236 -1243.
[8] Bakirtzi K,Hatziapostolou M,Karagiannides I,et al.Neurotensin signaling activates microRNAs-21 and-155 and Akt,promotes tumor growth in mice,and is increased in human colon tumors[J].Gastroenterology,2011,141(5):1749 -1761.
[9] Wang X,Tang S,Le SY,et al.Aberrant expression of oncogenic and tumor-suppressive microRNAs in cervical cancer is required for cancer cell growth[J].PLoS ONE,2008,3(7):e2557.
[10] Szafranska AE,Davison TS,John J,et al.MicroRNA expression alterations are linked to tumorigenesis and nonneoplastic processes in pancreatic ductal adenocarcinoma[J].Oncogene,2007,26(30):4442 -4452.
[11] Nikiforova MN,Tseng GC,Steward D,et al.MicroRNA expression profiling of thyroid tumors:biological significance and diagnostic utility[J].Clin Endocrinol Metab,2008,93(5):1600-1608.
[12] Fan Y,Zhang YL,Wu Y,et al.Inhibition of signal transducer and activator of transcription 3 expression by RNA interference suppresses invasion through inducing anoikis in human colon cancer cells[J].World J Gastroenterol,2008,14(3):428 -434.

