小鼠胚胎發育過程中N-Cadherin異常表達對大腦皮層神經元遷移的影響①
付蘇雷 楊慈清 賈陽陽 李 晗 郭志坤 林俊堂
(新鄉醫學院生命科學技術學院,新鄉453003)
高等動物的大腦皮層是一個高度組織、由多層神經細胞構成的復合體,神經發生始于胚胎期的室管膜區和室管膜下區,此處的神經干細胞增殖分化為神經前體細胞,再向外遷移逐步分化和成熟形成皮層板的各層神經元細胞。這種遷移是一個神經元由內至外的裝配過程,即inside-out的過程[1],這個發育過程受到嚴格的調控以確保建立正確的、有功能的大腦皮層。一旦皮層發育異常,特別是神經元遷移異常,就會對大腦功能產生影響,造成諸如精神分裂癥、癲癇、自閉癥等多種疾病。
神經鈣黏蛋白(Neural cadherin,N-Cadherin)最先在雞胚胎神經管中被發現,是鈣黏連蛋白家族中第一個在中樞神經系統發現的成員。有研究表明,N-Cadherin介導了細胞間黏附及信號轉導,具有識別細胞、調控組織器官形態發生等生物學功能。Tan等[2]發現神經電活動依賴的樹突形態發生需要NCadherin介導的神經元之間的相互作用,并且NCadherin依賴的神經元之間的相互接觸在新生樹突維持過程中具有特異作用。Masakazu等[3]通過條件性基因敲除小鼠證明N-Cadherin沉默后的小鼠大腦皮層沒有明顯的層狀結構,出現分層混亂的現象。本實驗利用小鼠活體子宮內電轉基因(In utero electroporation,IUE)技術,將雞源性的 N-Cadherin轉染到E15胎鼠的大腦皮層,實現異源性N-Cadherin的超表達,結合RNA干擾技術實現N-Cadherin的抑制表達,用GFP作為示蹤,采用熒光免疫組化綜合分析N-Cadherin異常表達對小鼠胚胎發育過程大腦皮層神經元遷移的影響,為研究N-Cadherin在中樞神經系統中的功能提供科學依據。
1 材料與方法
1.1 實驗材料與儀器 本實驗所用小鼠由新鄉醫學院動物中心提供;雞源pCAGGS-N-Cadherin真核表達質粒和pCAGGS-GFP(綠色熒光蛋白)質粒由Redies教授饋贈,shRNA干擾載體pGPU/GFP/Neomouse-N-Cadherin-shRNA由百奇生物科技有限公司合成構建,DAPI購自羅氏公司,Rabbit anti N-Cadherin抗體(識別雞源組織)由Redies教授饋贈;二抗為Goat anti Rabbit Cy3標記(Molecular Probes);CUY-21型多功能活體電轉化儀(日本 NEPA公司);M205FA型倒置體視熒光顯微鏡(德國 Leica公司);Nikon ECLIPSE 80i熒光顯微鏡(日本);CM1850型冷凍切片機(德國Leica公司)。
1.2 實驗方法
1.2.1 同源性比較 從Genbank數據庫中查到小鼠 N-Cadherin(NCBI No.NM_007664.4)的 CDS序列有2 721 bp,其對應的氨基酸為906個;雞N-Cadherin(NCBI No.NM_001001615.1)的 CDS序列有2 739 bp,其對應的氨基酸為912個,且與本實驗所用真核表達質粒pCAGGS-N-Cadherin中N-Cadherin序列一致。利用DNAman7.0生物軟件比較兩物種N-Cadherin的CDS序列和氨基端序列同源性。
1.2.2 小鼠子宮內電轉 將健康成年小鼠雌雄各1只于第一天晚上7點合籠,第二天早上7點檢查雌鼠是否有陰道栓,有陰道栓記為懷孕0.5天(胎鼠E0.5),第三天 7點記為懷孕 1.5天(胎鼠E1.5),以此類推。取懷孕15天的小鼠進行實驗,將孕鼠用4.3%的水合氯醛按照0.01 ml/g體重腹腔注射,注射時避免扎到胚胎;約5分鐘后小鼠被麻醉,剔除腹部中線附近被毛,然后腹部朝上固定于超凈工作臺內37℃加熱墊的手術墊單上,用75%的酒精棉球和碘酒給孕鼠腹部徹底消毒,用無菌的手術器械沿腹中線剪開一個大約2~3 cm長的小口,取出兩側子宮,并不斷在子宮上滴加37℃已加抗生素的生理鹽水,保持子宮濕潤;用顯微注射毛細玻璃針吸取準備好的質粒0.5~1 μl準確注射到胎鼠側腦室,再把電轉儀板狀電極的正負兩極分別放在胎鼠的左右腦,正極在擬轉基因一側;使用電轉儀進行電擊,電轉電壓35 V,每次電擊時間60 ms,間隔時間600 ms,電脈沖數5次,從子宮頸口胚胎向兩側計數,記錄轉染胚胎位置,每側子宮轉染1~2個胚胎,轉染完成后把子宮放回腹腔,將創口縫合并放在37℃加熱墊上,手術2~3小時后小鼠恢復清醒。小鼠存活5天后,將其處死,根據記錄位置,取出轉染胚胎,在體視熒光顯微鏡下觀察結果,電轉部位呈現綠色熒光者(GFP顏色)視為陽性。
1.2.3 取材及切片 取體視熒光顯微鏡下觀察為陽性表達的胚胎,在普通體視顯微鏡下,采用尖頭鑷子小心去除皮膚和腦骨膜,用腦小鏟從腦干向嗅球的方向完整取出整個腦組織,轉移至4℃預冷處理的PBS液漂洗2~3次,浸沒于裝有4%PFA(多聚甲醛)的EP管中,置保溫盒冰塊中搖床搖晃過夜,次日取出組織,吸干液體,轉移到18%蔗糖溶液置冰盒中搖晃過夜,待組織沉淀到管底時取出組織吸干液體,根據組織大小,用錫箔紙做好模型,用OCT包埋,注意方向,嗅球朝上腦干朝下,確定好位置,置于液氮中冷凍后放-80℃冰箱保存,切片時取出已包埋的組織,在冰凍切片機上冠狀連續切片,厚度20 μm,切片后置烤片機上,37℃烤片30分鐘以上,放-80℃冰箱保存備用。
1.2.4 熒光免疫組織化學染色 從-80℃冰箱中取出冰凍切片40℃干燥20分鐘,4%PFA中4℃固定15分鐘,用1×TBS清洗3次,每次5分鐘,在含0.1%Triton X-100的1×TBS中再孵育5分鐘。每張載玻片上加1 ml免疫組化封閉液,濕盒中孵育1小時。去除封閉液后每張載玻片加300 μl用封閉液稀釋的合適濃度Rabbit anti N-Cadherin(1∶500)一抗,4℃孵育過夜后,1×TBS清洗3次,每次5分鐘,然后每張片加300 μl用封閉液稀釋的Cy3標記的Goat anti Rabbit二抗,室溫孵育1小時后,用1×TBS清洗3次,每次5分鐘。最后滴加DAPI封片劑染色10分鐘,加蓋玻片,在熒光顯微鏡下觀察拍照。
1.3 圖像處理分析 用Photoshop CS3軟件處理圖片,可將2種染色同位疊加在一起,從而分析蛋白質的表達定位。
2 結果
2.1 雞源與鼠源N-cadherin同源性比較結果 借助DNAman7.0生物軟件對兩物種 N-Cadherin的CDS序列和各自編碼氨基端序列進行同源性比較,同源相似性分別為77.25%和85.42%,說明二者為來自不同物種的同源基因。
2.2 雞源性N-cadherin超表達對小鼠大腦皮層發育過程神經元遷移的影響 從圖(1A-C)中可以看出,在胚胎發育的E15時轉染pCAGGS-GFP后,E20時取材切片,被轉染GFP陽性表達的神經元從內向外遷移,大多數已遷移到皮層Ⅱ-Ⅳ層(圖1B),同時在Ⅴ-Ⅵ層也有部分神經元,在亞室管膜(Subventrical zone,SVZ)也存在大量GFP陽性表達的細胞。將雞源性pCAGGS-N-Cadherin表達載體與pCAGGSGFP共轉染后,從圖(1D-F)中可以看到,雞源性NCadherin在小鼠大腦皮層中能夠實現超表達(圖1D),實驗中Rabbit anti N-Cadherin單克隆抗體不能夠與鼠N-Cadherin結合,圖(1D)中紅色標記的即為雞源性N-Cadherin超表達結果,N-Cadherin實現超表達后E20時(圖1D-F)可以看出大多數神經元已經遷移到Ⅱ-Ⅳ層,與對照組相比,GFP標記的神經元在Ⅴ-Ⅵ層和SVZ區的數量較少。
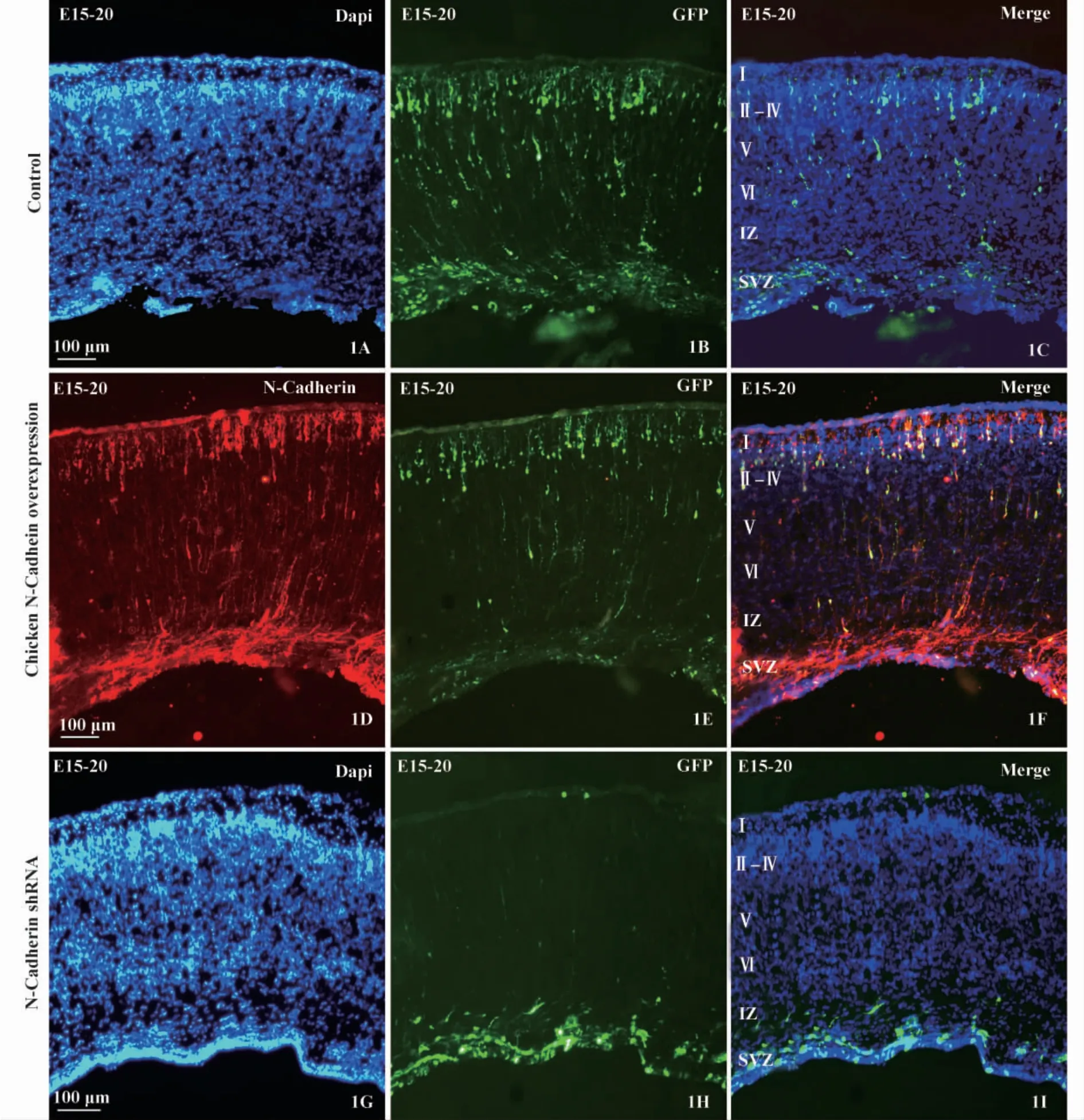
圖1 活體子宮內對胎鼠大腦皮層電轉N-Cadherin及其shRNAFig.1 N-Cadherin and its shRNA transfection into mouse embryonic cerebral cortex with in utero electroporation
2.3 N-cadherin抑制表達對小鼠大腦皮層發育過程神經元遷移的影響 針對小鼠N-Cadherin上的GCCTATGAAGGAACCACATGA靶序列設計shRNA干擾載體(pGPU/GFP/Neo-mouse-N-Cadherin-shRNA),該載體自身攜帶有GFP報告基因,但在預實驗中我們發現單獨轉染該載體所表達的GFP熒光非常微弱,很難檢測到綠色熒光,因此我們將能強表達GFP的pCAGGS-GFP質粒與其共轉,且shRNA干擾載體與 pCAGGS-GFP質粒的濃度比為8∶1,確保pCAGGS-GFP轉染的細胞同時也被shRNA干擾載體轉染。從圖(1G-I)中可以看到,將shRNA干擾載體與pCAGGS-GFP質粒共轉染后E20時,大量GFP陽性表達的細胞停留在SVZ區,很少有細胞遷移到Ⅱ-Ⅳ層,與對照組相比(圖1A-C)存在明顯差別。
3 討論
本研究中利用小鼠子宮內電轉基因技術將帶有強啟動子的真核表達載體pCAGGS-N-Cadherin和帶有干擾片段的shRNA干擾載體轉染到胎鼠的室管膜區,由此實現了對N-Cadherin的超表達和抑制表達。有研究表明對E10.5~E11.5胎鼠用放射性標記物標記室管膜的細胞,被標記的神經元最終大部分位于較深的板層中,在E12.5~E13.5標記的細胞,最終位于皮層中間的板層中,在E15.5~E16.5標記的細胞,最終位于皮層的第Ⅱ板層[4,5]。由于是對E15的胎鼠進行電轉,此時的神經元應該遷移到皮層的Ⅱ~Ⅳ層,從我們實驗的對照組中也可以看到同樣的結果;與對照組相比,N-Cadherin超表達后促進了神經元的遷移,有更多GFP標記的神經元遷移到Ⅱ~Ⅳ層;然而N-Cadherin被干擾后阻礙了神經元的遷移,被標記神經元明顯停滯在室管膜區。我們把能夠強烈表達GFP的質粒與目的質粒(濃度比為1∶8)混合共轉染,保證了目的質粒轉染的細胞同時也被GFP質粒轉染,GFP作為報告基因對觀察神經元的遷移狀況很方便,而且GFP的表達對胚胎的發育不存在影響[6]。在條件性基因敲除小鼠模型中N-Cadherin沉默小鼠大腦皮層出現了混亂狀態,完全失去了正常的層的結構,而且皮層中有絲分裂細胞的分布也出現異常,可見N-Cadherin在神經細胞遷移過程中具有非常重要的作用[3]。但是N-Cadherin不是唯一一個對大腦皮層發育和神經元遷移起作用的分子,潘樂等[7]結合RNA干擾和子宮內電轉技術研究發現DAM17對于小鼠大腦皮層發育中期神經前體細胞向外側遷移是必需的,干擾ADAM17的表達會造成神經前體細胞滯留在腦室區和腦室下區;神經元的向外遷移分為膠質細胞依賴型和非膠質細胞依賴型兩種,研究表明在非膠質細胞依賴型的神經元遷移中,Reelin調控Dap1激活Rap1,Rap1調節N-Cadherin表達,進而控制神經元的遷移和定位[8,9];Robo4在皮層神經元的放射狀遷移中具有重要的作用,上調皮層中新生神經元的Robo4表達導致新生神經元的放射狀遷移出現嚴重缺陷[10];可能還有很多沒有被發現的分子起著重要的作用,他們共同構成一個調控網絡來調控大腦皮層的發育。RNA干擾結合活體子宮內電轉基因方法與基因敲除技術相比具有明顯的優點:①局部受到干擾后的胚胎可以繼續生長發育便于長時間觀察受干擾細胞的生命活動狀況,而基因敲除小鼠的靶基因整體被沉默,對于胚胎發育過程中功能必須的基因沉默常常在胚胎發育過程導致個體的死亡,使持續觀察受限;②可以通過質粒混合共轉染的方法特異性的研究兩個及兩個以上基因的相互作用;③子宮內電轉基因技術可以實現基因的定時定位抑制表達,有利于在特定時間特定部位研究基因的功能。但是對于研究E12天以前與胚胎發育的相關分子,子宮內電轉技術也有其缺陷,因為對懷孕不到12天的小鼠進行電轉容易造成小鼠流產,很難獲得成功轉染的胚胎。總之,N-Cadherin作為一種細胞間同種黏附的鈣依賴型跨膜糖蛋白,主要分布于神經和肌肉組織,在神經元的遷移定位、突觸的形成、神經軸突的導向生長及靶向識別中起重要作用,而且在受到干擾后沒有觀察到明顯的補償機制,因此我們可以選擇N-Cadherin作為關鍵分子,結合子宮內電轉基因技術定時定位研究與其相關的上下游分子,進而研究皮層發育的調控網絡。
1 Bystron I,Blakemore C,Rakic P.Development of the human cerebral cortex:boulder committee revisited[J].Nat Rev Neurosci,2008;9(2):110-22.
2 Tan Z,Peng Y,Song H L et al.N-cadherin-dependent neuron-neuron interaction is required for the maintenance of activity-induced dendrite growth[J].Proc Natl Acad Sci USA,2010;107(21):9873-9878.
3 Masakazu M,Kadowaki S,Takeichi M et al.N-cadherin mediates cortical organization in the mouse brain[J].Dev Biol,2007;304(1):22-33.
4 Nadarajab B,Parnavelas J G.Modes of neuronal migration in the developing cerebral cortex[J].Nat Rev Neurosci,2002;3(6):423-432.
5 Kanatani S,Tabata H,Nakajima K.Neuronal migration in cortical development[J].J Child Neurol,2005;20(4):274-279.
6 楊慈清,石曉衛,林俊堂 et al.應用雞胚活體電轉GFP示蹤技術觀察脊髓左右兩側神經元纖維投射[J].中國免疫學雜志,2012;28(8):718-721.
7 潘 樂,馬執行,鄭煜芳.小鼠大腦皮層中ADAM17表達降低對神經元前體細胞向外遷移的抑制作用[J].復旦學報(自然科學版),2011;50(5):597-604.
8 Franco S J,Martinez-Garay I,Müller U et al.Reelin regulates cadherin function via Dab1/Rap1 to control neuronal migration and lamination in the neocortex[J].Neuron,2011;69(3):482-97.
9 Jossin Y,Cooper J A.Reelin,Rap1 and N-cadherin orient the migration of multipolar neurons in the developing neocortex[J].Nat Neurosci,2011;14(6):697-703.
10 Zheng W,Geng A Q,Yuan X B et al.Robo4 regulates the radial migration of newborn neurons in developing neocortex[J].Cereb Cortex,2012;22(11):2587-601.