體外重組CaV1.2不同蛋白片段純化及其與CaM相互作用的研究
何桂林,邵冬雪,印丹丹,胡慧媛,郭鳳,王紅梅,郝麗英
(1.中國醫科大學藥學院藥物毒理教研室,沈陽 110001;2.江西省人民醫院藥劑科,南昌 320006)
細胞外鈣內流在肌肉收縮、腺體分泌、細胞運動以及遞質釋放等生理過程中起著非常重要的作用[1,2]。心肌細胞中,細胞外鈣內流主要通過 L-型鈣通道。L-型鈣通道C末端的多個序列、N末端以及Ⅰ-Ⅱ片段可與多種調節因子相互作用而調節通道活性[2~4],其中C末端的CT1序列是與CaM、CaMKⅡ、Calpastatin等多種調節因子相互作用的共同序列[5~7]。CaM是一種廣泛存在于生物體的鈣結合蛋白,是細胞內鈣的重要受體,參與細胞中多種酶和生理過程的調節[8],與Ca2+形成Ca2+/CaM復合物而發揮生理學功能[9]。鈣通道蛋白分離純化方法較多[4,10,11],但 CaV1.2 鈣通道蛋白中的 CT1 片段因難溶于水而較難純化[12]。本研究改進完善了CaV1.2鈣通道C末端CT1、CT2和CT3的分離純化,并利用GST pull-down assay實驗技術探討了CT1、CT2和CT3與CaM及突變體的結合。
1 材料與方法
1.1 材料
pGEX-6p-3/CaM、pGEX-6p-3/CaM12 (E31A+E67A)、pGEX-6p-3/CaM34 (S101F+E140A)、pGEX-6p-3/CaM1234(E31A+E67A+S101F+E140A)質粒均由日本鹿兒島大學Kameyama教授惠贈;pGEX-6p-3/CT1、pGEX-6p-3/CT2和pGEX-6p-3/CT3由生工生物工程(上海)有限公司制作;異丙基硫代-β-D半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)、溶菌酶、AMP均購自Sigma公司;PreScission Protease 與 Glutathione-Sepharose 4B beads(GS-4B beads)購自GE Healthcare公司。其他試劑均購自BIOSHARP公司。
1.2 方法
1.2.1 重組菌株培養及 GST-CT1、GST-CT2、GSTCT3表達:將CaV1.2 C-末端的3個融合蛋白(CT1,a.a.1509-1789;CT2,a.a.1778-2003;CT3,a.a.1942-2169,圖1)相對應的重組質粒轉化入BL21(DE3)中,挑取單克隆菌落于5 mL LB/Amp+培養液中,37°C振搖培養至對數生長期(A595=0.6~1.0),保留菌種[13]。取適量菌種加入裝有400 mL LB(含AMP 50 μg/mL)培養液的錐形瓶中,37 °C、120 r/min 震搖培養12~16 h。當A595值在0.6~1.0之間時,加入IPTG 至 1 mmol/L,37 °C、120 r/min 震搖培養 4 h,誘導融合蛋白表達。
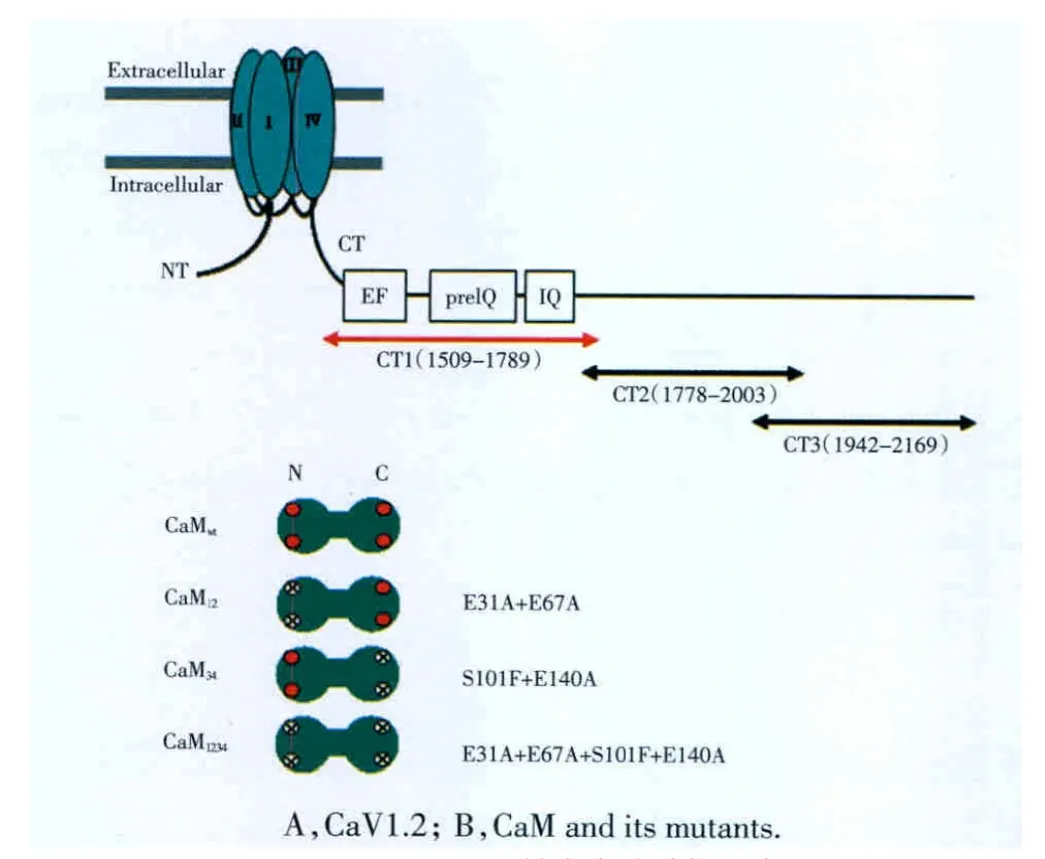
圖1 CaV1.2、CaM及其突變體結構示意圖Fig.1 Schematic diagram of fragment peptides of CaV1.2,CaMand its mutants
1.2.2 CT1、CT2、CT3的提取與純化:所有操作均在冰上進行,所有離心均為4°C離心。菌液離心(6 000 r/min,10 min),棄上清,用含 1.5%N-lauroylsarcosine sodium salt(Sigma公司)PBS重懸沉淀菌體,冰浴30 min;超聲打破細菌,超聲3 s停 3 s,200 W,20 min;加入 Triton X-100 至1%,冰浴 30 min;16 000 r/min離心 10 min,將上清轉移至2個15 mL離心管中,每個離心管中加有500 μL GS-4B beads(預先各管每次用5 mL PBS洗2次),置旋轉混合器充分混合4 h(10 r/min)。600 r/min離心3 min,棄上清。各管加入5 mL PBS,600 r/min離心3 min,棄上清,洗3~5次。每個管中加入1 000 μL Tris buffer(50 mmol/L Tris pH 8.0,150 mmol/L NaCl),4°C保存。參照Bradford蛋白濃度測定試劑盒方法測定純化后的GST-CT1、GST-CT2和GSTCT3的濃度,使其濃度約為0.04 g/L。
1.2.3 CT1、CT2、CT3蛋白鑒定:取連接于beads上的 CT1(CT2 或 CT3)50 μL,600 r/min,3 min,棄上清。加入10 μL 5×SDS洗脫連于beads上的目的蛋白,100°C 煮 10 min,離心,上清行 15%SDS-PAGE電泳,檢測 CT1、CT2、CT3 蛋白。
1.2.4 CaM、CaM12、CaM34和 CaM1234分離純化:CaM12是CaM的N-lobe 2個鈣結合位點發生突變,失去與鈣離子結合能力;CaM34是CaM的C-lobe 2個鈣結合位點發生突變;CaM1234是CaM兩端的鈣結合位點均發生突變(圖1)。CaM及突變體蛋白的分離純化參照文獻[13]。
1.2.5 GST pull-down assay 分別觀察 CT1、CT2、CT3與CaM及突變體的相互作用:取連接于beads上的CT1(CT2或 CT3)50 μL于 1.5 mL EP管中,加入CaM (終濃度分別為0.1、0.35、0.7、1.4、2.1、3.5 μmol/L)、CaCl220 μL ([Ca2+]2 mmol/L)、Tris buffer至1 mL。將1.5 mL EP放于旋轉混合器上,10 r/min,4 °C,4 h。600 r/min,3 min,棄上清。加入 1 mL Tris buffer輕輕混勻,600 r/min,3 min,棄上清(輕洗2遍)。加入 15 μL 5×SDS洗脫。600 r/min,3 min,上清用15%SDS-PAGE電泳確認。SDS-PAGE膠上的蛋白帶通過考馬斯亮藍染色顯示,并采用Photoshop軟件進行定量分析。
1.2.6 數據分析:總量[CaMs]—結合[CaMs]的關系曲線用SigmaPlot 10.0軟件中的Hill公式進行擬合,其擬合公式如下
其中Bmax為最大結合量,X為游離配體濃度,Kd為表觀分離常數。本實驗中的游離CaM濃度接近于CaM總濃度,所以X即為CaM總濃度。
2 結果
2.1 GST-CT1、GST-CT2、GST-CT3 與 CaM 的相互結合作用結果
CaV1.2 C-末端的3個融合蛋白片段:GST-CT1、GST-CT2和GST-CT3,其中GST-CT1包含了 EF-hand,preIQ和IQ序列(圖1)。結果表明:成功純化得到 GST-CT1、GST-CT2和 GST-CT3;在 2 mmol/L[Ca2+],CaM幾乎不與空白GS-4B或GST結合;純化的3個CaV1.2 C-末端的3個融合蛋白片段,只有GST-CT1可與CaM穩定結合(圖2);作為對照,CaM幾乎不與空白GS-4B或GST結合,表明CaM可特異性地與GST-CT1結合(圖2)。

圖2 純化后GST-CT1、GST-CT2、GST-CT3與CaM的相互結合作用Fig.2 SDS-PAGE of purified GST-CT1,GST-CT2,GST-CT3which interacted with CaM
2.2 CaM與GST-CT1結合的濃度依賴性
如圖3所示:在2 mmol/L[Ca2+]條件下,隨著反應體系中的CaM濃度增加,結合到GST-CT1上的CaM量也逐漸增加,呈濃度依賴性,在此劑量范圍內,其濃度—結合量的擬合曲線為“S”型。

圖3 CaM與GST-CT1結合的濃度依賴性Fig.3 Concentration-dependent binding of CaM to CT1
2.3 GST-CT1與CaM突變體結合的濃度依賴性
CaM與Ca2+形成Ca2+/CaM復合物之后才能與CaV1.2上的CaM結合位點結合發揮生理作用,突變后的CaM很難與之結合[9,14]。CaM的N-lobe和C-lobe在調節通道活性上具有不同的作用[3,15]。因此,本實驗還研究了在2 mmol/L[Ca2+]條件下CaM 3種突變體與GST-CT1的結合。結果表明:CaM12、CaM34、CaM1234均可與GST-CT1結合,且隨著反應體系中CaM突變體濃度的增加,結合到GST-CT1上的量也逐漸增加(圖4),濃度—結合量的擬合曲線為“S”型。在 2 mmol/L[Ca2+]條件下,CaM 3 種突變體可以與GST-CT1結合,并具有濃度依賴性,但是在同一濃度,它們結合到CT1的量明顯低于野生型CaM結合到CT1的量。
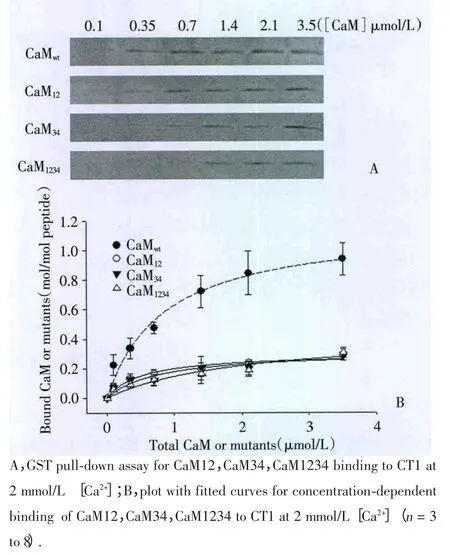
圖4 CaM突變體與GST-CT1結合的濃度依賴性Fig.4 Concentration-dependent binding of CaM mutants to CT1
3 討論
細胞內鈣在生物信息傳遞和內環境穩定中起重要作用。細胞外鈣內流主要通過鈣通道,鈣通道主要包括電壓依賴性鈣通道(voltage-dependent calcium channel,VDCC)和受體操控鈣通道(receptor-operated channel,ROC)。VDCC 根據通道電導、對電壓敏感性及對不同阻斷劑反應的不同,又進一步分為L、N、T、P、Q和R型,其中L型鈣通道是目前最具藥理學意義的一類鈣通道,其激活電位為-10~+10 mV,通道被激活后持續時間長,失活慢。L-型鈣通道廣泛存在于各種細胞中,尤其是心肌和血管平滑肌細胞,功能上與興奮—收縮耦聯、興奮—分泌耦聯有密切關系。在蛋白家族分類上,根據鈣通道α1亞基氨基酸序列的不同,鈣通道分為CaV1-3的3個亞家族:其中CaV1.x中的CaV1.1,CaV1.2和CaV1.3均介導L-型鈣通道電流,CaV2.x中的CaV2.1、CaV2.2和CaV2.3分別介導 P/Q型、N型和 R型,而CaV3.x介導T型鈣電流。
CaM是一種廣泛存在于生物體的鈣結合蛋白,它是細胞內鈣的重要受體,參與動植物細胞中多種酶和生理過程的調節。CaM是調節L-型鈣通道活性過程中的鈣感受器[3,9],且鈣通道C末端A、C或CB、IQ區域、N末端以及Ⅰ-Ⅱ環等區域均可以與CaM結合,從而調節CDF和CDI,其中α1c亞基C末端的IQ基序是最受公認的CaM結合位點。
GST pull-down assay是研究蛋白之間相互作用的重要實驗方法。其基本原理是將靶蛋白—GST融合蛋白親和固化在谷胱甘肽親和樹脂上,作為與目的蛋白親和的支持物,充當一種“誘餌蛋白”,目的蛋白溶液過柱,誘餌蛋白可從中捕獲與之相互作用的“捕獲蛋白(目的蛋白)”,洗脫結合物后通過SDSPAGE電泳分析,從而證實2種蛋白間的相互作用或篩選相應的目的蛋白。“誘餌蛋白”和“捕獲蛋白”均可通過細胞裂解物、純化的蛋白、表達系統以及體外轉錄翻譯系統等方法獲得。
本研究采用GST pull-down assay實驗方法,將CaV1.2的C末端分成CT1(包含EF-hand、CB、IQ基序)、CT2、CT3 3個片段作為“誘餌蛋白”,其中 CT2、CT3作為對照,分別研究其與“捕獲蛋白”CaM之間的相互作用。本研究結果證明在大腸桿菌中表達的融合蛋白經GS-4B純化后的CT1蛋白純度及濃度均較好;純化后CT1可穩定與Ca2+/CaM結合,表明此方法純化后的蛋白具有生物學活性;CaM可特異性地與CT1結合,且結合呈濃度依賴性;CaM的3種突變體也可與GST-CT1結合,并具有濃度依賴性。綜上所述,本研究成功純化了CaV1.2蛋白片段并順利完成GST pull-down assay實驗,為深入研究蛋白相互作用或發現新的蛋白相互作用奠定基礎。
[1]Berridge MJ.Elementary and global aspects of calcium signalling[J].J Physiol,1997,499(Pt 2):291-306.
[2]Peterson BZ,DeMaria CD,Adelman JP,et al.Calmodulin is the Ca2+sensor for Ca2+-dependent inactivation of L-type calcium channels[J].Neuron,1999,22(3):549-558.
[3]Dick IE,Tadross MR,Liang H,et al.A modular switch for spatial Ca2+selectivity in the calmodulin regulation of CaV channels[J].Nature,2008,451(7180):830-834.
[4]Asmara H,Minobe E,Saud ZA,et al.Interactions of calmodulin with the multiple binding sites of CaV1.2 Ca2+channels[J].J Pharmacol Sci,2010,112(4):397-404.
[5]Halling DB,Aracena-Parks P,Hamilton SL.Regulation of voltagegated Ca2+channels by calmodulin [J].Sci STKE,2005,315(er1):1-10.
[6]Pitt GS.Calmodulin and CaMKII as molecular switches for cardiac ion channels[J].Cardiovasc Res,2007,73(4):641-647.
[7]Saud ZA,Minobe E,Wang WY,et al.Calpastatin binds to a calmodulin-binding site of cardiac CaV1.2 Ca2+channels[J].Biochem Biophys Res Commun,2007,364(2):372-377.
[8]Zhang M,Yuan T.Molecular mechanisms of calmodulin′s functional versatility[J].Biochem Cell Biol,1998,76(2-3):313-323.
[9]LeeA,Zhou H,Scheuer T,et al.Molecular determinants of Ca2+/calmodulin-dependent regulation of CaV2.1 channels[J].Proc Natl Acad Sci USA,2003,100(26):16059-16064.
[10]Frangioni JV,Neel BG.Solubilization and purification of enzymatically active glutathione S-transferase (pGEX)fusion proteins[J].Anal Biochem,1993,210(1):179-187.
[11]Wang WY,Hao LY,Minobe E,et al.CaMKII phosphorylates a threonine residue in the C-terminal tail of CaV1.2 Ca2+channel and modulates the interaction of the channel with calmodulin [J].J Physiol Sci,2009,59(4):283-290.
[12]Kim J,Ghosh S,Nunziato DA,et al.Identification of the components controlling inactivation of voltage-gated Ca2+channels[J].Neuron,2004,41(5):745-754.
[13]何桂林,郭風,封瑞,等.重組鈣調蛋白及其突變體的分離純化及活性鑒定[J].中國生化藥物,2012,33(6):743-746.
[14]Zühlke RD,Pitt GS,Deisseroth K,et al.Calmodulin supports both inactivation and facilitation of L-type calcium channels[J].Nature,1999,399(6732):159-162.
[15]Guo F,Minobe E,Yazawa K,et al.Both N-and C-lobes of calmodulin are required for Ca2+-dependent regulations of CaV1.2 Ca2+channels[J].Biochem Biophys Res Commun,2010,391(2):1170-1176.

