《原電池》教學案例設計(人教版選修4第四章第一節)
溫東平
一、教材學情分析
1.教材分析:化學能可以直接轉化為熱能、光能等。化學能和電能的轉化則必須通過一定的裝置。研究化學能和電能相互轉化的裝置、過程和效率的科學叫電化學,其應用很廣泛,如電解、電鍍、電冶金、電池的制造等,本節內容有利于學生了解電化學反應所遵循的規律,知道電化學知識在生產生活、科學研究中的作用,同時一些有趣的實驗和科學探究活動,有利于激發學習興趣和樹立研究化學的志向。
必修2在學習《金屬的化學性質》和《化學反應與能量變化》等的基礎上已經學習了Zn—Cu稀H2SO4組成的簡單原電池,初步了解了原電池原理,本節進一步介紹帶有“鹽橋”的復雜的原電池的組成和工作原理。通過對原電池中閉合電路形成過程的分析,引出半電池、鹽橋、內電路、外電路等概念,從而進一步提高對原電池構成和工作原理的認識、應用。
內容結構上具有上承氧化還原反應,下啟電化學腐蝕和防護、化學電源、電解電鍍等并與能量轉化,元素化合物以及電解質溶液相互聯系,形成了一個系統的知識網絡。是培養學生創造性思維的好教材。
2.學情分析:
知識方面:已經在《金屬的化學性質》和《化學反應與能量變化》的基礎上學習了Zn—Cu稀H2SO4組成的簡單原電池,初步了解了原電池原理、正(負)電極、電解質溶液的選擇以及電極反應產物的判斷。
能力方面:具備了一定的實驗觀察、思維和自學能力,但分析推理和抽象思維能力有待提高。
二、教學目標
Ⅰ.知識目標
(1)判斷形成原電池的條件,明確原電池的工作原理。
(2)了解設計原電池,選用正、負電極的原則,電解質溶液的選擇及電極反應產物的判斷。
Ⅱ.能力目標
(1)培養學生探究精神和從實驗中得出結論的科學方法。
(2)培養學生由實踐到理論,再由理論指導實踐的科學方法。
(3)培養觀察能力和實驗設計能力
Ⅲ 德育目標:樹立正確的能源觀,增強環境保護意識等。
三、教學重點、難點
重點:
1.原電池的形成條件,原電池的工作原理(包括帶鹽橋的原電池)
2.能夠寫出電極反應式和電池反應方程式。
教學難點:原電池的原理及其應用(包括帶鹽橋的原電池)。
四、教學方法
實驗探究、啟發發現、討論法。
五、教學用品
大燒杯、電流表、銅片、鋅片、導線、稀H2SO4、蘋果、酒精溶液、鹽橋。
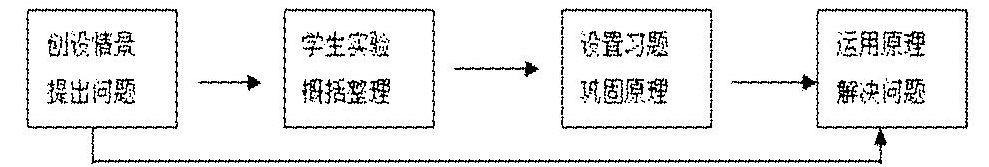
六、教學過程
1.創設情提出問題:從原電池在生活中的應用入手變學生的被動為主動突出學生的主體地位將演示實驗設計成學生分組實驗并設疑為:
2.學生實驗
實驗一:將銅片插入稀硫酸溶液中
實驗二:將鋅片插入稀硫酸溶液中
實驗三:將銅片和鋅片同時插入稀硫酸溶液中,但不接觸
[設疑]為什么上述實驗都是鋅片上產生氣泡但銅片上沒有,寫出離子方程式?
實驗四:將銅片和鋅片同時插入稀硫酸溶液中,并用導線連接(有氣泡產生)
實驗五:用干電池證明實驗四中的正負極
[設疑]①是什么氣體?②Cu片上產生H2,是否說明銅片能失去電子?
[提出假設一]銅片若失去電子,應觀察到什么現象?
[啟發學生思考]銅片若失去電子,應看到溶液成藍色而實驗無此現象,說明H+得到的電子不是銅失去的!
③H+得到的電子哪來的?④鋅失去的電子如何傳遞到銅片上?沿導線呢還是從溶液中?怎樣來證明?
[提出假設二]若電子從溶液中傳遞到銅片上的,那么在傳遞過程中H+就能獲得電子產生H+,而實驗中卻看到的是在銅片表面上看到氣泡。電子若沿導線傳遞則可以用電流表來測定,引出實驗六
實驗六:將銅片和鋅片同時插入稀硫酸溶液中,并用導線連接且在導線之間連接一電流表
[設疑]若將上述裝置中的稀硫酸溶液換成酒精溶液,電流表指針還會偏轉嗎?
[學生描述實驗現象并概括整理]
現象:______,結論:______。
[教師小結](1)原電池的定義
(2)原電池的構成條件
[教師設疑]根據原電池構成條件判斷:將鋅片和銅片分別通過導線與電流計連接,并使鋅片和銅片直接接觸,然后浸入盛有硫酸銅溶液的燒杯中,電流表指針會偏轉嗎?
【實驗7—1】將鋅片和銅片分別通過導線與電流計連接,并使鋅片和銅片直接接觸,然后浸入盛有硫酸銅溶液的燒杯中
現象:銅片表面明顯有銅析出,電流計指示無電流通過。
[問題與思考]上述實驗裝置構成了原電池嗎?如果沒有發生原電池反應,銅片表面為什么明顯有紅色的銅析出,并且鋅片逐漸溶解?如果實驗裝置就是原電池,為什么電流計的指針又不動,表現出元電流產生?(實驗中可單獨置—銅片于該CusO4溶液中,以作對比,說明銅不與硫酸銅溶液反應。)
[設想]如果要證明上述裝置就是原電池,確實實現了化學能與電能之間的轉換,就必須證明鋅片與銅片之間確實有電流通過,如何證明?
【實驗7—2】將鋅片和銅片分別通過導線與電流計連接,并使鋅片和銅片不直接接觸,再同時浸入盛有CuSO4溶液的燒杯中。
現象:電流計指針發生偏移,并指示電子是由鋅片流向銅片,在銅片表面有紅色的銅析出。
結論:發生了原電池反應,可以肯定【實驗7—1】中的裝置構成了原電池。并且,其中鋅為原電池的負極,銅為正極。
現象:隨著上述實驗時間的延續,電流計指針偏轉的角度逐漸減小,最終又沒有電流通過。同時鋅片表面逐漸被銅全部覆蓋。
[分析]:由于鋅片與CusO4溶液直接接觸,在反應一段時間后,難以避免溶液中有Cu2+在鋅片表面被直接還原,一旦有少量銅在鋅片表面析出,即在負極(鋅)表面也構成了原電池,進一步加速銅在負極表面析出,致使向外輸出的電流強度減弱(相當于短路了)。當鋅片表面完全被銅覆蓋后,反應終止了,也就無電流再產生。
[教師講述]:如果我們把氧化反應和還原反應分開在不同的兩區域進行再以適當方式連接起來就可以獲得較穩定的電流。為了解決這個問題我們用鹽橋來連接。
[演示實驗]教材P71實驗4—1提出半電池,電極等概念,分析帶鹽橋原電池的工作原理
描述現象:
解釋原因:
[教師小結]
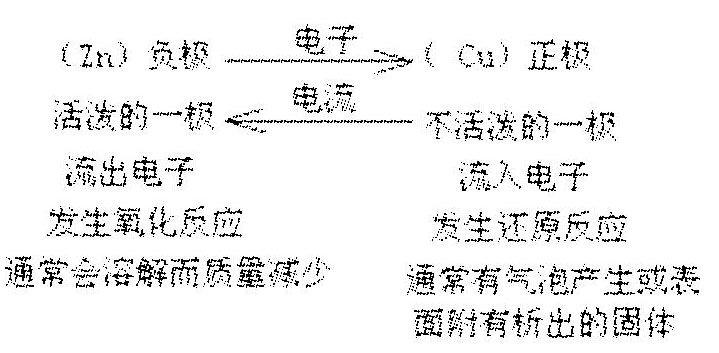
(3)原電池工作原理
(4)電極名稱:
(5)電極方程式以及電池總反應方程式書寫
3.為了進一步加強對知識的理解和應用設置幾組課堂練習如下
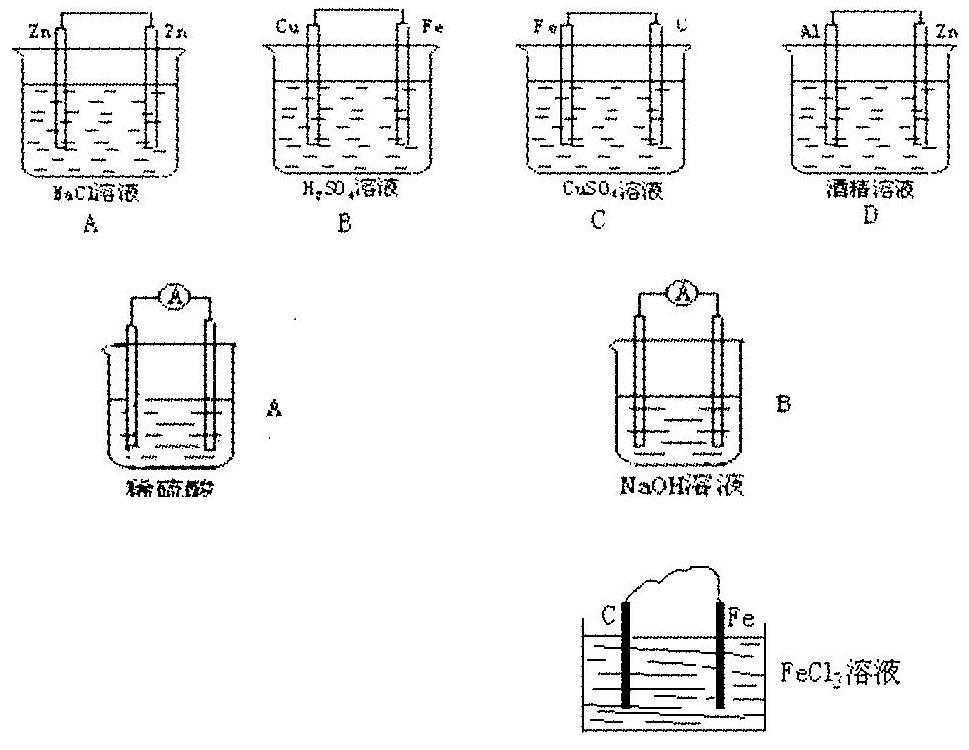
[思考題]投影:下列裝置能形成原電池的是:
答案:B、C
[課堂練習]教材P73
T1、T3、T4、T5
[課堂練習](拔高題)已知Al、Mg在不同電解質溶液中分別構成下面原電池A和B
(1)指出各原電池中負極材料并寫出相應的電極反應方程式____________
(2)從構成原電池的組成看,判斷電極的正負除了考慮金屬活潑性還要考慮什么?
4.運用原理解決問題
4.1 簡單原電池的設計
(1)將反應:2FeCl3+Fe一3FeCl2設計成原電池(右圖)。
(2)判斷正負極并寫出電極反應。
負極(鐵):Fe—2e—=Fe2+
正極(石墨):2Fe3++2e—=3Fe2+
4.2
[練習]教材P73T2
5.作業(1)教材P73T6
板書設計
一、原電池原理
1.定義:原電池是將化學能轉變為電能的裝置
2.構成要素
(a)電極①較活潑的金屬作負極;②較不活潑的金屬或非金屬作正極。
(b)電解質溶液
(c)閉合回路
(d)能自發進行的氧化還原反應
說明:四個要素相互聯系,不能孤立片面的理解。
3.原電池原理:(教材P71頁實驗4—1為例)
(1)電極反應:正極(Zn)Zn—2e-=Zn2+
負極(Cu)Cu+2e-=Cu2+
(2)電池總反應:Zn+Cu2+=Cu+Zn2+
(3)微粒流向:外電路:電子:負極→導線→正極
內電路:離子:陽離子向正極移動,陰離子向負極移動
4.簡單原電池的設計(以教材P73T2為例)
(1)根據電池反應寫出電極反應式
(2)電極材料的選擇:電極必須能導電。一般負極必須能與電解質溶液反應,容易失去電子,多為較活潑金屬。正極負極間要產生電勢差,所以必須和負極不同。
(3)電解質溶液的選擇:一般要能與負極反應。但若是兩個半反應分別在兩個燒杯中進行,則負極中的電解質溶液中應有與電極材料相同的陽離子。
(4)形成閉合回路。
教學反思:本節課主要采用實驗探究的形式,通過層層設問,充分發揮教師主導、學生主體的作用,結合實驗提出假設,驗證假設,突破教學重點難點,有利于科學訓練思維方法和態度。然后運用由具體到抽象,特殊到一般引導學生從能量變化和氧化一還原反應兩個方面概括原電池的基本構成條件和工作原理。使學生實現認識上的質的飛躍。

