大黃素對大鼠腎間質纖維化干預作用的實驗研究
魏建波 劉 琴 鐘 瑜 姜 凱 浙江省立同德醫院 杭州 310012
腎間質纖維化是腎臟疾病慢性進展直至發生終末期腎病的重要因素[1],臨床有應用大黃或以大黃為主藥治療腎間質纖維化疾病[2-3],并且取得較好療效。筆者觀察大黃提取物大黃素對大鼠腎間質纖維化防治的干預作用,并探討其作用機制。
1 材料與方法
1.1 動 物 Wistar雄性大鼠60只,體質量(180±20)g,清潔級,浙江省中醫藥研究院動物實驗中心提供,動物許可證號:SCXK(浙2008-0033)。
1.2 藥物和主要試劑 大黃素,成都茂辰生物科技有限公司生產;I型膠原(C-I)、Ⅲ前膠原肽(PⅢP)、透明質酸(HA)ELISA檢測試劑盒購自上海瑞奇生物科技有限公司;Trizol試劑盒,購自Invitrogen公司;RT-PCR試劑盒,購自寶生物工程(大連)有限公司;PCR引物由上海生工生物工程技術服務有限公司合成。
1.3 主要儀器 低溫高速離心機為美國Beckman Coulter;PCR擴增儀為美國ABI公司產品;凝膠電泳儀為美國伯樂公司產品。
2 方法
2.1 大鼠造模與給藥 常規飼養大鼠1周后,將60只大鼠隨機分為假手術對照組、模型組及大黃素小、中、大劑量組各12只。將大鼠用10%水合氯醛腹腔注射麻醉后,仰臥位固定于手術臺上,進行氣管插管。除假手術組外,其余各組大鼠結扎左側輸尿管近腎盂段制備腎間質纖維化模型,假手術對照組行手術但不結扎。次日大黃素各組分別給予大黃素25、50和80mg/kg腹腔注射給藥,1周3次,共4周。假手術對照組、模型對照組用等量生理鹽水代替。
各組動物于造模后28天后,眼球取血后處死。大鼠血離心后,取血清-20℃保存備用;左側腎臟行原位灌流去除血細胞后,腎組織液氮中凍存備用。
2.2 觀察指標 ①各組大鼠生存狀況并記錄生存曲線。②血清 C-I、PⅢP、HA含量檢測:采用ELISA方法檢測血清中C-I、PⅢP、HA含量。③RT-PCR檢測大鼠腎組織TGF-βmRNA的表達:采用Trizol一步法示提取組織總RNA。按逆轉錄試劑盒方法進行RT-PCR,mRNA定量采用半定量的RT-PCR法。引物序列如下:TGF-β 上游:5’-gaagtggatccacgagcccaag-3’,下游:5’-gctgcacttgcaggagcgcac-3’,內參照GAPDH 上游:5’-tggaatcctgtggcatccatgaaac-3’,下游:5'-acgcagctcagtaacagtccg-3’。PCR反應擴增條件為:94℃,30sec;54℃,40sec;72℃,1min;30個循環。PCR產物于2%瓊脂糖凝膠電泳,用凝膠成像系統對PCR產物進行定量分析,以對GAPDH相對值記錄結果。
2.3 統計學方法 應用SPSS12.0統計軟件,數據以(±s)表示,組間比較采用單因素方差分析,兩兩比較用q檢驗,P<0.05為差異有統計學意義。
3 結果
3.1 生存曲線 記錄各組大鼠實驗開始至第28天的生存狀況。對照組大鼠第28天時存活10只,模型組大鼠第28天僅存活4只,大黃素小劑量組、中劑量組、大劑量組大鼠到第28天時分別存活6只、7只和8只,較模型組有明顯升高。見圖1。
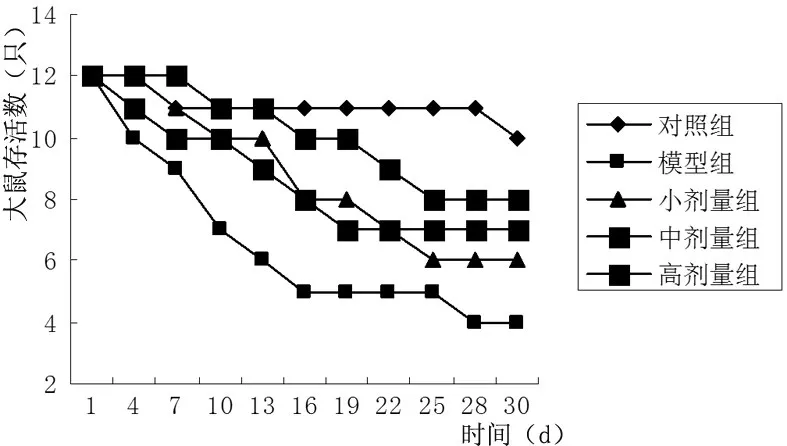
圖1 各組大鼠生存曲線
3.2 大黃素對腎間質纖維化大鼠血清C-I、PⅢP、HA含量影響 與對照組比較,模型組大鼠血清C-I、PⅢP、HA含量顯著升高(P均<0.01);與模型組比較,大黃素各組血清C-I、PⅢP、HA含量顯著降低(P<0.05,P<0.01),見表1。
3.3 大黃素對腎間質纖維化大鼠腎組織TGF-βmRNA表達的影響 腎組織TGF-βmRNA RT-PCR瓊脂糖凝膠電泳結果見圖2。將電泳條帶進行凝膠成像比較分析,見圖3,模型組腎組織TGF-βmRNA表達高于對照組,差異有統計學意義(P<0.01)。大黃素各劑量組TGF-βmRNA表達與模型組比較顯著下降(P<0.05,P<0.01)。
表1 各組大鼠血清中C-I、PⅢP、HA含量比較(±s) μg/L

表1 各組大鼠血清中C-I、PⅢP、HA含量比較(±s) μg/L
注:與對照組比較,△P<0.01;與模型組比較,*P<0.05,**P<0.01
n/只C-I PⅢP HA 組 別
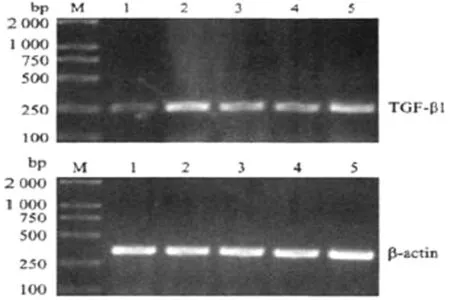
圖2 腎組織TGF-βmRNA RT-PCR凝膠電泳圖

圖3 大黃素對腎間質纖維化大鼠腎組織TGF-βmRNA表達的影響
4 討論
大黃素是從大黃生藥中分離提純的有效成分之一,具有抑菌消炎、抗氧化,以及抗腫瘤、調節胃腸活動、抗肝腎纖維化等多種藥理作用[4-6]。本實驗采用單側輸尿管梗阻法制備腎間質纖維化模型[7]。腎間質纖維化是腎間質細胞增生,腎間質膠原過度沉積,最終導致纖維化的過程。
I型膠原(C-I)、Ⅲ前膠原肽(PⅢP)、透明質酸(HA)是觀察纖維化過程的重要指標。實驗結果顯示,與模型組相比,大黃素能明顯降低大鼠血清HA、C-I和PⅢP水平,說明大黃素有較好的抑制細胞外基質合成,促進其降解,減輕腎纖維化作用。大黃素給藥組大鼠最終生存數量明顯多于模型組,提示大黃素可能具有治療腎纖維化的作用。
轉化生長因子(TGF-β)是公認的促纖維化發生、發展的關鍵因子之一,在腎間質纖維化的進程中起重要作用[8]。本實驗發現模型組大鼠腎組織TGF-βmRNA表達水平明顯高于對照組,經大黃素干預治療后,TGF-β表達顯著降低,提示降低TGF-β的表達量可能是大黃素抗腎間質纖維化的作用機制之一。
[1]EddyAA.Molecularbasisofrenal fibrosis[J].PediatrNephrol,2000,15:290-301.
[2]劉明,何學紅,李林,等.大黃在慢性腎功衰竭不同階段的應用[J].中醫藥學刊,2006,24(1):45-46.
[3]周媧,涂為平,楊麗平,等.大黃對非尿毒癥慢性腎衰竭患者微炎癥狀態的影響[J].南昌大學學報(醫學版),2012,52(5):62-66.
[4]嚴澤軍,程躍,蔣軍輝,等.大黃素通過非Caspase依賴通路誘導膀胱癌細胞BIU87凋亡的機制[J].中華泌尿外科雜志,2012,33(4):259-263.
[5]張文生,李鋒,鮑軍強.大黃素對LoVo細胞水通道蛋白2表達的調節效應[J].中草藥,2008,39(5):718-723.
[6]BhadaufiaM ,Shrivastava S,Nirala SK,etaL.Emodin reverses CCL4 induced hepatic cytochrome P450(CYP)enzymatic and ultrastructural changes:The in vivo evidence[J]HepatolRes,2009,39(11):290-300.
[7]張志新,何立群.腎小管間質纖維化動物模型的研究進展[J].時珍國醫國藥,2010,21(4):969-971.
[8]DoiS,Zou Y,Togao O,etaL.Klotho inhibits transferming growth factor-beta1(TGF-betal)signalingand suppresses renal fibrosisand cancermatastasis inmice[J].JBiolChem,2011,286:8655-8665.

