蠟狀芽孢桿菌磷脂酶C基因在大腸桿菌中的異源表達
劉菲菲,張 梁,*,顧正華,丁重陽,石貴陽
(1.糧食發(fā)酵工藝與技術國家工程實驗室,江蘇 無錫 214122;2.工業(yè)生物技術教育部重點實驗室,江蘇 無錫 214122)
磷脂酶C(phospholipase C,PLC,EC3.1.4.3),是一種水解甘油磷脂C3位點磷酯酰鍵生成甘油二酯和磷酸膽堿、磷酸肌醇、磷酸乙醇胺等的脂類水解酶[1]。根據(jù)作用底物特異性可以分為磷脂酰膽堿特異性磷脂酶C(PC-PLC)、磷脂酰肌醇特異性磷脂酶C(PI-PLC)和鞘磷脂特異性的鞘磷脂酶(SMase),其中磷脂酰膽堿特異性磷脂酶C除了具有磷脂酰膽堿活性外,還具有磷脂酰乙醇胺(PE)、磷脂酰絲氨酸(PS)活性。磷脂酶C水解產(chǎn)物甘油二酯是一種生理活性物質(zhì),在細胞信號傳導途徑上起著第二信使的作用,能激活蛋白激酶C(PKC)而引起細胞增殖、分化、收縮、分泌和代謝等功能變化[2-3],此外還具有明顯的抗血小板黏附、聚集等功能,對抗血小板新型藥物及抗靜脈血栓醫(yī)療方面的研究[4-6]意義重大。隨著對磷脂酶C研究的深入及工業(yè)發(fā)展的需求,磷脂酶C的應用價值逐漸被挖掘開發(fā),已經(jīng)逐漸從藥品生產(chǎn)延伸至油脂精煉[1]、食品加工、磷脂改性等領域[7-8]。例如植物油行業(yè),粗制植物油中含有的磷脂、痕量金屬等造成其色澤或口味變差,利用磷脂酶A(PLA)和磷脂酶C的混合物進行酶法脫膠[9]或者說是酶催化精煉,可以完全除去磷脂,比水、酸或苛性堿脫膠具有更好的油產(chǎn)率和經(jīng)濟效益;食品工業(yè)中磷脂酶C可用來改善面包的冷凍保存,生面團烤制時在面包表面產(chǎn)生的老化、緩和梨皮狀表皮等;而最近磷脂酶C作為一種新型食品添加劑勢必會推動磷脂酶C的廣泛應用和研究。
微生物來源磷脂酶C較動植物來源磷脂酶C具有生產(chǎn)周期短、結構簡單,可工業(yè)化大規(guī)模培養(yǎng)等優(yōu)勢,但野生菌株產(chǎn)量低、分離純化耗資大[10],使得高純度磷脂酶C商業(yè)化生產(chǎn)難以實現(xiàn);而且大多數(shù)來源菌株都具有病原性,在食品安全性方面存在一定的隱患。本實驗篩選出一株產(chǎn)磷脂酶C菌株Bacillus cereus 12并以其染色體為模板,利用pET系統(tǒng)載體構建磷脂酰膽堿特異性磷脂酶C基因重組大腸桿菌,初步嘗試利用該途徑實現(xiàn)磷脂酰膽堿特異性磷脂酶C基因的異源高效表達,為后續(xù)的工作提供參考。
1 材料與方法
1.1 菌株與質(zhì)粒
蠟狀芽孢桿菌Bacillus cereus 12為本實驗所篩選的高產(chǎn)磷脂酶C菌株,E. coli JM109、BL21(DE3)菌株及載體pET28a(+)為本實驗室(糧食發(fā)酵工藝與技術國家工程實驗室)保藏。
1.2 試劑與培養(yǎng)基
限制性內(nèi)切酶BamHⅠ、EcoRⅠ、DNA marker、Protein marker 加拿大Fermentas公司;T4 DNA連接酶、TaqDNA聚合酶、dNTPs、pMD18-T載體 日本TaKaRa公司;DNA片段純化試劑盒、質(zhì)粒小量提取試劑盒、膠回收試劑盒 北京博大泰克生物技術公司;p-NPPC 美國Sigma公司;其他試劑均為國產(chǎn)分析純試劑。
卵黃LB固體培養(yǎng)基:在LB固體培養(yǎng)基中添加2%卵黃;硼砂卵黃固體培養(yǎng)基:NaCl 0.66g/100mL、硼酸1.09g/100mL、硼砂0.19g/100mL、瓊脂1.5g/100mL、卵黃液2%,pH7.2~7.4。
1.3 方法
1.3.1 產(chǎn)磷脂酶C菌株的篩選
以本實驗室保藏的600株細菌為出發(fā)菌株,分別點種于卵黃LB平板上進行初篩,37℃培養(yǎng)過夜,篩選出乳白色暈圈較大的15株進行發(fā)酵培養(yǎng),于等距放在硼砂卵黃平板上的牛津杯中加入200μL發(fā)酵液,每個做3個平行,37℃溫育24h進行復篩,挑取暈圈最大的菌株進行保藏。
1.3.2 基因組DNA的提取
蠟狀芽孢桿菌基因組DNA的提取參考分子克隆實驗指南[11]相關方法進行。
1.3.3 pcplc基因的克隆
以NCBI上報道的ATCC10987的pcplc基因為模板設計PCR引物p1/p2,見表1。
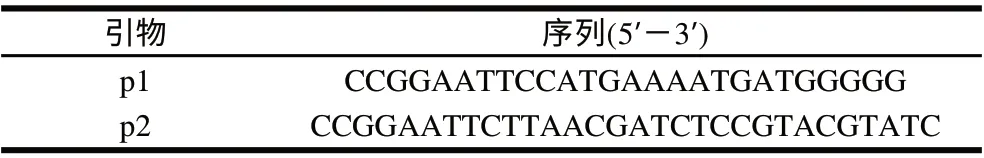
表 1 所用引物Table 1 Primers used in this study
以Bacillus cereus 12染色體為模板,以p1/p2為引物進行PCR擴增。PCR擴增體系為:dNTPs、10×Buffer各2.5μL,上下游引物各0.5μL,模板1μL,滅菌的雙蒸水18μL,Taq酶0.3μL。PCR擴增條件為:95℃預變性5min;94℃變性30s,54℃退火30s,72℃延伸90s,30個循環(huán)后72℃延伸10min。瓊脂糖凝膠電泳進行結果分析,PCR產(chǎn)物純化后,用T4 DNA連接酶連接,插入pMD18-T載體,轉化大腸桿菌JM109,藍白斑篩選陽性克隆。挑取陽性克隆接種至Amp抗性LB培養(yǎng)基中,提質(zhì)粒用EcoRⅠ酶切驗證。將驗證正確的克隆送華大基因測序。測序正確的重組質(zhì)粒命名為pMD18-pcplc1,-70℃甘油管保存。
1.3.4 大腸桿菌表達質(zhì)粒的構建
提取pMD18-pcplc1質(zhì)粒,用EcoRⅠ進行酶切膠回收目的條帶后,與經(jīng)EcoRⅠ線性化的pET28a于16℃培養(yǎng)箱連接過夜,轉化E.coli JM109感受態(tài)細胞,氨芐抗性平板篩選,挑取轉化子用T7啟動子引物和目的基因下游引物進行菌落PCR,挑取菌落PCR正確的轉化子大提,然后用BamHⅠ酶切驗證連接正反。送華大基因用T7啟動子/終止子引物測序,正確的重組質(zhì)粒命名為pET28a-pcplc1,將測序正確的質(zhì)粒轉化宿主菌BL21(DE3),-70℃甘油管保存。
1.3.5 重組菌的誘導表達及SDS-PAGE凝膠電泳檢測
將重組菌株pET28a-pcplc1/DE3以及空載對照pET28a/DE3于37℃振蕩培養(yǎng)過夜,次日以4%接種量轉接至50mL卡那霉素抗性LB液體培養(yǎng)基,37℃、200r/min培養(yǎng)至OD600nm為0.6~0.8時,加入IPTG至終濃度為1.0mmol/L,25℃誘導6h。
誘導結束后6000r/min離心10min收集菌體,并用10mL濃度為25mmol/L Tris-HCl(pH7.2)緩沖液重懸菌體,菌體于冰浴中超聲波破碎至澄清,8000r/min離心10min,收集上清,取20μL樣品加入5×Loading buffer,煮沸10min,12000r/min離心10min,上樣量15μL,采用10%分離膠、5%濃縮膠進行SDS-PAGE鑒定蛋白表達與否。
1.3.6 磷脂酶C的酶活力測定
硼砂卵黃平板牛津杯法測酶活力:取200μL發(fā)酵液置于等距放置在硼砂卵黃平板上的牛津杯中,37℃溫育24h,所產(chǎn)生的乳白色暈圈的大小即代表酶活力的高低。由于該方法磷脂酶直接作用于底物卵磷脂,所以成本低廉,應用較為廣泛。
NPPC底物法測磷脂酶C酶活力:根據(jù)磷脂酶C能水解甘油磷脂結構類似物對硝基苯酚磷酸膽堿(p-NPPC)產(chǎn)生有色基團(對硝基苯酚),該物質(zhì)在410nm波長處有最大吸收峰,可利用p-NPPC為反應底物,于410nm波長處測定反應液的吸光度,并代入標準曲線計算出PLC水解p-NPPC產(chǎn)生對硝基苯酚的量,從而定量檢測磷脂酶C活力大小。酶反應系統(tǒng)組成:0.25mol/L Tris-HCl (pH 7.2)、0.1mmol/L ZnCl2、60g/100mL山梨醇、10mmol/L p-NPPC,在反應系統(tǒng)中加入200μL發(fā)酵酶液于37℃反應30min,立刻用分光光度計測410nm波長處吸光度。酶活單位的定義:在pH7.2、37℃的條件下,每分鐘水解p-NPPC產(chǎn)生1nmol的對硝基苯酚所需的酶量為1個酶活力單位(U)。由于底物昂貴,而且p-NPPC缺乏磷脂尾端結構,不能真實地反映出磷脂酶C的水解程度[2],故初步鑒定采用硼砂卵黃平板牛津杯法。
1.3.7 重組菌株生長曲線的測定
從平板上挑取重組大腸桿菌單菌落接種于裝有20mL卡那霉素抗性LB液體培養(yǎng)基的100mL三角瓶中,37℃、200r/min過夜培養(yǎng),按4%的轉接量轉接于若干裝有50mL卡那霉素抗性LB液體培養(yǎng)基的250mL三角瓶中,37℃、200r/min振蕩培養(yǎng),定點取樣測OD600nm值,實驗過程中做3組平行實驗。
1.3.8 誘導條件的初步優(yōu)化
誘導時機、誘導溫度、誘導劑濃度、誘導時間對產(chǎn)酶的影響隨重組蛋白的種類不同而有所不同。本實驗在方法1.3.5節(jié)的基礎上通過改變單因子的方法進行誘導,根據(jù)硼砂卵黃平板牛津杯法產(chǎn)生的乳白色暈圈直徑大小來鑒定酶活的高低,每個因素做3個平行。
2 結果與分析
2.1 產(chǎn)磷脂酶C菌株的篩選結果
由圖1可知,最終篩選出3株暈圈較大的菌株,分別為95-3-3、642-16-4、12-3-1,暈圈直徑都達到22mm,經(jīng)鑒定95-3-3為熒光假單胞菌,642-16-4、12-3-1為蠟狀芽孢桿菌。本實驗選取642-16-4為出發(fā)菌株,重新命名為Bacillus cereus 12。
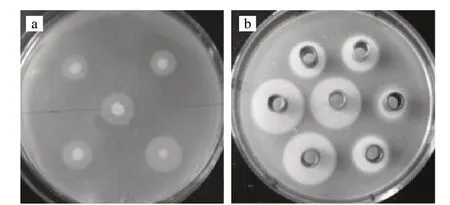
圖 1 產(chǎn)PLC的部分初篩(a)和部分復篩(b)結果Fig.1 Screening of PLC
2.2 pcplc基因的克隆
根據(jù)NCBI公布的ATCC10987的pcplc基因設計引物時發(fā)現(xiàn)該基因由信號肽、前肽和成熟肽構成,考慮前肽的助折疊功能,引物設計中包含前肽。提取蠟狀芽孢桿菌Bacillus cereus 12的基因組DNA,用p1/p2引物擴增,瓊脂糖凝膠電泳表明在約800bp處有明顯的條帶如圖2所示,命名為pcplc1。用純化試劑盒回收該片段,與pMD18-T連接后用EcoRⅠ進行酶切驗證,驗證結果如圖3中789bp和2692bp兩條帶,分別對應目的基因片段大小和載體大小。挑取正確的轉化子送華大基因測序,測序結果顯示擴增序列與ATCC10987的pcplc基因序列比對相似度97%。
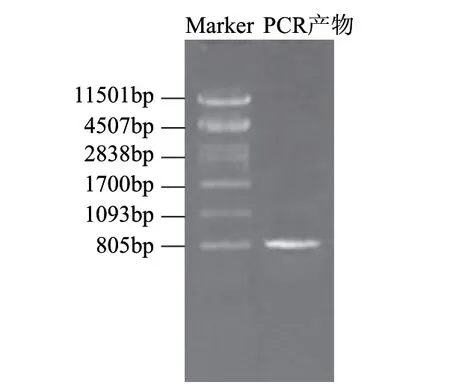
圖 2 目的基因擴增結果Fig.2 PCR amplification of the target gene
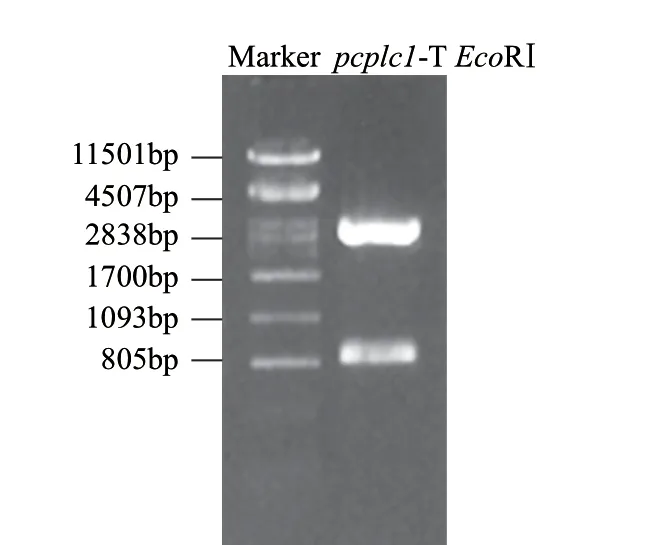
圖 3 pcplc1-pMD18-T EcoRⅠ酶切驗證Fig.3 Restriction enzyme digestion analysis of pcplc1-PMD18T by EcoRI
2.3 重組表達質(zhì)粒的構建
該表達質(zhì)粒利用N端His-Tag融合標簽,在EcoRⅠ位點將目的基因連接到載體中,構建方法如1.3.4節(jié)。利用目的基因和載體上共有的BamHⅠ位點來驗證pcplc1基因插入的正反,如果正接則得到577bp和5578bp兩條片段,如果反接則得到225bp和5930bp,結果如圖4。挑取驗證正確的轉化子進行測序,測序結果顯示閱讀框正確,重組質(zhì)粒構建成功,將其命名為pET28a-pcplc1。
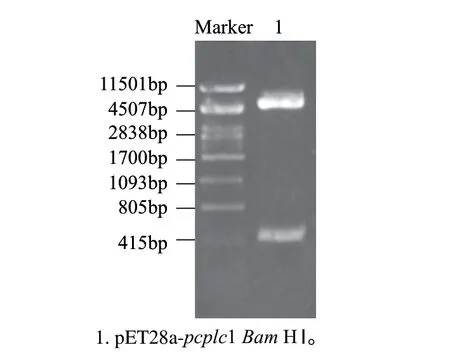
圖 4 重組質(zhì)粒pET28a-pcplc1 Bam HⅠ酶切驗證Fig.4 Restriction enzyme digestion analysis of pET28a-pcplc1 by BamHⅠ
2.4 重組質(zhì)粒在大腸桿菌中的表達
將驗證正確的包含前肽的重組質(zhì)粒pET28a-pcplc1轉化感受態(tài)表達菌株BL21(DE3),并以空載pET28a(+)和不含前肽的重組質(zhì)粒pET28a-pcplc2(構建方法同pET28apcplc1)作為對照轉化BL21(DE3),按上述1.2.4節(jié)方法進行誘導及SDS-PAGE電泳鑒定。結果如圖5所示,構建的重組菌pET28a-pcplc1/DE3、pET28a-pcplc2/DE3成功表達了分子質(zhì)量分別約為33kD和31kD的重組蛋白,與預期值相符,說明磷脂酶C基因pcplc1在大腸桿菌DE3中得以表達。
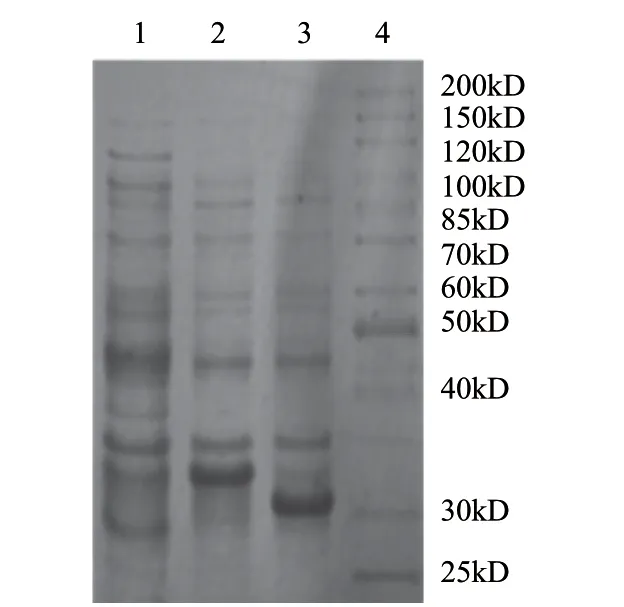
圖 5 大腸桿菌重組磷脂酶C的SDS-PAGE電泳Fig.5 SDS-PAGE analysis of recombination PLC
2.5 重組蛋白活性驗證
利用1.3.6節(jié)所述的卵黃硼砂平板法檢測磷脂酶C活性,結果如圖6顯示,pET28a-pcplc1/DE3破碎上清中的重組蛋白有明顯乳白色暈圈,而pET28a-pcplc2/DE3和空載對照均沒有,說明含有前肽的重組蛋白具備磷脂酶C活性。原因推測是酶催化位點位于成熟肽N端位置,距離前肽較近,酶活性的體現(xiàn)必須基于前肽的助折疊功能。
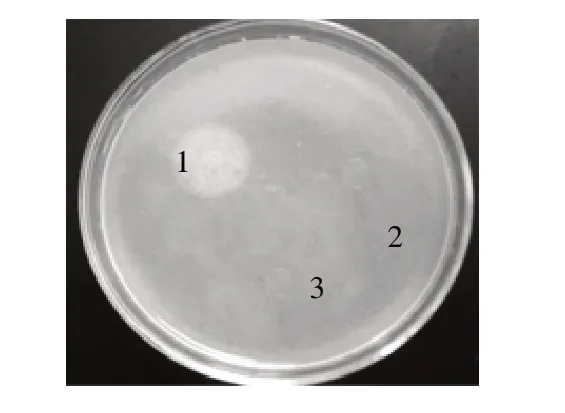
圖 6 重組蛋白活性驗證Fig.6 Verification of recombinant enzyme activity
2.6 重組菌pET28a-pcplc1/DE3生長曲線的測定及誘導條件的優(yōu)化
2.6.1 重組菌生長曲線的測定
重組菌的誘導發(fā)酵產(chǎn)酶與誘導條件密切相關,在確定最佳的誘導條件之前需要先研究重組菌的生長曲線。根據(jù)此生長曲線選擇適應期、對數(shù)生長前期、對數(shù)生長中期、對數(shù)生長后期進行誘導。按方法1.3.7節(jié)測定生長曲線,結果如圖7所示,0~1h為適應期,1~6h為對數(shù)生長期。
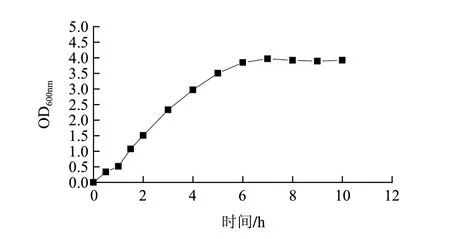
圖 7 重組菌生長曲線Fig.7 Growth curve of recombinant strain pET28a(+)-pcplc1/DE3
2.6.2 最佳誘導起始時間的確定
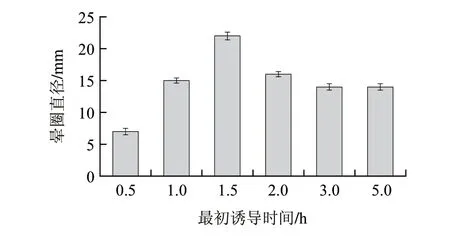
圖 8 誘導時機對酶活力的影響Fig.8 Effect of induction time on enzyme activity
誘導時機對菌體產(chǎn)酶有著較大影響,在對數(shù)生長期菌體生長狀況良好,體內(nèi)各種酶的代謝處于旺盛階段,此時誘導利于外源蛋白的合成。誘導時間過早,菌體太少往往會降低外源蛋白產(chǎn)量;誘導時間過遲,細菌過老自身代謝能力下降,不利于外源基因表達。因此按方法1.3.8節(jié),轉接后分別選取菌體生長0.5、1、1.5、2、3、5h時添加IPTG進行誘導。結果如圖8所示,酶活力隨著時間的延長而逐漸增大,在對數(shù)前期1.5h達到最大值,隨后酶活力基本上保持不變,故最佳誘導起始時間為轉接后1.5h。
2.6.3 IPTG最佳濃度的確定
IPTG作為誘導劑,能夠啟動lac啟動子的轉錄,但本身均有一定的毒性,濃度過高會抑制菌體的生長,另外IPTG價格昂貴,所以IPTG的添加并不是越多越好。按方法1.3.8節(jié),IPTG濃度選取0.1、0.2、0.4、0.6、0.8、1.0、1.2mmol/L進行誘導。由圖9可知,在IPTG濃度為0.2mmol/L時酶活力達到最大,酶活力隨著IPTG濃度的增加逐漸降低,故最佳誘導劑濃度為0.2mmol/L。
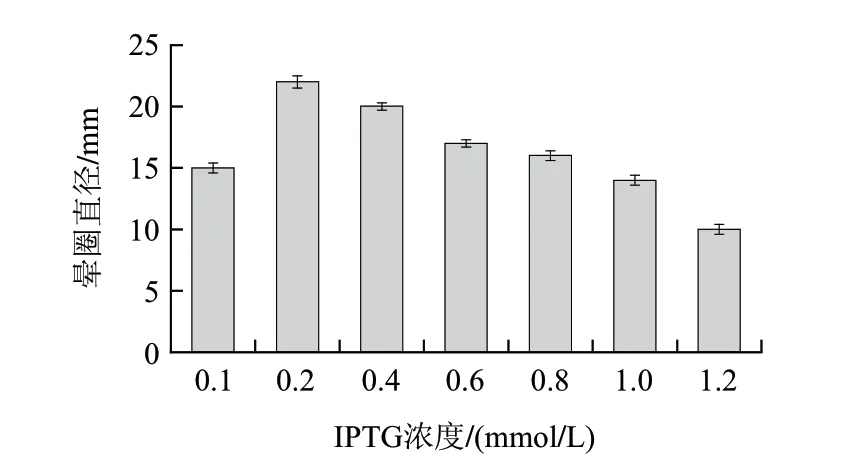
圖 9 IPTG濃度對酶活力的影響Fig.9 Effect of IPTG concentration on enzyme activity
2.6.4 最佳誘導溫度的確定
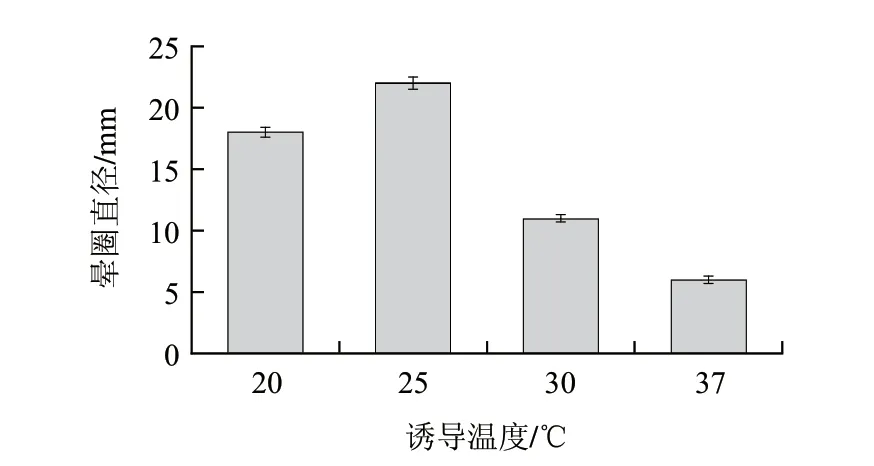
圖 10 誘導溫度對酶活力的影響Fig.10 Effect of induction temperature on enzyme activity
溫度決定著微生物體內(nèi)新陳代謝的酶催化反應,大腸桿菌的最適生長溫度為37℃,誘導溫度過高重組蛋白易折疊錯誤而以包涵體的形式存在;溫度過低菌體生長緩慢,表達量降低。本實驗依據(jù)方法1.3.8選取了4個溫度20、25、30、37℃,考察了誘導溫度對酶活的影響,結果如圖10所示,隨著溫度的升高酶活在25℃時達到最大,隨后降低,故選取發(fā)酵產(chǎn)酶的最佳溫度為25℃。
2.6.5 最佳誘導時間的確定
依據(jù)方法1.3.8節(jié),分別誘導2、4、6、8、10、12h研究誘導時間長短對產(chǎn)酶的影響。結果如圖11所示,酶活力在4h達到最大值,隨后隨著時間的遞增而減小,在8h以后酶活力相對變化較小,故最佳的誘導時間為4h。
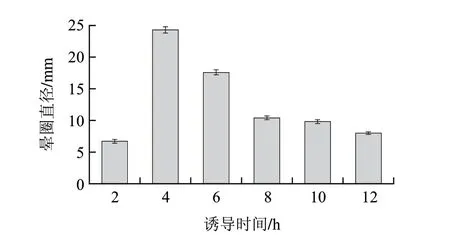
圖 11 誘導時間對酶活力的影響Fig.11 Effect of induction time on enzyme activity
2.7 最佳誘導條件下重組菌特性
綜上所述,重組大腸桿菌pET28a-pcplc1/DE3最佳誘導條為:轉接量4%,37℃培養(yǎng)1.5h后添加IPTG至終濃度為0.2mmol/L,25℃誘導培養(yǎng)4h。在最佳誘導條件下,重組磷脂酶C在硼砂卵黃平板上暈圈直徑較優(yōu)化前增大約9mm,細胞破碎上清中重組磷脂酶C酶比活力為(30.24±0.18)U/mL。
3 討 論
磷脂酶C基因結構及功能[3]的研究開始于國外20世紀60年代,隨后1997年Cristina等[12]在大腸桿菌中以包涵體的形式克隆表達了蠟狀芽孢桿菌磷脂酶C基因,近年來開始出現(xiàn)少量不同表達體系的克隆表達[13-14]及有關工業(yè)應用的報道[15]。然而目前國內(nèi)相關研究尚淺,2005年陳濤[16]對產(chǎn)磷脂酶C野生菌株Bacillus cereus Shenzhen754-1進行紫外線和60-γ射線誘變處理將酶活力提高至16.45U/mL;2007年高林等[17]對Bacillus cereus Shenzhen754-1進行培養(yǎng)條件的優(yōu)化產(chǎn)酶水平提高至26U/mL;同年王常高等[7]對篩選到的一株Bacillus mycoides進行了分離純化和部分酶學特性研究,結果純化出的蛋白具有高分解甘油磷脂結構類似物p-NPPC的能力卻沒有底物卵磷脂的分解能力;2010年詹逸舒[18]篩選到一株Bacillus cereus Z-13優(yōu)化后酶活力23.31U/mL。由于野生菌株單位產(chǎn)量低,磷脂酶C的分離純化一般采用硫酸銨沉淀初步分離,然后采用離子交換層析、凝膠柱層析等進行進一步分離純化。分離過程復雜,硫酸銨消耗量大[19],給成本帶來負擔。國內(nèi)關于細菌來源磷脂酶C基因的克隆表達的報道很少,2007年任龍等[10]嘗試利用分子克隆的手段提高產(chǎn)量,將Bacillus cereus Shenzhen754-1 磷脂酰肌醇特異性磷脂酶C基因克隆進pGEX-KG載體,在BL21(DE3)中誘導表達出以包涵體形式存在的約38kD大小的重組蛋白,但初始復性沒有測到磷脂酶C活性。隨著磷脂酶C應用范圍的拓展,單純性從野生菌株出發(fā)來提高生產(chǎn)磷脂酶C存在諸多弊端。
本實驗利用pET系統(tǒng)載體從分子生物學途徑成功實現(xiàn)了磷脂酰膽堿特異性磷脂酶C基因在大腸桿菌BL21(DE3)中的可溶性表達,避免了包涵體復性帶來的各種麻煩,而且該重組磷脂酶C的N端帶有6HIS融合標簽,為下一步的快速分離純化提供了依據(jù)。研究中發(fā)現(xiàn),前肽的存在是保證酶活的前提;直接將成熟肽基因進行克隆表達,得到的是沒有活性的重組蛋白。在誘導前提一致的情況下,誘導結束時能產(chǎn)生活性重組蛋白的重組菌菌體濃度是其他兩個對照菌體濃度的一半,由此證實了活性蛋白對菌體有一定的毒素作用,從而阻礙菌體的生長,猜測毒素作用是因為該酶的作用底物是磷脂,而且能參與一些代謝調(diào)控,從而引起不利于菌體生長的反應。后續(xù)工作將利用其N端6HIS標簽進行分離純化,獲得的純酶用于研究重組磷脂酶C的酶學性質(zhì)及一些應用研究,并將該磷脂酶C基因在芽孢桿菌和畢赤酵母等更優(yōu)越更安全的表達體系中進行表達,從而獲得更高表達量的活性蛋白,為磷脂酶C在產(chǎn)業(yè)化及工業(yè)應用方面做出貢獻。
[1] 孟慶飛, 溫其標. 磷脂酶C水解大豆油磷脂提高油脂精煉率的研究[J]. 中國油脂, 2006, 31(1): 36-38.
[2] TITBALL R W. Bacterial phospholipase C[J]. Microbiol Rev, 1993, 57(2): 347-366.
[3] LEVINE L, XIAO D M, LITTLE C. Increased arachidonic acid metabolities from cells in culture after treatment with the phosphatidylcholine-hydrolyzing phospholipase C from Bacillus cereus[J]. Prostaglandins, 1998, 34(5): 633-642.
[4] 陳明鍇, 陳蔚, 宋建華, 等. 磷脂酶C對實驗性血栓形成和纖溶功能的影響[J]. 中國藥理學通報, 2002, 18(4): 477-479.
[5] 陳濤, 宋建華, 陳明鍇, 等. 磷脂酶C抗血小板功能的研究Ⅰ: 對血小板聚集率和黏附率的作用[J]. 中國藥理學通報, 2003, 19(10): 1107-1111.
[6] 陳明鎧, 宋建華, 王散, 等. 磷脂酶C抗血小板功能的研究Ⅱ: 對血小板釋放和代謝的作用[J]. 中國藥理學通報, 2003, 19(12): 1340-1344.
[7] 王常高, 劉彥昌, 干信, 等. Bacillus mycoides磷脂酶C部分特性研究[J]. 化學與生物工程, 2007, 24(7): 52-54.
[8] 長崎詠子. 新型磷脂酶: 中國, 200680053785.2[P]. 2009-04-15.
[9] 邦奇油類公司. 使用PLA和PLC磷脂酶混合物進行酶法脫膠: 中國, 200880009294.7[P]. 2010-03-03.
[10] 任龍, 楊寧, 陳福生, 等. 蠟狀芽孢桿菌深圳株754-1PLC基因的克隆及表達[J]. 武漢工業(yè)學院學報, 2007(2): 19-21.
[11] 奧斯伯F M, 金斯頓R E, 塞德曼J G, 等. 精編分子生物學實驗指南[M]. 5版. 北京: 科學出版社, 2008.
[12] CRISTINA A T, MICHAE1 J H, MARY F R. Cloning, overexpression, refolding, and purification of the nonspecific phospholipase C from Bacillus cereus[J]. Protein Expression and Purification, 1997, 10: 365-372.
[13] SEO K H. High-level expression of recombint phospholipase C from Bacillus cereus in Pichia pastoris and its characterization[J]. Biotechnology Letters, 2004, 26: 1475-1479.
[14] MARKUS A. High level expression of a recombinant phospholipase C from Bacillus cereus in Bacillus subtilis[J]. Appl Microbiol Biotechnol, 2007, 74: 634-639.
[15] SUGIMORI D, NAKAMURA M. Partial purification and some properties of a phospholipase C from Pseudomonas sp. strain KS3.2[J]. Biosci Biotechnol Biochem, 2006, 70: 535-537.
[16] 陳濤. 高產(chǎn)磷脂酶C菌株的誘變選育[J]. 天然產(chǎn)物研究與開發(fā), 2005, 17(6): 712-716.
[17] 高林, 陳濤, 高智謀. 蠟狀芽孢桿菌深圳菌株754-1產(chǎn)磷脂酶C培養(yǎng)條件的優(yōu)化研究[J]. 安徽農(nóng)業(yè)大學學報, 2007, 34(4): 501-504.
[18] 詹逸舒. 產(chǎn)磷脂酶C菌株的篩選及其酶學性質(zhì)的研究[D]. 長沙: 湖南農(nóng)業(yè)大學, 2010.
[19] 楊寧, 陳明鍇, 仁龍, 等. 重組磷脂酶C的研究[J]. 中國藥理學通報, 2006, 22(10): 1263-1265.

