兒童ALL治療中骨髓細胞形態學動態監測及其意義
,,,
(青島大學醫學院附屬醫院小兒血液科,山東 青島 266003)
急性淋巴細胞白血病(ALL)是兒童常見的惡性腫瘤,其治愈率接近80%,但仍有約20%的病兒復發,主要原因是達到血液學完全緩解時體內仍殘留一定數量的白血病細胞[1]。為了更有效地提高療效,本文對我院按2004方案[2]診治的70例ALL病兒骨髓形態學動態監測結果進行回顧性分析,探討其臨床意義。現將結果報告如下。
1 資料與方法
1.1 研究對象
2006年8月—2010年3月,我科診治ALL病兒70例,男39例,女31例;年齡1~14歲,中位年齡4歲。細胞形態學分型:L1型(原幼淋細胞以小細胞為主,大細胞<25%)59例,L2型(原幼淋細胞以大細胞為主,>25%)11例;免疫學分型:B細胞系54例(含My+-B細胞系10例),T細胞系10例(含My+-T細胞系1例),未明確免疫學分型7例;臨床分型:標危型34例,中危型20例,高危型16例。中位隨訪時間6~69個月,平均38個月。
1.2 研究方法
1.2.1骨髓細胞形態學監測 監測完全緩解治療第19、33天以及初次緩解后維持治療過程中,骨髓存在形態學可辨認的原始+幼稚淋巴細胞比例。完全緩解治療第19天骨髓緩解狀態[2-3]分為M1(骨髓明顯抑制,原始+幼稚淋巴細胞<5%)、M2(骨髓呈不同程度的抑制,原始+幼稚淋巴細胞為5%~25%)、M3(骨髓抑制或不抑制,原始+幼稚淋巴細胞>25%),第33天及初次緩解后維持治療過程中的骨髓緩解狀態[2-3]分為完全緩解(CR,原始+幼稚淋巴細胞<5%)、部分緩解(PR,原始+幼稚淋巴細胞為5%~20%)、未緩解(NR,原始+幼稚淋巴細胞>20%)。骨髓涂片采用瑞特染色,所有涂片由兩位有經驗的形態學專家共同完成閱片。
1.2.2無事件生存(EFS)時間、刪失數據的統計EFS時間指自確診到第1次事件發生或隨訪截至日所經歷的時間,其中事件定義為白血病復發或死亡。刪失數據是指在規定觀察時間內未觀察到死亡結果,無法得知病兒的確切生存時間。
1.3 統計學處理

2 結 果
2.1 誘導完全緩解第19、33天治療反應
70例ALL病兒誘導完全緩解治療第19天M1組51例,5年EFS率為(73.9±8.2)%;M2組19例,5年EFS率為(19.7±9.5)%;經Log-Rank檢驗,M1組病兒生存率顯著高于M2組(χ2=25.320,P<0.001)。誘導完全緩解治療第33天CR組69例,5年EFS率(59.0±7.3)%;PR組1例,5年EFS率0;經Log-Rank檢驗,CR組病兒生存率顯著高于PR組(χ2=21.676,P<0.001)。見圖1。
2.2 維持治療中骨髓形態學動態監測
維持治療中骨髓形態學監測出現原始+幼稚淋巴細胞比例5%~20%、1.0年內出現及1.0年內出現頻率>3次組病兒生存率明顯降低,差異有統計學意義(χ2=14.347~16.416,P<0.05)。見表1。各因素分組的ALL病兒5年EFS率及生存曲線見表1、圖2。
2.3 不同臨床分型及免疫學分型ALL病兒骨髓細胞形態學監測結果比較
骨髓形態學監測原始+幼稚淋巴細胞比例為5%~20%病兒中,臨床分型為高危型、免疫分型為T細胞系的生存率均明顯降低(χ2=8.476、23.099,P<0.01)。各因素分組的病兒5年EFS率及生存曲線見表1、圖3。
2.4 獨立預后因素分析
1.0年內骨髓原始+幼稚淋巴細胞比例5%~20%出現頻率>3次病兒的死亡風險為≤3次病兒的8.180倍(95%CI2.371~28.217,P=0.001),高危型骨髓原始+幼稚淋巴細胞比例5%~20%病兒的死亡風險是非高危型病兒的3.013倍(95%CI1.146~7.918,P=0.025),T細胞系骨髓原始+幼稚淋巴細胞比例5%~20%病兒的死亡風險是B細胞系病兒的7.064倍(95%CI1.968~25.359,P=0.003)。見表2。
3 討 論
兒童ALL是造血干細胞異常克隆性疾病,骨髓細胞形態學檢查不僅具有診斷價值,也是臨床療效的判斷指標。2004方案[2]將誘導完全緩解治療第19天骨髓原始+幼稚淋巴細胞>5%作為早期治療反應不佳的情況之一,也將其納為高危組的判斷標準之一。本文回顧性分析結果顯示,誘導完全緩解治療第19天骨髓原始+幼稚淋巴細胞比例<5%與5%~25%的病兒生存率差異有統計學意義,提示誘導完全緩解治療第19天骨髓細胞形態學檢查能反映早期化療敏感性和誘導治療過程中早期緩解狀態,具有一定的預后價值;但COX比例風險回歸模型多因素分析顯示,第19天骨髓細胞形態學檢查不是獨立的預后指標。宋亮等[4]的研究結果也顯示,誘導第19天骨髓是否緩解對長期生存沒有影響。CHAUVENET等[5]研究認為,準確評估早期化療反應是確保高危病兒不會錯誤進入低危治療方案的關鍵。因此,第19天骨髓細胞形態學檢查雖能初步預測病兒的復發風險,但不是獨立的預后因素,需結合第8天潑尼松敏感試驗綜合判斷早期治療反應,以早期干預,達到合理化療的目的。誘導完全緩解治療第33天骨髓CR組病兒生存率明顯高于NR組,提示第33天骨髓細胞形態學檢查不僅是兒童ALL誘導完全緩解治療的療效標準,也可提示化療敏感性及殘留白血病細胞數量,協助判斷預后。誘導治療末期測定殘留白血病細胞數量是早期預測復發的基礎[6]。
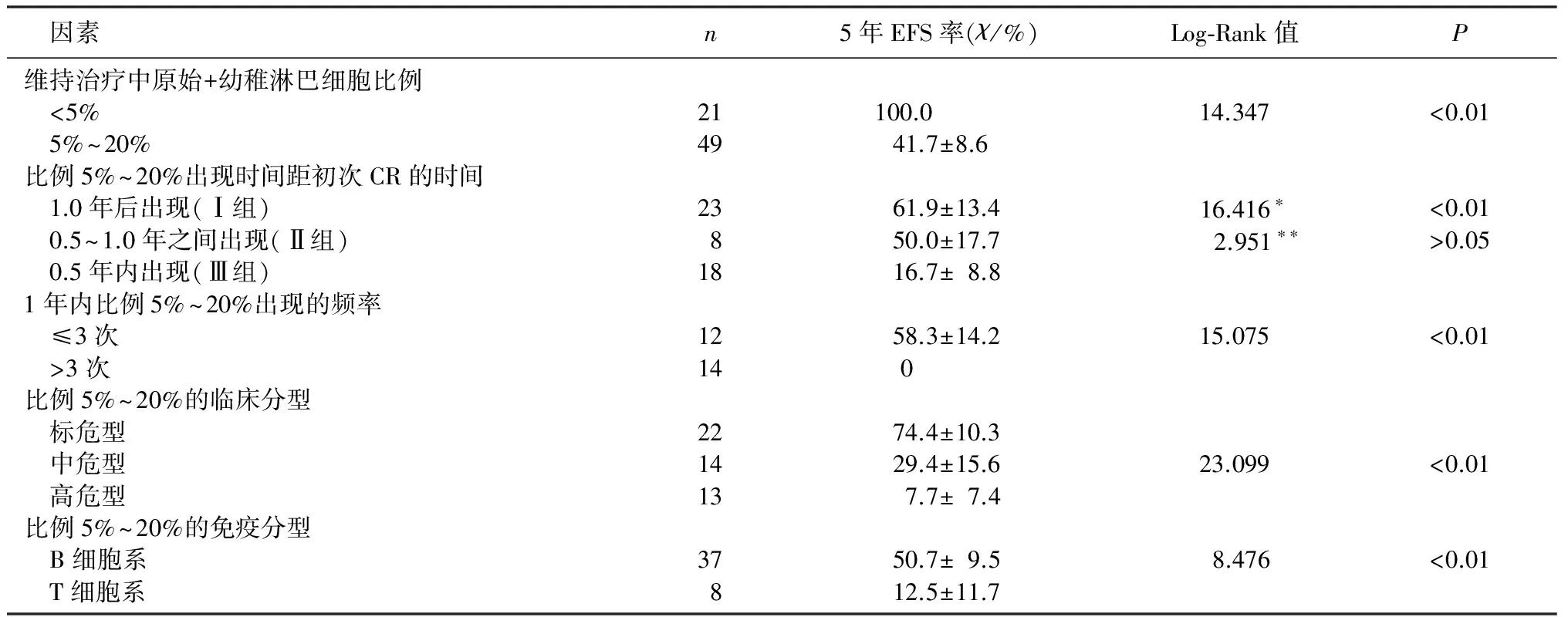
表1 各因素分組的ALL病兒5年EFS率及Log-Rank檢驗結果

圖1 誘導完全緩解治療第19天不同骨髓形態學分組的生存曲線

圖2 維持治療中不同骨髓原始+幼稚淋巴細胞比例5%~20%組的生存曲線


圖3 不同臨床分型及免疫學分型原始+幼稚淋巴細胞比例為5%~20% ALL病兒生存曲線

表2 1.0年內骨髓原始+幼稚淋巴細胞比例5%~20%病兒COX回歸分析結果
本文獲得完全緩解后病兒維持治療中骨髓形態學動態檢測結果顯示,原始+幼稚淋巴細胞比例在5%~20%之間病兒生存率均低于<5%組,說明動態監測骨髓原始+幼稚淋巴細胞比例的變化具有預后價值,而形態學持續處于完全緩解狀態的病兒對化療敏感,預后好;而且原始+幼稚淋巴細胞比例5%~20%出現時間越早(1.0年內),其3年和5年EFS率越低,預后差;其中出現時間早(1.0年內)且出現頻率高(>3次)更具有預后意義,且為獨立的預后影響因素。
近10年來,強調以危險因素分型的連續規范化治療是兒童ALL治療成功的關鍵。根據白血病臨床分型和免疫分型給予不同方案化療,可極大提高療效。RATEI等[7]研究結果表明,明確免疫分型可為個體化治療及預后判斷提供可靠依據。還有研究認為,T細胞系白血病細胞易轉移,易復發,預后不良[8]。本文結果顯示,高危型和T細胞系白血病維持治療中骨髓原始+幼稚淋巴細胞比例5%~20%均是獨立的預后影響因素,緩解后維持治療中出現這種情況,提示體內殘留白血病細胞數量增高,腫瘤負荷大。且這些殘留腫瘤細胞往往具有耐藥性,成為 ALL復發的根源[9]。
綜上所述,動態監測骨髓細胞形態學以判斷病情發展,評估臨床復發風險,有助于及時調整化療方案;實行基于危險因素分組的個體化治療,有極大臨床指導意義[10]。
[1] M?RICKE A, REITER A, ZIMMERMANN M, et al. Risk-adjusted therapy of acute lymphoblastic leukemia can decrease treatment burden and improve survival: treatment results of 2169 unselected pediatric and adolescent patients enrolled in the trial ALL-BFM 95[J]. Blood, 2008,111(9):4477-4489.
[2] 中華醫學會兒科學分會血液學組、中華兒科雜志編輯委員會. 兒童急性淋巴細胞白血病診療建議(第三次修訂草案)[J]. 中華兒科雜志, 2006,44(5):392-395.
[3] 張之南,沈悌. 血液病診斷及療效標準[M]. 北京:科學出版社, 2007:168-172.
[4] 宋亮,劉華林,孫立榮,等. 影響兒童急性淋巴細胞白血病預后的多因素分析[J]. 中國小兒血液與腫瘤雜志, 2010,15(1):21-24.
[5] CHAUVENET A R, MARTIN P L, DEVIDAS M, et al. Antimetabolite therapy for lesser-risk B-lineage acute lymphoblastic leukemia of childhood: a report from Children’s Oncology Group Study P9201[J]. Blood, 2007,110(4):1105-1111.
[6] 張志向,柴憶歡,何海龍,等. 急性淋巴細胞白血病患兒骨髓微小殘留病檢測的臨床意義[J]. 實用兒科臨床雜志, 2010,25(15):1133-1135.
[7] RATEI R, BASSO G, DWORZAK M, et al. Monitoring treatment response of childhood precursor B-cell acute lymphoblastic leukemia in the AIEOP-BFM-ALL 2000 protocol with multiparameter flow cytometry: predictive impact of early blast reduction on the remission status after induction[J]. Leukemia, 2009,23(3):528-534.
[8] 王亞,盧愿,王玲珍,等. 培門冬酶與左旋門冬酰胺酶治療兒童白血病效果比較 [J]. 齊魯醫學雜志, 2012,27(3):208-210.
[9] YANG J J, CHENG C, YANG W J, et al. Genome-wide interrogation of germline genetic variation associated with treatment response in childhood acute lymphoblastic leukemia[J]. JAMA: the Journal of the American Medical Association, 2009,301(4):393-403.
[10] IRVING J, JESSON J, VIRGO P, et al. Establishment and validation of a standard protocol for the detection of minimal residual disease in B lineage childhood acute lymphoblastic leukemia by flow cytometry in a multi-center setting[J]. Haematologica, 2009,94(6):870-874.

