胺碘酮對兔心肌缺血再灌注后血清SOD和MDA影響
,,,,,,,
(1 邯鄲市第一醫院心內科,河北 邯鄲 056002; 2 河北醫科大學研究生學院)
無復流是指急性心肌梗死心外膜冠狀動脈再通后,心肌組織水平的再灌注不完全,甚至無再灌注的現象[1]。無復流發生機制尚不完全清楚,但有研究結果表明,氧自由基可能參與無復流形成[2]。血清超氧化物歧化酶(SOD)是體內最重要的自由基清除酶,丙二醛(MDA)是自由基引起的脂質過氧化過程中生成的一種醛類物質,檢測血清中SOD活性和MDA含量可反映心肌細胞氧自由基產生和損傷程度[3]。胺碘酮作為抗心律失常藥物臨床應用廣泛,它同時具有擴張冠狀動脈、抗炎、抗脂質過氧化及清除氧自由基等作用[4]。本實驗旨在探討胺碘酮對兔實驗性急性心肌缺血再灌注后SOD和MDA水平的影響及其意義。
1 材料與方法
1.1 實驗動物
清潔級健康新西蘭大白兔30只,雌雄不限,年齡11~12周,體質量(2.5±0.3)kg,由河北醫科大學實驗動物中心提供。隨機分為假手術組、正常對照組及胺碘酮組,每組10只。
1.2 試劑及儀器設備
胺碘酮注射液購自杭州默沙東制藥有限公司。伊文思藍、硫磺素S購自美國Sigma公司。MDA、SOD試劑盒購自南京建成生物工程研究所。
1.3 模型的建立及各組處理
[5-6]方法建立缺血再灌注無復流模型。正常對照組再灌注即刻給予等量的生理鹽水,胺碘酮組再灌注即刻給予胺碘酮3 mg/kg。假手術組僅開胸不結扎冠狀動脈。各組于再灌注120 min后取血檢測SOD活性及MDA含量。術后取心臟進行缺血、無復流面積的評估[5-6]。
1.4 SOD及MDA水平的檢測
于再灌注120 min后分別從耳緣靜脈采血2 mL,置于真空采血管中,于離心機中以3 500 r/min離心15 min,取出血清后置于-20 ℃冰箱中保存,統一采用黃嘌呤氧化酶法測定SOD活性,硫代巴比妥法測定MDA含量,嚴格按照試劑盒說明書操作。
1.5 統計學處理
2 結 果
2.1 缺血無復流范圍比較
正常對照組與胺碘酮組缺血范圍比較,差異無顯著性,而胺碘酮組無復流范圍明顯小于正常對照組(t=4.483,P<0.01)。見圖1、2,表1。
2.2 血清中SOD活性及MDA含量的比較
與假手術組相比,正常對照組、胺碘酮組再灌注后血清SOD活性明顯降低,MDA含量明顯增高,差異均有統計學意義(F=800.90、1 457.60,q=18.89~73.32,P<0.01)。與正常對照組相比,胺碘酮組再灌注后血清SOD活性明顯增高,MDA含量明顯降低,差異有顯著意義(q=36.76、18.18,P<0.01)。見表2。

2a為正常對照組硫磺素S染色;2b為胺碘酮組硫磺素S染色。
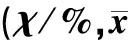
表1 兩組缺血、無復流范圍比較±s)
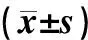
表2 各組血清SOD、MDA檢測結果比較
3 討 論
心肌細胞缺血再灌注損傷產生大量的氧自由基和過氧化物質促進無復流的發生,ZHAO等[7]研究認為,冠狀動脈無復流是由于再灌注期間黃嘌呤氧化酶代謝產生大量自由基所致,而氧自由基多來源于黃嘌呤氧化酶反應及線粒體、多形核細胞等,同時也發現SOD途徑在正常時負責清除氧自由基,這種功能可能在缺血發作后發生了改變,導致無復流的產生。本研究也得出相似的結論,正常對照組與假手術組相比,SOD活性明顯降低,表明發生無復流時,心肌細胞膜發生脂質過氧化,會產生大量的自由基,使得SOD活性因消耗過多而降低。本研究同時顯示,胺碘酮組與正常對照組相比,SOD活性明顯增高,提示冠狀動脈發生無復流后,胺碘酮可能通過抗脂質過氧化作用,抑制過多自由基的產生與清除自由基,改善缺血再灌注損傷細胞的膜結構及其功能,減少脂質過氧化物的形成,從而減輕心肌缺血再灌注損傷,改善無復流狀況。
已有充分依據表明,再灌注損傷與氧自由基生成有關,冠狀動脈再灌注期間會產生大量的氧自由基,體內的抗氧化酶系統(如SOD等)可清除自由基,使得SOD活性降低,同時產生了大量的脂質過氧化產物,MDA是脂質過氧化的終產物,是研究抗氧化能力的常用指標之一。通過測定體內MDA含量,可間接反映體內冠狀動脈無復流時自由基對機體的損傷程度[8]。本研究結果顯示,與對照組相比,胺碘酮組血清MDA含量明顯降低,提示胺碘酮可能通過增加SOD活性,明顯減輕缺血再灌注損傷,使脂質過氧化產物生成減少,進而減少血清MDA的產生。有研究顯示,胺碘酮增加SOD活性及降低血清中MDA含量,可能與減少氧自由基的產生密切相關[9],進而改善冠狀動脈無復流的嚴重程度。
總之,本文的研究結果顯示,急性心肌缺血時應用胺碘酮可以通過增加SOD的活性及降低血清中MDA含量,減輕缺血再灌注損傷,改善無復流狀況,在預防無復流治療中有重要的參考價值。
[參考文獻]
[1] 騰軍,宋玲,尹作民. AMI病人冠狀動脈內支架安置術的無復流現象分析[J]. 齊魯醫學雜志, 2005,20(4):54-81.
[2] BOLOGNESE L, CARRABBA N, PARODI G, et al. Impact of microvascular dysfunction on left ventricular remodeling and long-term clinical outcome after primary coronary angioplasty for acute myocardial infarction[J]. Circulation, 2004,109(9):1121-1126.
[3] JIANG B, CHEN Q, LIU X, et al. Ischemic postconditioning protects renal function after 24 hours of cold preservation in a canine autotransplantation model[J]. Transplant Proc, 2012,44(6):1776-1781.
[4] MAREN L, NELE B A, UWE J F, et al. Amiodarone has anti-inflammatory and anti-oxidative properties: an experimental study in rats with carrageenan-induced paw edema[J]. European Journal of Pharmacology, 2007,566(1-3):215-221.
[5] KLONER R A, GANOTE C E, JENNINGS R B. The “no-reflow” phenomenon after temporary coronary occlusion in the dog[J]. J Clin Invest, 1974,54(6):1496-1508.
[6] REFFELMANN T, KLONER R A. Microvascular reperfusion injury: rapid expansion of anatomic no reflow during reperfusion in the rabbit[J]. Am J Physiol Heart Circ Physiol, 2002,283(3):1099-1107.
[7] ZHAO J, YANG Y, YOU S, et al. Carvedilol preserves endothelial junctions and reduces myocardial no-reflow afteracute myocardial infarction and reperfusion[J]. Int J Cardiol, 2007, 115(3):334-341.
[8] GAO Y H, CHEN L, MA Y L, et al. Chronic intermittent hypoxia aggravates cardiomyocyte apoptosis in rat ovariectomized model.[J]. Chin Med J (Engl), 2012,125(17):3087-3092.
[9] DOMENICO L, GIULIANO C, SANTE D P, et al. Amiodarone inhibits tocopherol-mediate human lipoprotein peroxidatio biochemical[J]. Pharmacology, 2007,74(2):265-272.

