鯉春病毒血癥病毒G 蛋白的研究進展
張家林 李洋 李強
(大連海洋大學 農業部北方海水增養殖重點實驗室,大連 116023)
鯉春病毒癥(Spring viraemia of carp,SVC)是由鯉春病毒血癥病毒(Spring viremia of carp virus,SVCV,簡稱鯉春病毒)引發的危害鯉科魚類的一種急性、高致死性的傳染病。在歐洲、亞洲及北美廣泛流行,對鯉科魚類養殖造成巨大的經濟損失[1]。世界動物衛生組織(OIE)將其列為必報的重要疫病,《中華人民共和國進境動物一、二類傳染病、寄生蟲病名錄》(2008)列為一類動物疫病[2]。SVCV屬于彈狀病毒科(Rhabdoriridae)、水泡性病毒屬(Vesiculorirus),為單股負鏈RNA 病毒。病毒基因組包含5 個開放閱讀框(ORF),分別編碼核蛋白(N)、磷蛋白(P)、基質蛋白(M)、糖蛋白(G)和RNA聚合酶蛋白(L)[3]。其中,糖蛋白(G)是位于病毒囊膜表面的結構及功能蛋白,與病毒的感染[4],免疫識別[5]及病毒內吞[6]等功能密切相關。深入研究G 蛋白對于建立新型檢測方法以及鯉春病毒血癥的防治有重要意義。
1 G 蛋白結構與生物學功能
G 蛋白由509 個氨基酸殘基組成,根據糖基化程度的不同,分子量介于76-88 kD[7]。靠近N 端上游有一段信號肽序列,C 端第476-499 位氨基酸殘基之間擁有一個跨膜結構域。Roche 等[8]通過晶體衍射試驗表明,G 蛋白是典型的Ⅱ型跨膜糖蛋白,以三聚體形式鑲嵌在病毒囊膜表面,折疊成4 個不同的區域,存在5 個可能的糖基化位點。G 蛋白的糖基化主要有兩種:O-糖基化和N-糖基化,O-糖基化位點主要位于氨基末端,N-糖基化位點可能位于28、181、338、362 和369 位點[9,10]。圖1 為本實驗室采用Phyre2 在線工具預測的G 蛋白結構。
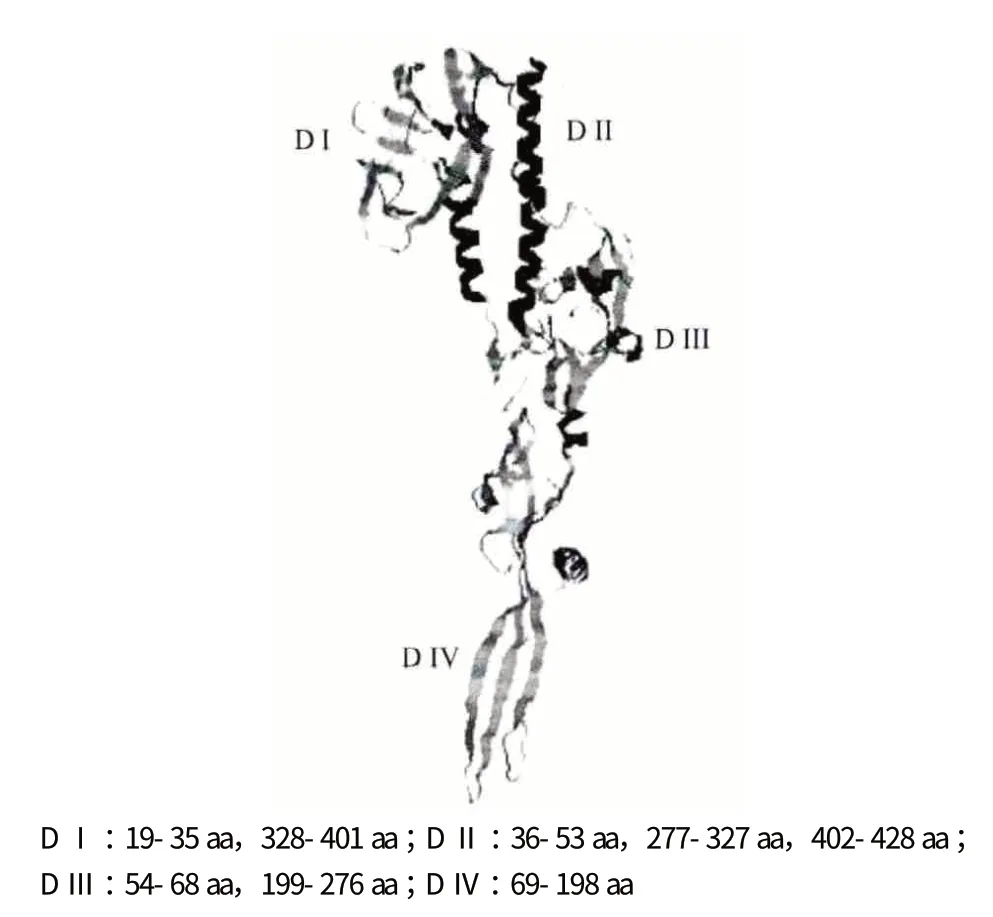
圖1 Phyre2 工具預測的G 蛋白結構
病毒感染時,G 蛋白可選擇性地與宿主細胞受體結合,在低pH 環境刺激下促使病毒囊膜與宿主細胞融合,核衣殼釋放到細胞質中完成內吞[11]。G蛋白可誘導機體產生中和抗體(Viral neutralizing antibody),是研制鯉春病毒基因工程疫苗的重要靶點[12]。G 蛋白還是病毒抗原性和遺傳性差異最大的結構蛋白,Stone 等[13]根據G 蛋白基因核苷酸序列以及抗原性差異,將SVCV 基因型分成Ⅰa、Ⅰb、Ⅰc 和Ⅰd 四個亞型,其中Ⅰa、Ⅰd 變異度較高。研究表明:G 蛋白與病毒毒力密切相關,不同毒力毒株G 蛋白的基因序列存在差異。Gaudin 等[14]發現G 蛋白存在R Ⅰ和R Ⅱ兩大毒力區域,若同時發生突變,病毒毒力將明顯降低。此外,G 蛋白擁有部分高度保守基因序列,可作為鑒別病毒的依據。
2 G 蛋白表達的研究進展
病毒天然蛋白的提取需要一定的設備和工藝程序,往往得率較低,難以大量分離。隨著基因工程的發展,采用重組表達技術人工表達病毒蛋白,解決了病毒蛋白難以純化的難題,為大量制備病毒蛋白提供了條件,有效地避免病毒泄露事故。目前已經有采用重組表達的蛋白制備單克隆抗體(Monoclonal antibody)的報道[15],國內外很多學者致力于重組表達G 蛋白,為研究G 蛋白的功能及制備抗SVCV 單克隆抗體準備材料。
大腸桿菌表達系統是發展最早,應用最廣泛的表達系統。通常將構建的重組表達質粒轉化至大腸桿菌感受態細胞中,通過IPTG 誘導獲得目的蛋白[16]。它不僅操作程序簡單、表達周期短,而且其表達產量遠高于其他表達系統。張琳等[17]在表達C1 分離株G 蛋白時,將雙酶切后的G 基因片段定向克隆至原核表達載體pET21a 上,轉化到大腸桿菌BL21(DE3)中,經誘導,目的蛋白以包涵體形式實現高效表達,經包涵體變性、稀釋復性、分子篩層析后,純度達90%以上。楊振慧等[18]構建包含G 蛋白基因的重組表達質粒,轉化入BL21(DE3)后實現高效表達,割膠回收包涵體、His 親和純化后制備兔抗血清,Western-blot 結果表明G 蛋白的兔抗血清能與病毒細胞培養物發生特異性反應。但是,大腸桿菌表達系統缺乏糖基化、脂肪酸酰化、磷酸化等翻譯后修飾,影響目的蛋白的生物活性及功能[19]。
為了解決上述困難,很多學者開始采用真核表達系統表達G 蛋白,研究集中在桿狀病毒表達系統及畢赤酵母表達系統上。昆蟲/桿狀病毒表達系統是當前最具潛力的表達系統,目前已經有近千種異源蛋白在此系統中得到高效表達,重組蛋白折疊正確、有一定的翻譯后修飾、易于分離純化[20]。一般是將目標蛋白編碼序列克隆至桿狀病毒轉移載體上,通過同源重組構建重組病毒DNA,進而感染昆蟲細胞產生重組蛋白。Huang 等[21]將連有鯉春病毒G 蛋白基因的重組轉移質粒轉化到含穿梭載體Bacmid 的感受態細胞DH10Bac 中,成功構建重組子rBacmid-SVCV/G,在脂質體介導下轉染sf9 昆蟲細胞,獲得重組桿狀病毒Bac-SVCV/G,采用間接免疫熒光和Western-blot 檢測到G 蛋白在昆蟲細胞膜上獲得表達,并證明了G 蛋白可以介導細胞融合。研究還表明,利用重組桿狀病毒Bac-CMV-EGFP 可以高效轉導魚類細胞系,使外源基因穩定、高量的表達。
然而桿狀病毒表達系統不能連續表達外源蛋白,畢赤酵母表達系統具有特定的醇氧酶基因(Alcohol oxidase,AOX)啟動子,將外源基因通過載體整合到酵母基因組后,以甲醇作為醇氧化酶的誘導劑,誘導AOX 啟動子的轉錄翻譯,從而可嚴格地調控外源基因的表達[22]。它既保留了原核表達系統培養周期短、產物易純化的優點,又可以對外源蛋白進行一定的加工修飾,可用于大規模生產外源蛋白。付峰等[23]用穿梭載體pGAPZαA/B 構建含鯉春病毒G蛋白基因片段的重組表達載體,經線性化后采用電擊法轉化至畢赤酵母SMD1168 菌株,斑點印跡結果表明重組酵母菌株成功地表達G 蛋白。
3 G 蛋白在鯉春病毒血癥預防上的應用
3.1 在鯉春病毒檢測中的應用
目前OIE 規定的檢測SVCV 的方法是基于單克隆抗體的間接酶聯免疫吸附試驗(Enzyme-linked immunosorbent assay,ELISA)及間接免疫熒光試驗(Indirect immunoinfluscent assay,IFA)。由于鯉春病毒變種多,制備通用的單克隆抗體較為困難,限制了該方法的應用普及。近幾年國內外學者主要圍繞G 蛋白基因的高度保守區,建立了一些檢測SVCV方法。
3.1.1 套式RT-PCR 該方法是在RT-PCR 基礎上,通過引入兩套引物放大特定的DNA 片段。套式RTPCR 具有靈敏度高、特異性強和檢測周期短的優點,但不適合無病檢測,易出現假陽性。高隆英等[24]根據鯉春病毒G 蛋白編碼基因序列,經過RT-PCR和半套式PCR 擴增出G 蛋白編碼框的714 bp 和606 bp 片段,特異性試驗表明該方法與其他彈狀病毒沒有交叉反應,該方法已成為我國檢測鯉春病毒的國家標準(GB/T 15805.5-2008);Kim 等[25]在高隆英等研究的基礎上進行方法改進,通過引入構建的陽性對照質粒,有效地減少了模板污染引起的假陽性現象。Kountná 等[26]根據G 蛋白基因保守序列設計4 條引物,建立了檢測鯉春病毒的套式RT-PCR,該方法與狗魚幼魚彈狀病毒(PFRV)等其他魚類病毒無交叉反應,病毒細胞培養后其檢測靈敏度達到10-1TCID50mL-1。
3.1.2 熒光定量RT-PCR 熒光定量RT-PCR 技術是在反應體系中加入熒光基團,利用熒光信號積累實時監測整個PCR 進程,最后通過標準曲線對未知模板進行定量分析。該方法可對病毒RNA 進行定量檢測、靈敏度較套式RT-PCR 高一個數量級,有效避免交叉污染的機會。張利峰等[27]根據SVCV 的G蛋白編碼基因保守區序列,建立了快速檢測鯉春病毒的熒光RT-PCR 檢測技術。靈敏度試驗結果表明,將病毒懸液10-6稀釋后應用此法仍可檢出。為縮短檢測時間、提高檢測通量,劉宗曉等[28]根據G 蛋白基因序列設計引物,建立了多重實時RT-PCR 方法,能夠同時定量檢測SVCV、傳染性造血器官壞死病毒(IHNV)、病毒性出血敗血癥病毒(VHSV)3 種彈狀病毒,該方法的最低檢測限分別為40 個拷貝、220 個拷貝和140 個拷貝,同時通過對80 份樣品的檢測、抗原捕捉方法和細胞培養試驗,證實了方法的準確性,可用于疾病診斷和理論研究。
3.1.3 RT-LAMP RT-LAMP 技術是通過提取病毒RNA,利用逆轉錄酶的逆轉錄活性,采用4 條特異性引物及一種具有鏈置換活性的DNA 聚合酶,在恒定溫度下對樣品RNA 模板進行擴增。該技術不需要PCR 儀、程序簡單快速、可檢測到pg 級的病毒RNA。Shivappa 等[29]針對從美國卡羅萊納州分離到鯉春病毒G 蛋白編碼基因設計了4 套引物進行RT-LAMP 擴增,證實建立的RT-LAMP 方法是特異的,靈敏度與RT-PCR 方法近似,最低檢測限為101TCID50mL-1。Liu 等[30]根據SVCV 糖蛋白基因的保守序列設計兩個內引物和兩個外引物,建立了快速檢測SVCV 的一步法RT-LAMP 方法,結果表明該法可區分SVCV、PFRV、VHSV、IHNV 等彈狀病毒,且具有與半套式RT-PCR 相同的靈敏度,通過與其他檢測方法比較,證實RT-LAMP 檢測技術更適合SVCV 的現場檢測和大規模監控。
3.1.4 其他檢測技術 除了上述核酸檢測方法之外,G 蛋白作為特異性蛋白抗原,也可直接參與建立病毒免疫診斷方法。ELISA 法是歷史上較為經典的診斷方法,目前已經有商品化ELISA 診斷試劑盒面世(鯉春病毒血癥抗原檢測試劑盒,BIO-X),該方法檢測結果準確、直觀、重復性好,但步驟較為繁瑣費時,需要在酶標儀上完成檢測。隨著膠體金免疫層析技術和蛋白芯片在水產上的應用,建立基于G 蛋白的新型檢測方法成為了今后一個階段的研究熱點,為實現快速、簡便、靈敏地檢測SVCV 提供了可能。
3.2 在構建DNA疫苗上的應用
目前SVCV 相關疫苗研究集中在滅活疫苗、亞單位疫苗及DNA 疫苗。傳統滅活疫苗存在毒力返強的現象[31],而制備通用亞單位疫苗的難點在于G 蛋白的變異度較高。DNA 疫苗是繼傳統疫苗和基因工程亞單位疫苗之后的第三代新型疫苗,利用基因重組技術直接將抗原蛋白編碼的外源基因導入魚體細胞內,在宿主細胞中表達抗原蛋白,誘導宿主產生對該抗原蛋白的免疫應答,以達到預防和治療疾病的目的。它不但具有滅活疫苗的優點,還具有適于大批量生產、結構穩定、相對安全等優點,越來越受到人們的重視[32],具有廣闊的應用前景。
歐陽征亮等[33]選取鯉春病毒 G 蛋白基因N 端去信號肽的1 000 bp 的片段,構建了糖蛋白基因的DNA 疫苗,肌肉注射后魚體產生體液免疫應答和細胞免疫應答,免疫組相對保護率為22%。Emmenegger 等[34]利用分離至北美的鯉春病毒G 蛋白基因構建了DNA 疫苗,冷水刺激環境下進行攻毒試驗,結果表明DNA 疫苗可明顯降低感染鯉魚的死亡率,相對免疫保護率為50%-88%。從試驗結果來看,該DNA 疫苗具有良好的免疫原性,可作為鯉魚和其他北美魚種的預防性疫苗。Kanellos 等[35]構造了鯉春病毒 G 蛋白基因的DNA 疫苗,金魚免疫試驗表明,50%以上試驗魚出現特異性免疫反應,攻毒試驗表明疫苗相對免疫保護率為48%。此外,還證明使用含CMV-Intron A 啟動子的質粒以及加入先導序列mGM-CSF 和CpG 可明顯加強疫苗的保護功效。
如何克服DNA 疫苗的低免疫原性及確保疫苗安全性是研制高效DNA 疫苗的關鍵。為了提高DNA疫苗免疫應答效果,國內外學者在替換啟動子、優化免疫佐劑[36]以及改造宿主等方面進行研究,而DNA 疫苗安全性的討論主要圍繞在外源基因染色體整合問題及可能引發的自身免疫反應。
4 展望
對于G 蛋白結構、功能研究已取得初步進展,但到目前為止,其作用機理的研究還很缺乏。就目前的研究成果來看,G 蛋白是鯉春病毒主要的表面抗原,在病毒侵染宿主的過程中發揮重要作用,可以作為抗病毒藥物作用的靶點。已有研究證實:針對G 蛋白的單克隆抗體具有中和活性,能消除病毒的感染能力[37]。但探討G 蛋白介導病毒入胞的作用機理、制備抗G 蛋白的單克隆抗體具有重要意義,將有助于開發新型病毒診斷試劑及制備高效免疫保護疫苗。在以后的研究中應考慮以下幾個方面的問題:(1)加深對蛋白結構、功能及作用機理的研究;(2)利用生物信息學技術分析G 蛋白的抗原表位;(3)尋找G 蛋白突變影響病毒變異的直接證據。隨著各種技術手段的不斷提高,G 蛋白將在病毒檢測、抗病毒研究等方面體現更大的應用價值。
[1] Fijan N. Spring viremia of carp and other viral diseases of warmwater fish[J]. Fish Diseases and Disorders, 1999, 3:177-244.
[2] 王姝, 張利峰, 徐立蒲. 鯉春病毒核酸檢測方法研究進展[J]. 檢驗檢疫學刊, 2012, 22(3):49-51.
[3] Ahne W, Bjorklund H, Essbauer S, et al. Spring viremia of carp(SVC)[J]. Dis Aquat Organ, 2002, 52:261-272.
[4] Jorgensen PEV, Olesen NJ, Ahne W, et al. SVCV and PFR viruses:serological examination of 2 isolates indicates close relationship between the two fish rhabdoviruses[M]. Viruses of Lower Vertebrates, 1989:349-366.
[5] 劉葒, 付峰, 黃倢. 鯉春病毒血癥病毒中國分離株糖蛋白基因和氨基酸序列的初步解析[J]. 中國病毒學, 2005, 20(6):647-651.
[6] Padhi A, Verghese B. Detecting positively selected codons in the glycoprotein of spring viremia of carp virus(SVCV)isolates from the USA and China[J]. J Fish Dis, 2008, 31:785-791.
[7] Hoffmann B, Schutze H, Mettenleiter T. Determination of the complete genomic sequence and analysis of the gene products of the virus of Spring Viremia of Carp, a fish rhabdovirus[J]. Virus Res, 2002(84):89-100.
[8] Roche S, Albertini J. Structures of vesicular stomatitis virus glycoprotein :membrane fusion revisited[J]. Cellular and Molecular Life Sciences, 2008(65):1716-1728.
[9] Hill B, Underwood B, Smale C, et al. Physico-chemical and serological characterization of five rhabdoviruses infecting fish[J]. Journal of General Virology, 1975, 27(3):369-378.
[10] Clerx J, Horzinek M. Comparative proteinanalysis of non-salmonid fish rhabdoviruses[J]. J Gen Virol, 1978, 40(2):287-295.
[11] 孫芳, 李玉霞. 病毒入胞機制研究方法及其研究進展[J]. 微生物學通報, 2010(1):46-50.
[12] Corbeil S, Lapatra S, Anderson E. Naked DNA vaccination of Atlantic Salmon Psalm to salar against IHNV[J]. Dis Aquat Org, 1999, 39:29-36.
[13] Stone DM, Ahne W, Denham KL. Nucleotide sequence analysis of the glycoprotein gene of putative spring viraemia of carp virus andpike fry rhabdovirus isolates reveals four genogroups[J]. Dis Aquat Org, 2003, 53:203-210.
[14] Gaudin Y, de Kinkelin P, Benmansour A. Mutations in the glycoprotein of viral haemorrhagic septicaemia virus that affect virulence for fish and the pH threshold for membrane fusion[J]. J Gen Virol, 1999, 80:1221-1229.
[15] 張志榜, 陳建飛. 豬流行性腹瀉病毒M 蛋白單克隆抗體的制備及鑒定[J]. 中國預防獸醫學報, 2011, 33(7):568-570.
[16] 張月, 蘭鄒然. 豬瘟病毒基因組蛋白結構及蛋白表達技術的研究進展[J]. 中國畜禽種業, 2012, 10:54-57.
[17] 張琳, 丁雅苓, 陳建民, 等. 中國鯉魚春季病毒血癥毒株糖蛋白基因的亞克隆表達與純化[J]. 中國獸醫雜志, 2011, 47(7):10-12.
[18] 楊振慧. 鯉春病毒血癥病毒外膜蛋白G 和基質蛋白M. 的原核表達及多克隆抗體的制備[D]. 福州:福建師范大學, 2011:1-44.
[19] 范翠英, 馮利興, 范金玲. 重組蛋白表達系統的研究進展[J]. 生物技術, 2012, 22(2):76-80.
[20] 劉高強, 章克昌, 王曉玲. 昆蟲桿狀病毒表達系統的研究與應用進展[J]. 中國生物工程雜志, 2004, 24(7):40-43.
[21] Huang FT, Li Qin, Cui XX, et al. Characterization of Spring Viremia of Carp virus glycoprotein expressed by recombinant baculovirus[J]. Pak Vet J, 2012, 32(3):334-338.
[22] 楊梅, 溫真, 林麗玉. 畢赤酵母蛋白表達系統研究進展[J]. 生物技術通報, 2011(4):46-51.
[23] 付峰, 劉葒. 鯉春病毒血癥病毒的克隆及其在畢赤酵母中的初步表達[J]. 海洋水產研究, 2007, 28(4):72-76.
[24] 高隆英, 史秀杰, 劉葒. 用RT-PCR 法快速檢測鯉春病毒血癥病毒基因[J] . 水生生物學報, 2002, 26(5):452-456.
[25] Kim HJ. Improved diagnosis of spring viremia of carp by nested reverse-transcription PCR:development of a chimeric positive control for prevention of false-positive diagnosis[J]. J Virol Methods, 2012, 185(1):39-42.
[26] Koutná M, Vesely T, Psikal I, et al. Identification of spring viraemia of carp virus(SVCV)by combined RT-PCR and nested PCR[J]. Dis Aquat Organ, 2003, 55(3):229-235.
[27] 張利峰, 張鶴曉, 喬衛虹. 熒光RT-PCR 檢測魚類鯉春病毒血癥病毒的研究[J]. 檢驗檢疫科學, 2005, 6:22-25.
[28] 劉宗曉, 劉葒, 李慧芳, 等. 一步法環媒恒溫擴增(RT-LAMP)技術檢測鯉春病毒血癥病毒(SVCV)方法的建立和應用[C]. 2007 年中國水產學會學術年會暨水產微生態調控技術論壇論文摘要匯編, 2007.
[29] Shivappa R, Savan T, Kono T, et al. Detection of spring viraemia of carp virus(SVCV)by loop-mediated isothermal amplification(LAMP)in koi carp, Cyprinus caipio L. [J]. J Fish Diseases, 2008, 31(4):249-258.
[30] Liu ZX, Teng Y, Liu H, et al. Simultaneous detection of three fish rhabdoviruses using multiplex real-time quantitative RT-PCR assay[J]. J Virol Methods, 2008, 149(1):103-109.
[31] 馬文婷, 張麗. 鯉春病毒血癥的診斷及疫苗研究展望[J]. 天津水產, 2008(3):28-31.
[32] 許大明, 漢麗梅, 劉丹. DNA 疫苗在動物疾病預防中的研究進展[J]. 獸醫研究, 2010(1):12-15.
[33] 歐陽征亮. 鯉春病毒血癥病毒(SVCV)糖蛋白DNA 疫苗的構建及免疫效果的評估[D]. 廣州:中山大學, 2006:1-76.
[34] Emmenegger EJ, Kurath G. DNA vaccine protects ornamental koi(Cyprinuscarpio koi)against North American spring viremia of carp[J]. Vaccine, 2008, 26(50):6415-6421.
[35] Kanellos T, Sylvester ID, D'Mello F, et al. DNA vaccination can protect cyprinus carpio against spring viraemia of carp virus[J]. Vaccine, 2006, 24(23):4927-4933.
[36] 白志坤, 馮新暢. DNA 疫苗免疫機制及預防新城疫病毒的研究進展[J]. 東北農業大學學報, 2007, 38(3):416-419.
[37] Chen ZY, Liu H, Li ZQ, et al. Development and charaeterization of monoclonal antibodies to spring viraemia of carp virus[J]. Vet Immunol Immunopathol, 2008, 123(3-4):266-276.

