利用Tol2 轉座子構建轉基因草金魚初探
董穎 胡紅霞 王巍 田照輝
(北京市水產科學研究所暨國家淡水漁業工程技術研究中心 農業部都市農業(北方)重點實驗室,北京 100068)
轉座子(transposon)是基因組上的一段具有一定長度的DNA 序列,其在自身編碼的轉座酶或逆轉錄酶的作用下,以“剪切/復制-粘貼”的方式在基因組中進行移動[1]。自1951 年McClintock[2]首次在玉米中發現AC/Ds(Activator/Dissociator)轉座子以來,在細菌及多種真核生物中均發現有轉座子的存在[3-6]。但是長期以來,對脊椎動物中轉座子的研究和應用都還是空白。直到近十幾年才有青鳉Tol1 和Tol2[7,8]、鮭魚SB[9]以及金魚Tgf2[10]等幾例魚類活性轉座子發現的報道。
青鳉Tol2 轉座子(Transposable element of Oryzias latipes,number 2)是脊椎動物中發現的第一例天然具有活性的轉座子。Tol2 轉座子屬于hAT 超轉座子家族,其自身包含編碼轉座酶的基因,能以“剪切-粘貼”的方式進行自主轉座。自被發現以來,Tol2轉座子已被成功應用于果蠅[11]、斑馬魚[12]、非洲爪蟾[13]和小鼠[14]等模式生物的轉基因研究中,證明其具有一定的通用性。但是,Tol2 轉座子在金魚中的應用還未見報道。本研究采用PCR 的方法以質粒pCAgcGH 為模板擴增出一段含有草魚生長激素(GH)5 個外顯子、鯉魚beta-actin 啟動子及多個酶切位點的序列,并將這段序列與質粒pTol2-MCSEGFP 進行重組,得到重組質粒pTol2-GH-EGFP。采用顯微注射的方法將重組質粒pTol2-GH-EGFP 與體外合成的Tol2 轉座酶mRNA 一起注入草金魚受精卵中,獲得表達GH 基因和綠色熒光蛋白的轉基因草金魚。利用Tol2 轉座子構建轉基因草金魚。
1 材料與方法
1.1 材料
1.1.1 試驗動物 試驗用草金魚(Carassius auratus)購買自北京市通州區水產技術推廣站。
1.1.2 主要試劑與試劑盒 內切酶BamH I、Xho I和Not I 購自NEB 公司。質粒提取試劑盒購自Omega 公司。膠回收試劑盒和基因組DNA 提取試劑盒購自Axygen 公司。mRNA 體外合成試劑盒(mMESSAGE mMACHINE? SP6 Kit)購自Invitrogen 公司。10×Holf’s 儲 存 液:將1 g CaCl、20.5 g KCl 和3.5 g NaCl 加蒸餾水至1 L,煮沸儲存。用時將10×儲存液稀釋至1×工作液,用氣泵曝氣過夜,并加入終濃度為10 萬單位/L 的青霉素和5 萬單位/L 的鏈霉素。使用1×Holf’s 工作液配置50 μg/mL 的胰酶溶液。
1.1.3 質粒載體 質粒pTol2-MCS-EGFP、pCSTol2由北京大學趙玨老師贈送;質粒pCAgcGH 由中科院水生生物研究所胡煒研究員提供。
1.1.4 主要儀器 凝膠成像系統為Bio-RAD 公司Gel Doc 2000 型產品,顯微注射儀為ASI 公司MPPI3型產品,熒光顯微成像系統為OLYMPUS 公司DP72型產品。
1.2 方法
1.2.1 載體構建 質粒pTol2-MCS-EGFP 含有綠色熒光蛋白基因GFP、Tol2 轉座子和多個酶切位點。質粒pCAgcGH 含有草魚生長激素基因(GH)的5 個外顯子、鯉魚beta-actin 啟動子及多個酶切位點。因為質粒pTol2-MCS-EGFP(保留GFP 和Tol2 轉座子序列)和質粒pCAgcGH(保留GH 的5 個外顯子和鯉魚beta-actin 啟動子)待保留區域之間只有一個共同的酶切位點BamH I,所以針對質粒pCAgcGH 序列設計PCR 引物,從BamH I 酶切位點開始,跨GH的5 個外顯子,并加酶切位點Xho I 的接頭,引物序列為TGATGAAAATCGCTTAGGGA 和CCGCTCGAGAGGCTTTACACTTTATGCTT。使用上述引物對質粒pCAgcGH 進行擴增,使用膠回收試劑盒回收PCR 產物。再對回收后的擴增產物進行BamH I/Xho I 雙酶切。純化后與同樣經雙酶切處理的質粒pTol2-MCSEGFP 過夜連接,獲得重組質粒,命名為pTol2-GHEGFP。根據質粒pCAgcGH 保留區序列及插入方向,設計一對檢測引物,序列為CGCAACCCTCAGGTAAGT 和TCTTCAACAACGCAGTCA。將重組質粒pTol2-GH-EGFP 轉入大腸桿菌DH10B 感受態細胞,涂于LB 平板培養基過夜培養,選取氨芐陽性的單克隆接入LB 液體培養基,并使用檢測引物對菌液進行擴增驗證,使用質粒提取試劑盒從可以成功擴增檢測引物的菌株中提取質粒pTol2-GH-EGFP,并進行測序驗證。
1.2.2 轉座子mRNA 的合成 使用Not I 內切酶對質粒pCSTol2 進行酶切,使其線性化,用SP6 RNA聚合酶在體外轉錄合成Tol2 轉座酶mRNA。
1.2.3 轉基因草金魚的獲得及驗證 選取自然性成熟的雌雄草金魚,采用人工干法授精的方式獲得受精卵。將受精卵置于1×Holf’s 工作液,受精后約2-3 min 開始舉膜,待舉膜比較完全后將Holf’s 工作液替換為胰酶溶液溶解卵膜,待卵脫膜以后用Holf’s 工作液清洗幾次,將其轉移到提前鋪好瓊脂糖并加有Holf’s 工作液的表面皿里。將質粒pTol2-GH-EGFP 與體外合成的Tol2 轉座酶mRNA 按終濃度100 ng/μL 和70 ng/μL 進行混合,在受精卵第一次卵裂前,通過顯微注射的方法注射入動物極。之后將卵轉移到18℃的1×Holf’s 工作液中培養,魚苗孵出后,在熒光顯微鏡下挑選發出綠色熒光的個體,獲得轉基因草金魚。孵化2 周后,取幾尾能發出綠色熒光的魚苗,使用基因組DNA 提取試劑盒提取DNA,并以此為模板使用檢測引物進行PCR,檢驗其中是否含有轉入的外源基因。
2 結果
2.1 載體構建
設計PCR 引物擴增出質粒pCAgcGH 的一段序列,同時引入Xho I 酶切位點,得到4 330 bp 的擴增產物。回收并純化PCR 產物,再進行BamH I/Xho I 雙酶切,之后與經同樣雙酶切處理的質粒pTol2-MCS-EGFP 進行連接,獲得重組質粒pTol2-GHEGFP。雙酶切電泳分析結果見圖1。
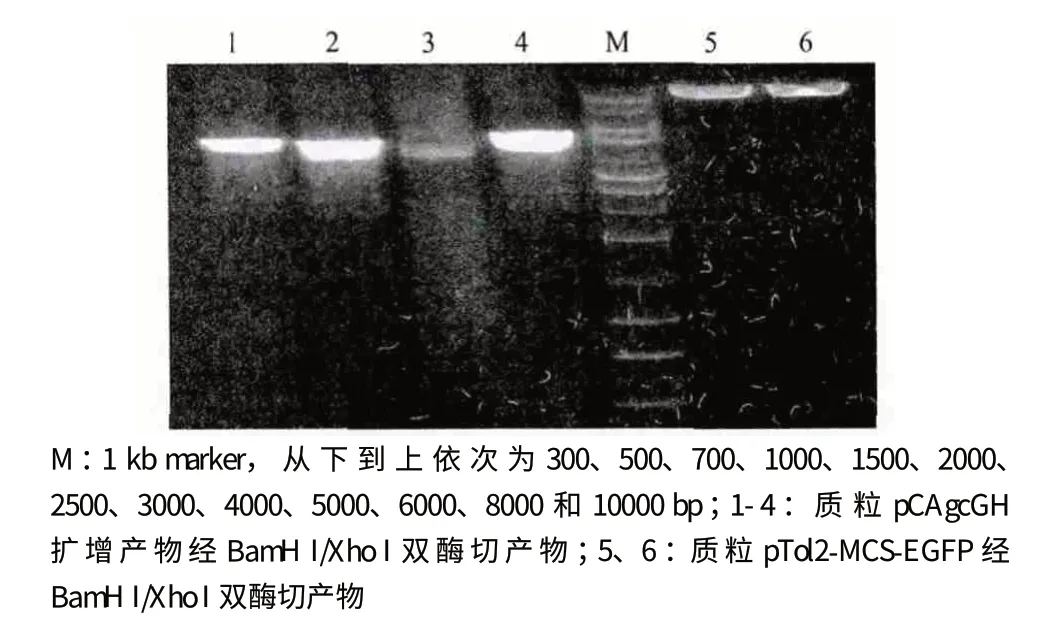
圖1 質粒pCAgcGH 擴增產物和質粒pTol2-MCS-EGFP的雙酶切鑒定
2.2 載體驗證及陽性轉基因魚檢測
將重組質粒pTol2-GH-EGFP 轉入大腸桿菌DH10B 感受態細胞,挑選氨芐陽性的菌落,使用本實驗設計的草魚GH 檢測引物進行PCR 擴增,得到長度為1 580 bp 的擴增產物,證明重組質粒中包含有GH 基因,結果見圖2 泳道1-5。設計測序引物對重組質粒pTol2-GH-EGFP(圖3)進行測序,確保其中即含有Tol2 轉座子和綠色熒光蛋白(GFP)基因,又含有草魚生長激素(GH)基因的5 個外顯子。取3 尾能發出綠色熒光的轉基因魚提取基因組DNA,以此為模板使用同樣的檢測引物進行PCR,得到長度為1 580 bp 的擴增產物,證明其中均含有轉入的外源基因,結果見圖2 泳道6-8。
2.3 轉基因草金魚的獲得及驗證
在紫外光下,最早可以于受精后21.5 h 觀察到部分胚胎發出微弱的綠色熒光。在進行了顯微注射的150 粒受精卵中共有133 尾仔魚成功孵化,其中有26 尾可以在紫外光下觀察到綠色熒光,占總數的17.3%。圖4 為不同時期的轉基因草金魚熒光檢測結果。
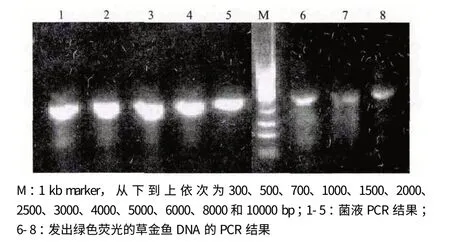
圖2 重組質粒pTol2-GH-EGFP 菌液及轉基因魚外源基因檢驗結果
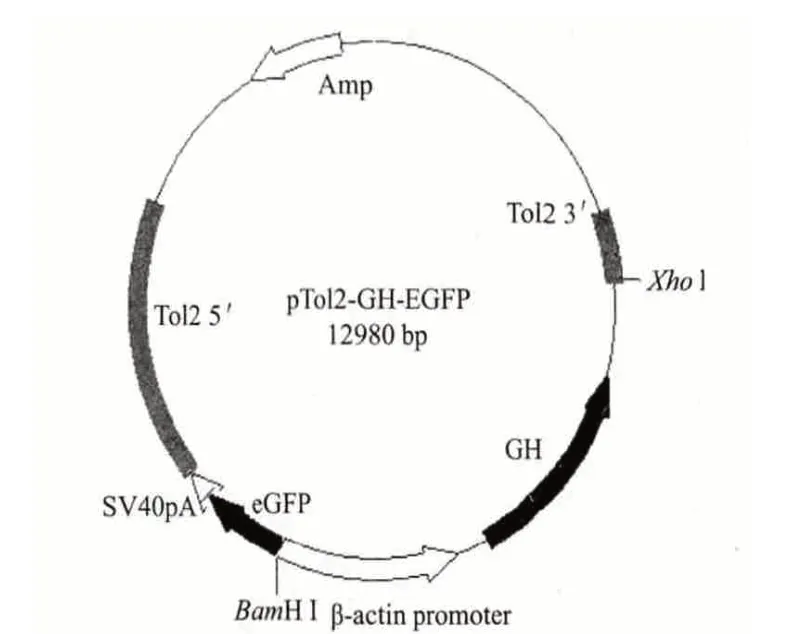
圖3 質粒pTol2-GH-EGFP 圖譜
3 討論
3.1 轉基因方法的比較
自朱作言等[15]利用顯微注射法首次成功構建轉基因魚模型以來,顯微注射法就被廣泛應用于魚類轉基因研究中。除此之外,電脈沖(電穿孔)法[16]和精子載體法[17]也是比較常用的魚類轉基因方法。另外,還有磷酸鈣共沉淀、脂質體融合、逆轉錄病毒轉染、微彈轟擊、激光介導和基因槍(粒子槍)等多種方法可以將外源基因導入受體細胞[18]。
顯微注射法是目前被使用最多的轉基因操作方法,它具有轉基因陽性率較高的優點,但同時對試驗者的操作技能要求較高,而且因為要在第一次卵裂前完成注射,所以一批次只能處理比較少的卵,相對費時費力。而電脈沖法雖然陽性率略低[19],但一次可以處理大量受精卵,且試驗操作簡單,省時省力。精子載體法不會對卵造成機械損傷,外源基因導入與受精過程同步完成,但是由于精子載體法的作用機理尚不明確,導入的外源基因可能會被降解或不能整合到基因組中去,而是更多的以附加體的形式存在[20],且轉基因陽性率差異巨大,難以控制。
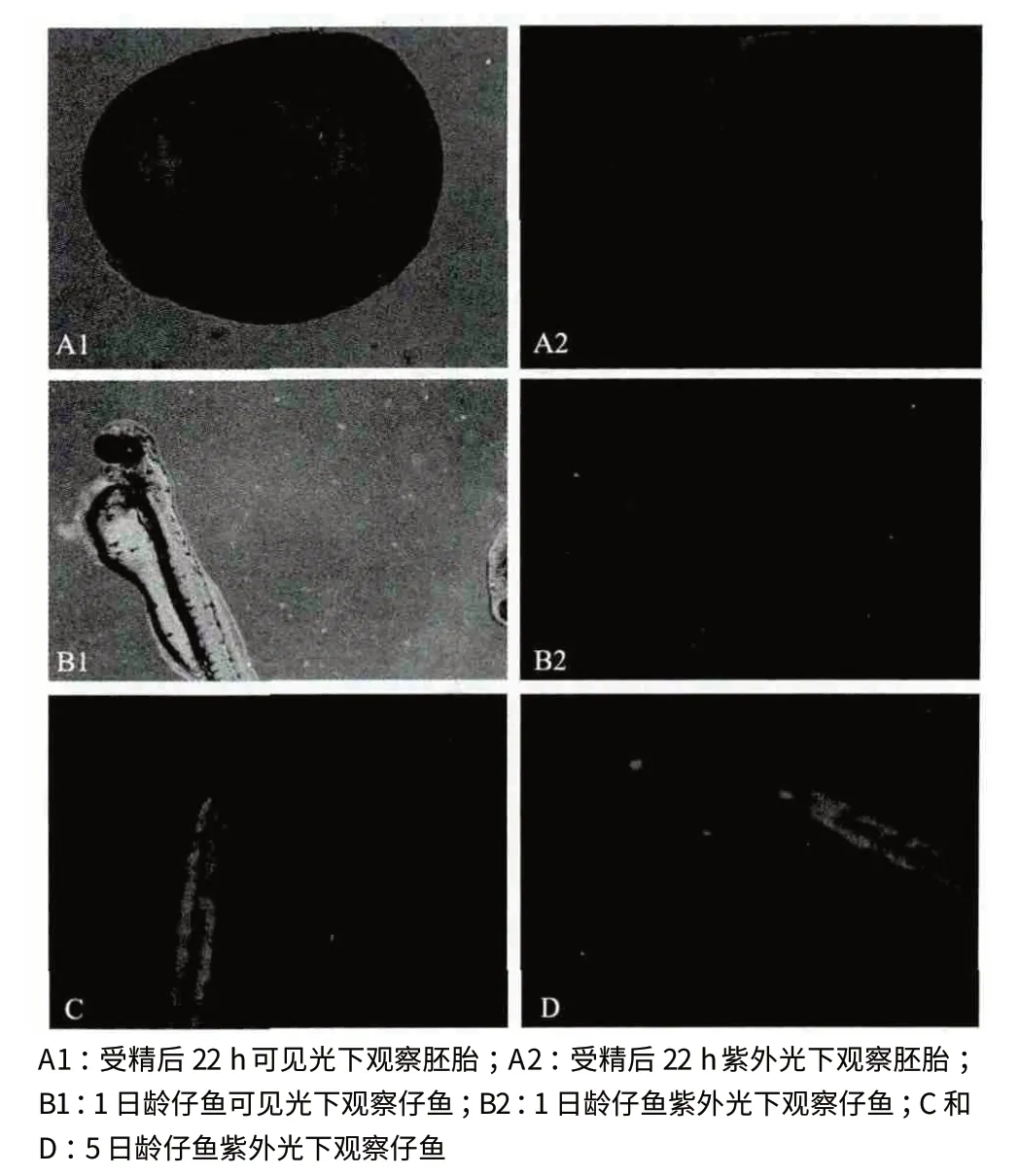
圖4 胚胎及仔魚期轉基因草金魚熒光檢測結果
Sumiyama 等[21]首次將攜帶有外源基因的Tol2轉座子載體與體外合成的轉座酶mRNA 一起注射入小鼠受精卵的細胞質中,該方法可以較大幅度的提高外源基因的整合效率。本研究首次用此方法構建金魚轉基因方法,外源基因的表達率為17.3%,與Sumiyama 等[21]的20%陽性檢出率差異不大,都顯著高于常規顯微注射轉基因方法2%-5%的陽性檢出率。
3.2 青鳉Tol2轉座子的研究和應用
Tol2 轉座子是日本學者在對正常日本青鳉(Oryzias latipes)與其白化變種的酪氨酸酶基因進行比較分析時發現的[8],它是脊椎動物中發現的第一例天然具有活性的轉座子。Tol2 轉座子屬于hAT 轉座子超家族,這個轉座子超家族還包括玉米的Ac 轉座子[22]、果蠅的hobo 轉座子[23]、金魚草的Tam3轉座子[24]和金魚的Tgf2 轉座子[10]。Tol2 轉座子全長4 681 bp,其自身包含一個由4 個外顯子構成的編碼轉座酶的基因,它能翻譯成一個含有649 個氨基酸的蛋白質,并催化Tol2 轉座子以“剪切-粘貼”的方式在基因組中進行自主移動[8,25]。利用Tol2 轉座子開展魚類轉基因研究,轉基因效率較高,可攜帶大片段外源基因轉入,畸形率較低,整合位點便于檢測,同時不會引入質粒骨架而干擾魚類正常基因的表達。
Kawakami 等[26]以綠色熒光蛋白基因GFP 作為報告基因,通過顯微注射將帶有Tol2 轉座子和GFP基因的質粒和人工合成的編碼轉座酶的mRNA 一起注入到斑馬魚受精卵中,使轉座子穩定地整合到基因組中,挑選含有外源基因的轉基因斑馬魚作為親本與野生型進行雜交,檢測F1 代發現有50%-70%為轉基因陽性。上述試驗表明外源基因通過Tol2 轉座子整合到宿主基因組上,并可以遺傳到下一代。在對呂宋青鳉(O. luzonensis)(日本青鳉的近緣種,但是自身不含Tol2 轉座子)的類似試驗中也獲得了相同的結果[27]。此外,Tol2 轉座子也被成功應用于果蠅[11]、非洲爪蟾[13]、雞[28]和小鼠[14]等動物的轉基因研究中。
利用Tol2 轉座子可以構建具有組織特異表達能力的轉基因載體,如脊髓特異表達[29]或心臟組織特異表達[30]轉基因斑馬魚家系的建立就對研究這兩個組織的發育調控和基因表達具有重要意義。
Kawakami 等[31]利用Tol2 轉座子對斑馬魚進行基因捕獲研究,他們將帶有報告基因GFP 的重組質粒隨機整合到斑馬魚基因組中,然后通過反向PCR 的方法鑒定了捕獲載體插入位點上下游的基因序列,再利用RACE 的方法獲得了8 種報告基因與內源基因的融合轉錄本。Parinov 等[32]利用Tol2 轉座子進行斑馬魚增強子捕獲,以增強型綠色熒光蛋白(EGFP)基因為報告基因挑選出37 個陽性魚苗,并以此為基礎分離出28 個轉基因斑馬魚家系用以研究斑馬魚的體內發育調控。Asakawa 和Kawakami[33]利用上游激活序列(Upstream activating sequence,UAS)的轉錄激活因子Gal4FF 構建載體進行基因捕獲與增強子捕獲,當有內源基因被捕獲時轉錄激活因子得以表達,而將基因捕獲個體與帶有報告基因的轉基因斑馬魚品系UAS-GFP 雜交后,轉錄激活因子可以刺激報告基因強烈表達。
目前,Tol2 轉座子已經被成功應用于包括昆蟲、兩棲類、魚類、鳥類以及哺乳動物等多種動物的轉基因表達、基因捕獲以及增強子捕獲等方面的研究中,其中在模式生物斑馬魚上的研究成果最多。本研究利用Tol2 轉座子成功構建轉基因草金魚,擴大了Tol2 轉座子的應用范圍,并為進一步開展關于基因捕獲及其功能等方面的研究奠定了基礎。
3.3 Tol2轉座子對金魚轉基因陽性率的影響
Liu 等[34]利用顯微注射法將含有豬生長激素基因的線性DNA 片段注入金魚受精卵,其轉基因陽性率為2%。劉艷紅等[35]采用顯微注射的方法將綠色熒光蛋白(GFP)基因重組表達質粒導入金魚受精卵中,3 批試驗獲得的轉基因陽性率分別為4.24%、8.51%和6.77%。胡瑩瑩等[36]利用精子載體法通過昆蟲piggyBac 轉座子介導成功獲得轉基因金魚,但是其陽性率極低(小于1%)。而本試驗通過顯微注射法將帶有Tol2 轉座子和外源基因的質粒與體外合成的Tol2 轉座酶mRNA 一起注入到金魚受精卵中,獲得轉基因金魚的陽性率為17.3%,顯著高于未使用Tol2 轉座子介導的轉基因方法,說明Tol2 轉座子在構建轉基因金魚的過程中有助于提高轉基因效率。另外,利用新發現的金魚Tgf2 轉座子系統開展金魚轉基因試驗獲得的熒光率為83%[37],這可能是由于金魚受精卵的細胞質中具有內源性的Tgf2 轉座酶mRNA,而大量的轉座酶mRNA 有助于提高轉座子的轉座效率。因此,可嘗試通過加大Tol2 轉座酶mRNA 的注射量來提高其在金魚中的轉基因陽性率。另外,外源基因的注射濃度以及質粒與轉座酶mRNA 的混合比例也將在進一步試驗中進行調整,以期提高外源基因的表達陽性率。
3.4 青鳉Tol2轉座子與金魚Tgf2轉座子的比較
2010 年,鄒曙明等[10]在我國不同品系金魚中發現hAT 家族的一個新成員,命名為金魚Tgf2 轉座子,它是脊椎動物中發現的第二例具有自主活性的轉座子。金魚Tgf2 轉座子全長4720 bp,由4 個閱讀框組成,它與青鳉Tol2 轉座子的序列相似度為97%,且都含有末端倒位重復、亞末端重復和內含子中間倒位重復序列。但是兩者的末端倒位重復和亞末端重復序列存在一定差異,而這一區域恰好與轉座子的轉座活性密切相關[38]。另外,金魚Tol2轉座子第一內含子的1 453 bp 到2 091 bp 區域為反向重復序列,與青鳉Tol2 轉座子中間反向重復序列可形成莖環結構不同,Tgf2 轉座子的中間反向重復序列可形成“十”字結構,這也可能對其轉座活性產生影響。目前,對金魚Tgf2 轉座子的研究尚處于起步階段。考慮到Tol2 轉座子和Tgf2 轉座子的相似性,Tol2 轉座子在金魚中的應用將對研究Tgf2 轉座子具有一定的積極作用。同時,對二者的比較研究也將有助于了解轉座子序列及結構的功能。
4 結論
本研究采用PCR 的方法以質粒pCAgcGH 為模板擴增出一段含有草魚生長激素(GH)5 個外顯子、鯉魚beta-actin 啟動子及多個酶切位點的序列,并將這段序列與質粒pTol2-MCS-EGFP 進行重組,得到重組質粒pTol2-GH-EGFP。采用顯微注射的方法將重組質粒pTol2-GH-EGFP 與體外合成的Tol2 轉座酶mRNA 一起注入草金魚受精卵中,獲得表達GH基因和綠色熒光蛋白的轉基因草金魚,表達率為17.3%。
致謝:
感謝中科院水生生物研究所胡煒研究員提供草魚GH 質粒;感謝北京大學朱作言院士實驗室趙玨博士提供的Tol2 轉座子及實驗過程中給與的幫助。
[1] Curcio MJ, Derbyshire KM. The outs and ins of transposition:from mu to kangaroo[J]. Nature Reviews Molecular Cell Biology, 2003, 4(11):865-877.
[2] McClintock B. Chromosome organization and genic expression[J]. Cold Spring Harbor Symposia on Quantitative Biology, 1951, 16:13-47.
[3] Franz G, Savakis C. Minos, a new transposable element from Drosophila hydei, is a member of the Tc1-like family of transposons[J]. Nucleic Acids Research, 1991, 19(23):6646.
[4] Hirochika H, Fukuchi A. Transposable elements in rice plants [J]. Jpn Agr Res Q, 1992, 25:230-237.
[5] Amutan M, Nyyssonen E, Stubbs J, et al. Identification and cloning of a mobile transposon from Aspergillus niger var. awamori[J]. Current Genetics, 1996, 29(5):468-473.
[6] Nagy Z, Chandler M. Regulation of transposition in bacteria[J]. Research in Microbiology, 2004, 155:387-398.
[7] Koga A, Inagaki H, Bessho Y, et al. Insertion of a novel transposable element in the tyrosinase gene is responsible for an albino mutation in the medaka fish, Oryzias latipes[J]. Molecular and General Genetics, 1995, 249(4):400-405.
[8] Koga A, Suzuki M, Inagaki H, et al. Transposable element in fish[J]. Nature, 1996, 383:30.
[9] Ivics Z, Hackett PB, Plasterk RH, et al. Molecular reconstruction of sleeping beauty, a Tc1-like transposon from fish, and its transposition in human cells[J]. Cell, 1997, 91:501-510.
[10] 鄒曙明, 杜雪地, 袁劍, 等. 金魚hAT 家族轉座子Tgf2 的克隆及其結構[J]. 遺傳, 2010, 32:1203-1208.
[11] Urasaki A, Mito T, Noji S, et al. Transposition of the vertebrate Tol2 transposable element in Drosophila melanogaster[J]. Gene, 2008, 425:64-68.
[12] Kawakami K, Koga A, Hori H, et al. Excision of the Tol2 transposable element of the medaka fish, Oryzias latipes, in zebrafish, Danio rerio[J]. Gene, 1998, 225:17-22.
[13] Kawakami K, Imanaka K, Itoh M, Taira M. Excision of the Tol2 transposable element of the medaka fish Oryzias latipes in Xenopus laevis and Xenopus tropicalis[J]. Gene, 2004, 338(1):93-98.
[14] Kawakami K, Noda T. Transposition of the Tol2 element, an Ac-like element from the Japanese medaka fish Oryzias latipes, in mouse embryonic stem cells[J]. Genetics, 2004, 166(2):895-899.
[15] 朱作言, 許克圣, 謝岳峰, 等. 轉基因魚模型的建立[J]. 中國科學(B 輯), 1989, 2:147-155.
[16] 謝岳峰, 劉東, 鄒鈞, 等. 泥鰍受精卵的電脈沖基因轉移[J]. 水生生物學報, 1989, 13(4):387-389.
[17] 于建康, 閻維. 精子介導魚類基因轉移和聚合酶鏈反應檢測技術[J]. 動物學報, 1994, 40(1):96-99.
[18] 朱作言, 汪亞平. 轉基因魚. 生物學通報[J] , 1999, 34(5):1-3.
[19] 柳曉瑜, 王豪博, 仇雪梅, 等. 斑馬魚兩種轉基因方法的比較[J]. 生物技術通報, 2011(12):205-209.
[20] Nakanishi A, Iritani A. Gene transfer in the chicken by sperm-mediated methods[J]. Molecular Reproduction and Development, 1993, 36:358-261.
[21] Sumiyama K, Kawakami K, Yagita K. A simple and highly efficient transgenesis method in mice with the Tol2 transposon system and cytoplasmic microinjection[J]. Genomics, 2010, 95(5):306-311.
[22] Rosen E, Sivertsen A, Firtel RA. An unusual transposon encoding heat shock inducible and developmentally regulated transcripts in Dictyostelium[J]. Cell, 1983, 35(1):243-251.
[23] Streck RD, MacGaffey JE, Beckendorf SK. The structure of hobo transposable elements and their insertion sites[J]. The EMBO Journal, 1986, 5(13):3615-3623.
[24] Sommer H, Carpenter R, Harrison RJ, et al. The transposable element Tam3 of Antirrhinum majus generates a novel type of sequence alterations upon excision[J]. Molecular and General Genetics MGG, 1985, 199(2):225-231.
[25] Kawakami K. Tol2:a versatile gene transfer vector in vertebrates[J]. Genome Biology, 2007, 8(Suppl 1):S7.
[26] Kawakami K, Shima A, Kawakami N. Identification of a functional transposase of the Tol2 element, an Ac-like element from the Japanese medaka fish, and its transposition in the zebrafish germ lineage[J]. Proceedings of the National Academy of Sciences, 2000, 97(21):11403-11408.
[27] Koga A, Hori H, Sakaizumi M. Gene transfer and cloning of flanking chromosomal regions using the medaka fish Tol2 transposable element[J]. Marine Biotechnology, 2002, 4(1):6-11.
[28] Sato Y, Kasai T, Nakagawa S, et al. Stable integration and conditional expression of electroporated transgenes in chicken embryos[J]. Developmental Biology, 2007, 305(2):616-624.
[29] Suster ML, Kikuta H, Urasaki A, et al. Transgenesis in zebrafish with the Tol2 transposon system[M]//Cartwright EJ. Transgenesis Techniques, Humana Press, 2009, 561:41-63.
[30] 陳婷芳, 羅娜, 謝華平, 等. 利用Tol2 轉座子構建斑馬魚心臟組織特異表達轉基因載體及其表達分析[J]. 生物工程學報, 2010, 26(2):230-236.
[31] Kawakami K, Takeda H, Kawakami N, et al. A transposon-mediated gene trap approach identifies developmentally regulated genes in zebrafish[J]. Developmental Cell, 2004, 7(1):133-144.
[32] Parinov S, Kondrichin I, Korzh V, et al. Tol2 transposon-mediated enhancer trap to identify developmentally regulated zebrafish genes in vivo[J]. Developmental Dynamics, 2004, 231(2):449-459.
[33] Asakawa K, Kawakami K. The Tol2-mediated Gal4-UAS method for gene and enhancer trapping in zebrafish[J]. Methods, 2009, 49(3):275-281.
[34] Liu GS, Zhang ZH, et al. Study on integration, expression and biological effects of porcine growth hormone gene in transgenic goldfish[J]. Developmental and Reproductive Biology, 1998, 7(1):25-31.
[35] 劉艷紅, 肖調義, 蘇建明, 等. 用顯微注射法將綠色熒光蛋白基因導入金魚受精卵中表達[J]. 上海水產大學學報, 2002, 11(2):102-105.
[36] 胡瑩瑩, 郭學雙, 周陽, 等. piggyBac 轉座子在金魚及泥鰍轉基因中的應用[J]. 水產學報, 2012, 36(10):1473-1481.
[37] 杜雪地. 金魚Tgf2 轉座子的研究及其轉基因應用[D]. 上海:上海海洋大學, 2011.
[38] Urasaki A, Morvan G, Kawakami K. Functional dissection of the Tol2 transposable element identified the minimal cis-sequence and a highly repetitive sequence in the sub-terminal region essential for transposition[J]. Genetics, 2006, 174(2):639-649.

