加熱速率對(duì)雞胸肉勻漿物凝膠特性影響
代佳佳,韓敏義,徐幸蓮,*,周光宏
(1.皖南醫(yī)學(xué)院,安徽 蕪湖 241002;2. 南京農(nóng)業(yè)大學(xué) 食品安全與營(yíng)養(yǎng)協(xié)同創(chuàng)新中心,農(nóng)業(yè)部畜產(chǎn)品加工重點(diǎn)實(shí)驗(yàn)室,江蘇 南京 210095)
加熱速率對(duì)雞胸肉勻漿物凝膠特性影響
代佳佳1,2,韓敏義2,徐幸蓮2,*,周光宏2
(1.皖南醫(yī)學(xué)院,安徽 蕪湖 241002;2. 南京農(nóng)業(yè)大學(xué) 食品安全與營(yíng)養(yǎng)協(xié)同創(chuàng)新中心,農(nóng)業(yè)部畜產(chǎn)品加工重點(diǎn)實(shí)驗(yàn)室,江蘇 南京 210095)
分別采用慢速加熱1 ℃/min和快速加熱2 ℃/min的速率,對(duì)雞胸肉勻漿物進(jìn)行加熱,使其最終中心溫度分別達(dá)到65、70、75、80、85 ℃。結(jié)果發(fā)現(xiàn):加熱方式對(duì)雞胸肉勻漿物凝膠的保水性有顯著影響(P<0.05),對(duì)雞胸肉凝膠硬度有極顯著影響(P<0.01);以1 ℃/min進(jìn)行加熱當(dāng)最終中心溫度達(dá)到70 ℃時(shí)形成熱誘導(dǎo)凝膠的保水性和硬度最好;1 ℃/min進(jìn)行加熱的雞胸肉蛋白的G’和G”都好于以2 ℃/min加熱的G’和G”,且慢速加熱雞肉蛋白的變相溫度比快速加熱提前,出現(xiàn)的兩個(gè)峰值也都高于快速加熱。掃描電鏡結(jié)果顯示慢速加熱形成的蛋白凝膠結(jié)構(gòu)較快速加熱形成的凝膠結(jié)構(gòu)均勻、致密。
雞胸肉勻漿物;熱致凝膠;保水性;硬度;超微結(jié)構(gòu);流變學(xué)特性
熱致凝膠是指變性或非變性的蛋白質(zhì)分子之間相互聚合進(jìn)而形成有序三維網(wǎng)絡(luò)結(jié)構(gòu)的過(guò)程,其形成的作用力主要是蛋白質(zhì)與蛋白質(zhì)、蛋白質(zhì)與水分子以及相鄰的多肽之間的引力及斥力之間達(dá)到相平衡[1]。在肉制品加工過(guò)程中,蛋白質(zhì)的凝膠形成過(guò)程非常重要,對(duì)肉制品的保水性、凝膠特性及感官品質(zhì)等有著顯著的影響[2]。研究發(fā)現(xiàn)影響肌肉蛋白熱誘導(dǎo)凝膠形成的因素有很多,如pH值、肌肉類(lèi)型、蛋白質(zhì)濃度、加熱條件和非肉添加成分等[3-4]。而不同加熱方式對(duì)雞肉勻漿物凝膠功能特性的研究還未見(jiàn)報(bào)道。本實(shí)驗(yàn)主要研究加熱方式對(duì)雞胸肉勻漿物凝膠特性、超微結(jié)構(gòu)及流變學(xué)特性的影響,為凝膠肉制品的加工提供理論依據(jù)。
1 材料與方法
1.1 材料與試劑
60日齡三黃雞購(gòu)于當(dāng)?shù)剞r(nóng)貿(mào)市場(chǎng),活體宰殺,切斷頸動(dòng)脈瀝血3~4 min,控血1~2 min,浸燙脫毛,并取其胸肉。
N a C l、K I、N a O H、C u S O4·5 H2O、C4H4KNaO6·4H2O均為分析純。牛血清白蛋白 上海Promeag公司。
1.2 儀器與設(shè)備
Waring Blender 8010ES高速組織搗碎機(jī) 美國(guó)Colo-Parmer公司;Alelgra 64R高速冷凍離心機(jī) 美國(guó)貝克曼庫(kù)爾特有限公司;723型分光光度計(jì) 上海光譜儀器有限公司;JA2003 電子天平 上海天平儀器廠;HH-42快速恒溫?cái)?shù)顯水箱 常州國(guó)華電器有限公司;TA-XT2i型質(zhì)構(gòu)儀 英國(guó)Stable Micro Systems 公司;SANYO SLM-F124制冰機(jī) 日本三洋公司;78-1磁力攪拌器深圳國(guó)華儀器廠;臺(tái)式pH計(jì)(pH211 Microprocessor)葡萄牙Hanna公司;臺(tái)式實(shí)驗(yàn)室超純水系統(tǒng) 南京總馨純水設(shè)備有限公司;MCR301旋轉(zhuǎn)流變儀 奧地利Anton Paar公司。
1.3 方法
1.3.1 肌肉勻漿物質(zhì)制備
60日齡三黃雞宰殺放血后,迅速撥毛剝皮取雞胸肉,沖去血污并剔除其可見(jiàn)結(jié)締組織和脂肪。并切成0.3 cm小塊,加入4倍體積pH值為6.8的濃度為0.6 mol/L NaCl冰水混合物中,用高速組織搗碎機(jī)以18 000 r/min的速度將肉絞碎,每次20 s,每次間隔2 s,共絞3次。將絞碎后的勻漿物用0.1 mol/L HCl調(diào)pH 6.3,放于4 ℃冰箱中存24 h[5]之后再用。
1.3.2 蛋白質(zhì)濃度測(cè)定
采用雙縮脲法測(cè)定蛋白質(zhì)濃度,用牛血清白蛋白作為標(biāo)準(zhǔn)蛋白。
1.3.3 凝膠制備
調(diào)整勻漿物濃度為30 mg/mL,在3 000×g的條件下離心1 min除氣泡后[5],分別以1 ℃/min和2 ℃/min的速率進(jìn)行加熱,使其中心溫度從30 ℃分別加熱到60、65、70、75、80、85 ℃,達(dá)到設(shè)定溫度后保溫30 min,然后從水浴中取出置于冰水混合物中冷卻1 h,再置于4 ℃冰箱中貯藏12 h。
1.3.4 保水性(water holding capacity,WHC)測(cè)定
將制備好的凝膠于5 000×g離心10 min后除水稱(chēng)質(zhì)量,每組樣品5個(gè)平行。
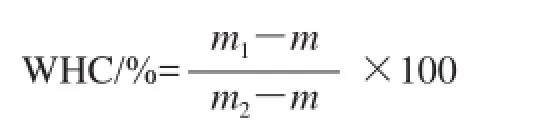
式中:m1為離心管和離心除水后的凝膠質(zhì)量/g;m2為離心前離心管和凝膠質(zhì)量/g;m為離心管質(zhì)量/g。
1.3.5 質(zhì)構(gòu)特性測(cè)定
應(yīng)用質(zhì)構(gòu)儀剖面分析法(texture profile analysis,T P A)及P 5不銹鋼圓柱探頭測(cè)定樣品的硬度(hardness)。質(zhì)構(gòu)儀參數(shù)設(shè)定:測(cè)前探頭下降速度1.0 mm/s,測(cè)試時(shí)探頭速度0.5 mm/s,測(cè)試后探頭上升速度10 mm/s,穿刺測(cè)試距離5 mm,感應(yīng)力為5 g,每組樣品5個(gè)平行,樣品硬度通過(guò)質(zhì)構(gòu)儀自帶的軟件對(duì)測(cè)量結(jié)果進(jìn)行計(jì)算得到。
1.3.6 流變性測(cè)定
采用MCR301旋轉(zhuǎn)流變儀測(cè)定樣品的流變性,流變性測(cè)定條件:采用直徑為50 mm的平行板,狹縫1 mm,頻率0.1 Hz,應(yīng)變2.85%,分別以1 ℃/min和2 ℃/min的加熱速率進(jìn)行升溫,升溫范圍30~85 ℃,每組樣品5個(gè)平行。
1.4 統(tǒng)計(jì)分析
應(yīng)用SAS 8.0 數(shù)理統(tǒng)計(jì)軟件進(jìn)行方差分析,用Duncan’s multiple-range test進(jìn)行多重比較(P<0.05)。
2 結(jié)果與分析
2.1 不同加熱方式對(duì)雞胸肉勻漿物凝膠保水性的影響

圖1 加熱方式對(duì)雞胸肉勻漿物凝膠保水性的影響Fig.1 Effects of heating methods on the WHC of gels
凝膠保水性是肌肉蛋白在加熱過(guò)程中形成凝膠網(wǎng)絡(luò)結(jié)構(gòu)所含水分的能力。圖1是不同加熱方式下雞胸肉形成凝膠保水性的變化,本實(shí)驗(yàn)發(fā)現(xiàn)在離心力5 000×g作用下,凝膠網(wǎng)絡(luò)內(nèi)的水分流出。除去水分的樣品質(zhì)量與未除去的樣品質(zhì)量之比反映了凝膠網(wǎng)絡(luò)形成的情況[6]。經(jīng)兩因素重復(fù)方差分析發(fā)現(xiàn),加熱速率對(duì)凝膠體系保水性有顯著影響(P<0.05),加熱溫度對(duì)形成凝膠的保水性無(wú)顯著性影響。當(dāng)以1 ℃/min加熱時(shí),凝膠體系的保水性開(kāi)始逐漸增加且在溫度70 ℃時(shí)達(dá)到最大,此時(shí)為94.47%,當(dāng)溫度超過(guò)70 ℃后整個(gè)凝膠體系的保水性呈下降趨勢(shì),但是下降程度并不顯著;當(dāng)以2 ℃/min的速率進(jìn)行加熱時(shí),在溫度為65 ℃時(shí)凝膠體系保水性最大;超過(guò)此溫度后保水性整體也呈下降趨勢(shì),在70 ℃時(shí)開(kāi)始大幅度下降,75 ℃時(shí)開(kāi)始有所升高,最終溫度85 ℃時(shí)達(dá)到最低,且低于1 ℃/min加熱時(shí)的保水性;但整個(gè)凝膠體系的保水性是以1 ℃/min的速率進(jìn)行加熱溫度達(dá)到70 ℃時(shí)最大。這可能是因?yàn)榧訜崴俾噬吆螅沟妹總€(gè)樣品達(dá)到最終凝膠溫度所用的時(shí)間變短,意味著蛋白展開(kāi)時(shí)間短,聚合時(shí)間也短,或者蛋白變性過(guò)快,最終導(dǎo)致蛋白凝膠網(wǎng)絡(luò)形成不均勻,使得快速加熱形成凝膠的保水性較慢速加熱形成的保水性差[7-10]。從整體上看,以1 ℃/min的速率加熱時(shí)凝膠體系的保水性要好于以2 ℃/min加熱時(shí)的保水性。
2.2 不同加熱方式對(duì)凝膠硬度的影響
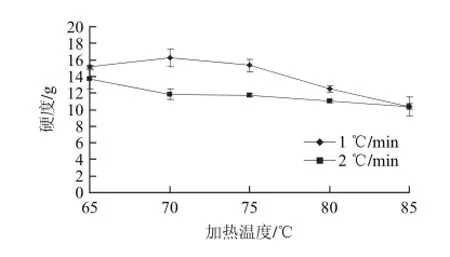
圖2 加熱方式對(duì)雞胸肉凝膠硬度的影響Fig.2 Effects of heating methods on the hardness of gels
圖2 是不同加熱方式對(duì)凝膠體系硬度的影響,經(jīng)兩因素重復(fù)方差分析結(jié)果顯示,加熱溫度對(duì)整個(gè)凝膠體系的硬度有極顯著影響(P<0.01),加熱速率對(duì)其無(wú)顯著性影響。慢速加熱時(shí),凝膠體系硬度開(kāi)始逐漸增大,在溫度70 ℃時(shí)達(dá)到最大,值為16.3 g,高于此溫度之后整個(gè)凝膠體系的硬度開(kāi)始逐漸減小;快速加熱時(shí),凝膠體系的硬度一直在逐漸減小,直到85 ℃兩種加熱速率形成的凝膠體系硬度幾乎一樣,說(shuō)明隨著溫度的升高凝膠體系的硬度無(wú)論慢速還是快速加熱都是相對(duì)比較差的。從整體上看,凝膠體系硬度的變化以1 ℃/min的速率加熱時(shí)的硬度要好于以2 ℃/min的速率進(jìn)行加熱時(shí)的硬度。
2.3 不同加熱方式對(duì)雞胸肉勻漿物凝膠流變學(xué)特性的影響
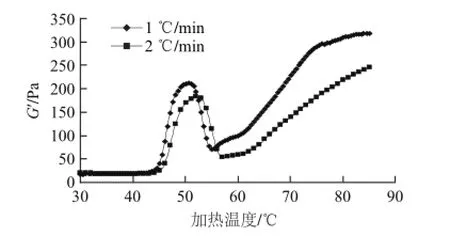
圖3 加熱方式對(duì)雞胸肉勻漿物G’的影響Fig.3 Effects of heating methods on the G’ of muscle homogenate
流變學(xué)是物質(zhì)在力的作用下變形或流動(dòng)的科學(xué),主要是力、變形、時(shí)間相互之間的關(guān)系,基本內(nèi)容是彈性力學(xué)和黏性流體力學(xué)[11]。G’是貯能模量,代表著形成彈性凝膠網(wǎng)絡(luò)的變化過(guò)程,反應(yīng)了不同的溫度下肌肉的蛋白分子展開(kāi)和聚集的過(guò)程[12]。從圖3可知,無(wú)論以何種速率進(jìn)行加熱,在加熱溫度30~40 ℃范圍內(nèi),肌肉勻漿物的G’并未發(fā)生明顯變化,在溫度為44.1 ℃時(shí),G’開(kāi)始逐漸升高,此溫度為G’的初始變相溫度;隨著加熱過(guò)程的繼續(xù),兩種加熱速率,G’分別在50.6 ℃(1 ℃/min)和52.1 ℃(2 ℃/min)時(shí)出現(xiàn)第一個(gè)峰值,值為212 Pa和183 Pa,在溫度為50.6~55.6 ℃和52.1~57.1 ℃之間G’開(kāi)始迅速下降;1 ℃/min加熱的肌肉蛋白在溫度為76.1 ℃時(shí)G’出現(xiàn)第二個(gè)峰值即296 Pa,2 ℃/min 加熱的肌肉蛋白始終沒(méi)有第二個(gè)峰出現(xiàn);并最終在85 ℃時(shí),兩種加熱速率加熱的G’達(dá)到最大,值分別為318 Pa和245 Pa。
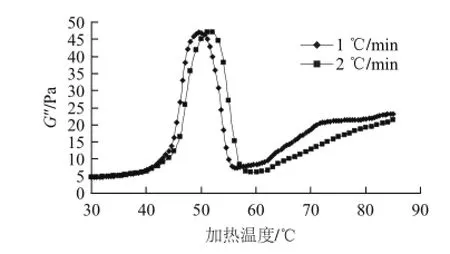
圖4 加熱方式對(duì)雞胸肉勻漿物G”的影響Fig.4 Effects of heating methods on the G”of muscle homogenate
G”是損耗模量,反映凝膠過(guò)程中蛋白懸浮物黏性的變化過(guò)程[13]。圖4是加熱方式對(duì)肌肉勻漿物G”的影響,當(dāng)分別以1 ℃/min和2 ℃/min的速率進(jìn)行加熱時(shí),在溫度分別為42.1~49.6 ℃和42.8~51.1 ℃區(qū)間段時(shí)G”均快速增加,表明在此溫度范圍內(nèi)肌肉蛋白所含的黏性物質(zhì)較多,增加了蛋白質(zhì)中肽鏈的凝結(jié)性,抑制了蛋白的遷移[14];慢速加熱(1 ℃/min)時(shí)G”的第一次相變溫度是40 ℃,比G’的相變溫度低,可能是蛋白質(zhì)分子展開(kāi)比聚集發(fā)生溫度要低,從而使得凝膠體系的黏性增加[15];在49.6 ℃和51.1 ℃后兩種加熱速率下的G”均迅速下降,推測(cè)此過(guò)程中蛋白質(zhì)分子發(fā)生了比較松散的聚集,黏結(jié)性較差[16]。
2.4 加熱方式對(duì)超微結(jié)構(gòu)的影響
肌肉蛋白在加熱條件下折疊的蛋白質(zhì)分子原本相互結(jié)合的側(cè)鏈開(kāi)始斷裂并逐步展開(kāi),然后蛋白質(zhì)間再通過(guò)巰基等鍵發(fā)生聚集和交聯(lián),從而形成肌肉蛋白顆粒和絲狀結(jié)構(gòu)同時(shí)存在的凝膠網(wǎng)絡(luò)結(jié)構(gòu)[17-18]。圖5是不同加熱方式對(duì)肌肉蛋白凝膠超微結(jié)構(gòu)的影響,可以看出只有圖A(1 ℃/min 65 ℃)和圖B(1 ℃/min 70 ℃)中有大的凝膠網(wǎng)絡(luò)形成,同時(shí)其中又嵌套著許多相互鏈接的小和更小的網(wǎng)絡(luò),進(jìn)而形成了絲絲相連的結(jié)構(gòu)致密的蛋白質(zhì)網(wǎng)絡(luò)結(jié)構(gòu)。圖5B比圖5A中形成的凝膠網(wǎng)絡(luò)結(jié)構(gòu)密集廣泛,也形成了大網(wǎng)聯(lián)大網(wǎng)同時(shí)大網(wǎng)又連著小網(wǎng)而小網(wǎng)又連著小網(wǎng)的相互交聯(lián)的結(jié)構(gòu),且聚集在凝膠網(wǎng)絡(luò)上的蛋白顆粒非常少。圖5C和圖5E中有凝膠網(wǎng)絡(luò)形成,但網(wǎng)絡(luò)中有部分?jǐn)嗔眩⑶夷z網(wǎng)絡(luò)結(jié)構(gòu)疏松;圖5D中有斷裂的大網(wǎng)出現(xiàn)。圖5F~J看出沒(méi)大的網(wǎng)絡(luò)形成,但小的網(wǎng)絡(luò)鏈接均勻致密,從圖5I和圖5J可以看出,表面有不均勻的大蛋白顆粒聚集。說(shuō)明了加熱溫度和加熱速率均影響著肌肉蛋白質(zhì)凝膠的形成,可以看出以1 ℃/min的速率加熱形成的蛋白質(zhì)凝膠結(jié)構(gòu)普遍較2 ℃/min的加熱速率形成的凝膠結(jié)構(gòu)要好。
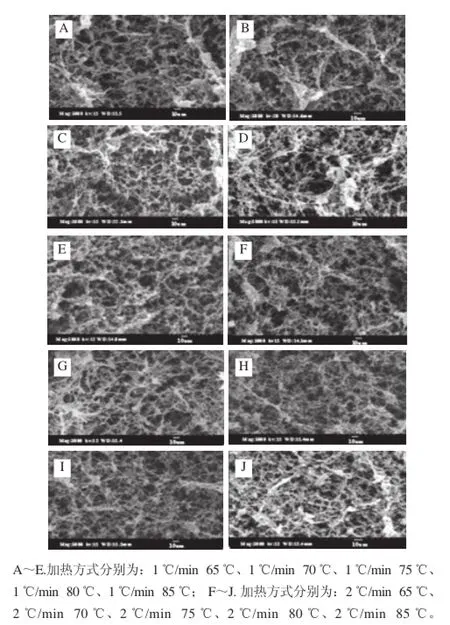
圖5 加熱方式對(duì)雞胸肉蛋白超微結(jié)構(gòu)的影響Fig.5 Ultrastrcuture of muscle protein gels with different heating methods
3 討 論
加熱速率和加熱溫度對(duì)肌肉蛋白熱誘導(dǎo)凝膠形成起著非常重要的作用[19]。本實(shí)驗(yàn)采用了1 ℃/min和2 ℃/min兩種加熱速率,把雞胸肉勻漿物最終溫度加熱到5個(gè)不同的溫度,結(jié)果發(fā)現(xiàn)慢速加熱的凝膠特性及流變學(xué)特性均優(yōu)于快速加熱,此結(jié)果與文獻(xiàn)[20-21]報(bào)道一致;1 ℃/min加熱的肌肉蛋白的G’初始相變溫度比2 ℃/min加熱時(shí)要提前,且1 ℃/min加熱時(shí)的第一和第二個(gè)峰值都高于2 ℃/min的峰值,整體上1 ℃/min加熱肌肉勻漿物的G’高于2 ℃/min加熱的G’;1 ℃/min加熱肌肉蛋白的G”要好于2 ℃/min時(shí)的G”,加熱溫度和加熱速率對(duì)肌肉勻物的保水性有顯著影響(P<0.05),對(duì)硬度有極顯著影響(P<0.01),凝膠保水性和硬度分別在以1 ℃/min加熱且最終溫度為70 ℃時(shí)達(dá)到最大,從電鏡圖片上看,此時(shí)形成的凝膠網(wǎng)絡(luò)結(jié)構(gòu)也是最好的。由于慢速加熱有利于蛋白的伸展和聚集,使得肌肉蛋白的疏水性氨基酸殘基更容易暴露出來(lái),該殘基含有大量的蛋白質(zhì)分子,故易導(dǎo)致蛋白分子與蛋白分子,蛋白分子與水分子之間的相互作用增強(qiáng),容易形成穩(wěn)定有序的三維網(wǎng)絡(luò)結(jié)構(gòu)[22-23]。
加熱溫度對(duì)肌肉凝膠的形成有直接影響,在溫度較低(低于30 ℃)時(shí),肌球蛋白基本不發(fā)生變化,隨著加熱溫度的逐步升高,蛋白質(zhì)分子開(kāi)始發(fā)生聚集,在40 ℃開(kāi)始形成二聚體,44 ℃時(shí)二聚體進(jìn)一步頭頭、頭尾、尾尾聚集逐步形成寡聚體,在44~60 ℃時(shí)寡聚體之間開(kāi)始聚集逐漸形成結(jié)構(gòu)致密的網(wǎng)絡(luò)結(jié)構(gòu)[24],當(dāng)溫度大于60 ℃時(shí)主要是肌球蛋白的頭部聚集形成凝膠網(wǎng)絡(luò)結(jié)構(gòu)[25],這樣會(huì)導(dǎo)致蛋白質(zhì)分子形成的網(wǎng)絡(luò)結(jié)構(gòu)松散且容易斷裂,致使肌肉凝膠的特性下降[26]。
4 結(jié) 論
本實(shí)驗(yàn)中,升溫速率的快慢和加熱溫度的高低均對(duì)雞胸肉蛋白形成的凝膠特性有顯著影響。從整體上看,慢速加熱形成的凝膠結(jié)構(gòu)優(yōu)于快速加熱形成的凝膠結(jié)構(gòu),以1 ℃/min的速率進(jìn)行加熱,當(dāng)中心溫度達(dá)到70 ℃時(shí),雞胸肉蛋白形成的凝膠特性最理想。
[1] FOEGEDING E A. Thermally induced changes in muscle proteins[J]. Food Technology, 1988, 2(6): 58-64.
[2] ACTON J C, ZIEGER G K, BURGE D L. Functionality of muscle constituents in the processing of comminuted meat products[J]. Critical Reviews Food Science Nutrition,1983,18: 99-121.
[3] BENJAKUL S, VISESSANGUAN W, ISHIZAKI S, et al. Differences in gelation characteristics of natural actomyosin from two species of bigeye snapper, priacanthus tayenus and priacanthus macracanthus[J]. Food Science, 2001, 66(9): 1311-1318.
[4] SHARP A, OFFER G. The mechanism of formation of gels from myosin molecules[J]. Journal of the Science of Food and Agriculture,1992, 58(1): 63-73.
[5] XIONG Y L. Thermally induced interactions and gelation of combined myofibrillar protein from white and red broiler muscles[J]. Food Science,1992,57(3): 581-585.
[6] FOEGEDING E A, ALLEN C E, DAYTON W R. Effect of heating rate on thermally formed myosin, fibrinogen and albumin gels[J]. Food Science, 1986a, 51: 104-112.
[7] SAFFLE R L, CARPENTER J A, ZIRKLE S B. Rapid method to determine stability of sausage emulsion and effect of processing temperature and humidities[J]. Food Technology, 1967, 21(5): 784-788.
[8] MONAGLE C W., TOLEDO R T, SAME, R L. Effect of smokehouse temperature, humidity and air velocity on rate of heating and quality of frankfurters[J]. Food Science, 1974, 39(3): 602-604.
[9] CAMOU J P, SEBRANEK J G, OLSON D G. Effect of heating rate and protein concentration on gel strength and water loss of muscle protein gels[J]. Food Science, 1989, 54(4): 850-855.
[10] HEGG P O, MARTENS H, LOFQVIST B. The protective effect of sodium dodecylsulphate on the thermal precipitation of conalbumin. a study on thermal aggregation and denaturation[J]. Food Agriculture,1978, 29(3): 245-260.
[11] 楊龍江, 南慶賢. 肌肉蛋白質(zhì)的熱誘導(dǎo)凝膠特性及其影響因素[J].肉類(lèi)工業(yè), 2001(10): 39-42.
[12] LEFEVRE F, FAUCONNEAU B, QUAIL A, et al. Thermal gelation of brown trout myofibrillar: effect of muscle type, heating rate andprotein concentration[J]. Food Science, 1998, 63: 229-302.
[13] LI J, ELEYA OULD M M, GUNASEKARAN S. Gelation of whey protein and xanthan mixture: effect of heating rate on rheologial properties[J]. Food Hydrocolloids, 2006, 20: 678-686.
[14] YASUI T, ISHIOROSHI M, NAKANO H, et al. Changes in shear modulus, ultrastructure and spin-spin relaxation times of water association with heat-induced gelation of myosin[J]. Food Science, 1979, 44(4): 1201-1204.
[15] BURKE M, HIMMELFARB S, HARRINGTON W F. Studies on the“hinge”region of myosin[J]. Biochemistry, 1973, 12(4): 701-710.
[16] TAJIMA M, ITO T, ARAKAWA N, et al. Heat-induced changes of myosin and sarcoplasmic proteins in beef during simmering[J].Food Science, 2001, 66: 233-237.
[17] RODGERS M E, KARR T, BIEDERMANN K, et al. Thermal stability of myosin rod from various species[J]. Biochemistry, 1987, 26(26): 8703-8708.
[18] LIU M N, FOEGEDING E A. Thermally induced gelation of chicken myosin isoforms[J]. Journal of Agricultural and Food Chemistry, 1996, 44(6): 1441-1446.
[19] WANG S F, SMITH D M. Dynamic rheological properties and secondary structure of chicken breast myosin as influenced by isothermal heating[J]. Journal of Agricultural and Food Chemistry, 1994, 42(7): 1434-1439.
[20] LESIOU T, XIONG Youling. Mechanism of rheological changes in poultry myofibrillar proteins during gelation[J]. Avian and Poultry Biology Reviews, 2001,12(4): 137-149.
[21] YONG SAWATDIGUL Y, PARK J W. Thermal aggregation and dynamic rheological properties of pacific whiting and cod myosins as affected by heating rate[J]. Food Technology, 1999, 64(4): 679-683.
[22] ANNE B S, DENISE M S, VEGA-WARNER V, et al. Thermal denaturation and aggregation of chicken breast muscle myosin and subfragments[J]. Journal of Agricultual and Food Chemistry, 1996, 44(4): 1005-1010.
[23] CHAN J K, GILL T A, PAULSON A T. The dynamics of thermal denaturation of fish myosins[J]. Food Research International,1992, 25: 117-123.
[24] 徐幸蓮, 周光宏, 黃鴻兵等. 蛋白質(zhì)濃度、pH值、離子強(qiáng)度對(duì)兔骨骼肌肌球蛋白熱凝膠特性的影響[J]. 江蘇農(nóng)業(yè)學(xué)報(bào), 2004, 20(3): 159-163.
[25] BEAS V E, CRUPKIN M, TRUCCO R E. Gelling properties of actomyosin from pre- and post-spawning hake[J]. Food Science, 1988, 53: 1322-1326.
[26] CHAN J K, GILL T A, PAULSON A T. Cross-linking of myosin heavy chains from cod, herring and silver hake during thermal setting[J]. Food Science, 1992, 57(4): 906-912.
Effects of Heating Methods on Gel Properties of Chicken Muscle Homogenate
DAI Jia-jia1,2, HAN Min-yi2, XU Xing-lian2,*, ZHOU Guang-hong2
(1. Wannan Medical College, Wuhu 241002, China; 2. Synergetic Innovation Center of Food Safety and Nutrition, Key Laboratory of Animal Products Processing, Ministry of Agriculture, Nanjing Agricultural University, Nanjing 210095, China)
In this paper, chicken meat homogenate was heated to 65, 70, 75, 80 and 85 ℃, respectively, by increasing the temperature at a rate of 1 or 2 ℃/min. The results showed that the heating methods significantly influenced the water holding capacity (WHC) of chicken breast homogenate gel (P < 0.05). A highly significant difference was detected for the gel hardness of chicken breast homogenate (P < 0.01). The best WHC and hardness of gel formation were obtained when the temperature reached 70 ℃ at an increasing rate of 1 ℃/min. The G’ and G” of chicken breast homogenate heated with 1 ℃/min were better than those heated with 2 ℃ /min. The initial transformation temperature of 1℃/min appeared earlier than that of 2 ℃/min, and the first and second peaks of 1 ℃/min were higher than those of 2 ℃/min. The scanning electron microscope results showed that better three-dimensional structure of gels was formed by the slower heating rate than by the faster heating.
chicken meat homogenate; heat-induced gel; water holding capacity(WHC); hardness; ultrastrcuture; rheological property
TS251.1
A
1002-6630(2014)05-0018-05
10.7506/spkx1002-6630-201405004
2014-01-07
國(guó)家自然科學(xué)基金項(xiàng)目(31171707);國(guó)家現(xiàn)代農(nóng)業(yè)(肉雞)產(chǎn)業(yè)技術(shù)體系建設(shè)專(zhuān)項(xiàng)(CARS-42-5)
代佳佳(1982—),女,碩士,研究方向?yàn)樾螽a(chǎn)品加工與質(zhì)量控制。E-mail:djjwin1983@163.com
*通信作者:徐幸蓮(1962—),女,教授,博士,研究方向?yàn)樾螽a(chǎn)品加工與質(zhì)量控制。E-mail:xlxu@njau.edu.cn

