甲潑尼龍聯合氨溴索對急性百草枯中毒家豬肺損傷的影響研究
蘭 超,李海娜,李 莉,王金柱,李 璐,劉蘭萍,狄 敏
百草枯是一種毒性作用很強的除草劑,因誤服等因素造成的百草枯中毒較為常見。人口服致死劑量為20 mg/kg,百草枯的口服吸收率可達5%~15%,經人體吸收后基本不與血漿蛋白結合,短時間內(通常為2 h)即可達藥學峰值[1]。肺臟作為百草枯中毒的主要靶器官,其損害的主要表現為早期的急性肺泡炎、肺水腫,以及后期迅速發展的肺纖維化[2]。為減輕百草枯中毒引起的肺損傷程度,除了利用導瀉、洗胃、口服吸附劑、血液灌流[3]等臨床手段來減少毒物的吸收外,還可采用激素療法以達到控制感染的目的。激素對急性百草枯中毒肺損傷的有效治療作用已通過實驗得到了驗證,并獲得了相關學者的肯定[4-5]。鹽酸氨溴索是一種臨床常用的黏液溶解劑,近年來有關鹽酸氨溴索對肺損傷保護作用的實驗研究越來越多,Seifart等[6]和Stetinova等[7]學者研究發現,氨溴索具有抗氧化及促進肺表面活性蛋白生成的作用。本研究旨在通過監測脈搏指示連續心排血量(PICCO)、氧合指數(PaO2/FiO2)及肺表面活性物質蛋白-D(SP-D)水平觀察甲潑尼龍聯合氨溴索對急性百草枯中毒家豬急性肺損傷(ALI)的治療效果,為急性百草枯中毒肺損傷的診斷及治療提供依據。
1 材料與方法
1.1 主要實驗儀器及藥物 甲潑尼龍(Pfizer,進口藥品注冊證號H20080284),氨溴索(沈陽新馬藥業有限公司,國藥準字號H20050242),呼吸機(Servo-s,德國),氣管插管(6.0 mm),PICCO導管(4F,PV2014L16,德國),PICCO2容量監測儀(德國),心電監護儀(PM-9000,深圳邁瑞生物醫療電子股份有限公司),血氣分析儀(Premier3000,德國)。20%百草枯溶液(美國Sigma公司),鹽酸氯胺酮注射液(福建古田藥業有限公司,國藥準字號H35020148),硫酸阿托品注射液(上海禾豐制藥有限公司,國藥準字號H31021172),丙泊酚注射液(商品名得普利麻,AstraZeneca S.P.A,進口藥品注冊號H20100648),順苯磺酸阿曲庫銨注射液(美國葛蘭素史克公司,進口藥品注冊號H20050516),枸櫞酸舒芬太尼注射液(宜昌人福藥業有限公司,國藥準字號H20054171)。
1.2 方法
1.2.1 模型制作 健康雌性家豬21只,由河南省動物實驗中心提供,日齡65~70 d,平均體質量(25.0±2.1)kg。術前禁食12 h,自由飲水。家豬肌肉注射阿托品(0.05 mg/kg)和氯胺酮(15 mg/kg)后仰臥于實驗臺上,持續心電監護,建立耳緣靜脈通道輸注乳酸林格液(10 ml·kg-1·h-1),同時經口氣管插管(6.0 mm)接呼吸機輔助呼吸。參數設置:采用容量控制通氣模式,潮氣量(VT)=12 ml/kg,通氣頻率(RR)=30次/ min,吸氣相和呼氣相比值(I/E)=1∶2,吸入氧濃度(FiO2)為30%,呼氣末正壓(PEEP)設置為0 cm H2O(1 cm H2O=0.098 kPa)。經頸內靜脈置入中心靜脈導管,經股動脈置入PICCO導管,PICCO的具體工作方式見文獻[8-9]。給予每只家豬20%百草枯溶液20 ml腹腔注射,每隔30 min測定一次動脈血氣分析,直至PaO2/FiO2≤300 mm Hg(1 mm Hg=0.133 kPa)并呈進行性下降趨勢,30 min后復測血氣分析仍顯示PaO2/FiO2≤300 mm Hg,即ALI/急性呼吸窘迫綜合征(ARDS)造模成功[10]。3只家豬在實驗過程中死亡,18只家豬在腹腔注射百草枯溶液后(4.5±0.8)h達到ALI/ARDS標準。整個過程中靜脈持續泵入丙泊酚2.4~2.5 mg·kg-1·h-1和舒芬太尼0.023~0.025 μg·kg-1·h-1,間斷給予順阿曲庫銨0.08~0.10 mg·kg-1·h-1維持肌松。
1.2.2 實驗方法 造模成功后將動物按隨機數字表法分為百草枯染毒甲潑尼龍干預組(A組),百草枯染毒氨溴索干預組(B組),百草枯染毒甲潑尼龍聯合氨溴索干預組(C組),每組6只。A、B兩組家豬分別于頸內靜脈輸入甲潑尼龍注射液30 mg/kg、氨溴索35 mg/kg,C組家豬輸入甲潑尼龍注射液30 mg/kg和氨溴索35 mg/kg。整個實驗期間各組均靜脈給予乳酸林格液(10 ml·kg-1·h-1),持續泵入丙泊酚2.4~2.5 mg·kg-1·h-1和舒芬太尼0.023~0.025 μg·kg-1·h-1,間斷給予順阿曲庫銨0.08~0.10 mg·kg-1·h-1維持肌松。
1.2.3 監測項目 (1)動脈血氣分析:抽取藥物治療后12 h(t12)、24 h(t24)及36 h(t36)時的動脈血,并按照血氣分析儀說明行血氣分析,記錄各時點的動脈血pH值、氧分壓(PaO2)及二氧化碳分壓(PaCO2)等指標,計算PaO2/FiO2。(2)PICCO相關監測項目:分別于造模前、造模成功(t0)、t12、t24及t36時各測定一次PICCO相關監測項目。具體方法為:頸內靜脈導管連接PICCO溫度探頭,股動脈導管連接PICCO檢測儀,每次測量時經頸內靜脈導管快速(<5 s)注入10 ml冰(0~4 ℃)0.9%氯化鈉溶液,連續檢測3次取平均值。記錄血管外肺水指數(EVLWI)、肺血管通透性指數(PVPI)、心率(HR)和平均動脈壓(MAP)。(3)肺組織病理及SP-D水平檢測:各組在造模前、t0、t12、t24、t36時分別用穿刺針取右肺下葉組織置于4%甲醛溶液中固定,待標本收集完畢后統一制作石蠟切片、蘇木精-伊紅(HE)染色后在光鏡下觀察造模前、t0及t36時肺組織的病理變化并拍照。通過Western bloot方法檢測SP-D水平。

2 結果
2.1 HR及MAP變化 組間比較:3組家豬HR和MAP造模前和t0時差異無統計學意義(P>0.05),t12、t24、t36時差異均有統計學意義(P<0.05)。組內比較:t0時3組家豬HR和MAP均較造模前明顯上升(P<0.05);t12、t24、t36時HR和MAP均較t0時明顯下降(P<0.05,見表1)。
2.2 PaO2/FiO2變化 t0時3組家豬PaO2/FiO2均較造模前降低,t12時3組PaO2/FiO2均較t0升高,C組升高最為明顯(P<0.05);t24、t36時較t12時降低(P<0.05,見圖1)。
2.3 SP-D水平變化 t0時3組家豬肺組織SP-D水平均較造模前降低,t12時3組家豬SP-D水平升高,以C組升高最明顯(P<0.05);t24、t36時較t12時明顯降低(P<0.05,見圖2)。

圖1 PaO2/FiO2變化趨勢圖
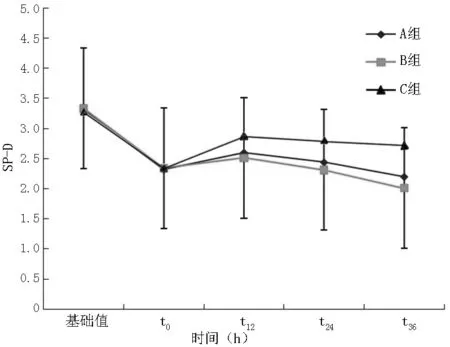
圖2 SP-D水平變化趨勢圖
2.4 EVLWI和PVPI變化 組間比較:3組家豬EVLWI和PVPI造模前及t0時差異無統計學意義(P>0.05),t12、t24、t36時差異均有統計學意義(P<0.05)。組內比較:t0時3組家豬EVLWI和PVPI均較造模前明顯上升(P<0.05);造模成功后,3組家豬EVLWI在t12、t24和t36時與組內t0時比較,差異均有統計學意義(P<0.05);t12、t24、t36時3組家豬PVPI與組內t0時比較,差異均無統計學意義(P>0.05,見表2)。
2.5 肺組織病理 肺組織HE染色顯示,正常肺組織肺泡結構完整,肺間質無異常滲出物(見圖3a);t0時肺組織肺泡結構破壞,充血水腫嚴重,肺間質可見大量紅細胞滲出,肺泡間隔增寬(見圖3b);t36時,C組肺組織肺泡壁基本完整,肺間質內少量炎癥細胞浸潤(見圖3c);t36時A組肺組織肺間質內多量炎癥細胞浸潤,毛細血管擴張(見圖3d);t36時B組肺組織肺間質內亦可見多量炎癥細胞浸潤,部分肺泡破裂融合(見圖3e)。
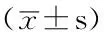
表1 3組家豬HR及MAP變化比較
注:與同組造模前比較,*P<0.05;與同組t0比較,△P<0.05;HR=心率,MAP=平均動脈壓
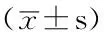
表2 3組家豬EVLWI和PVPI變化比較
注:與組內造模前相比,*P<0.05;與組內t0比較,△P<0.05;EVLWI=血管外肺水指數,PVPI=肺血管通透性指數
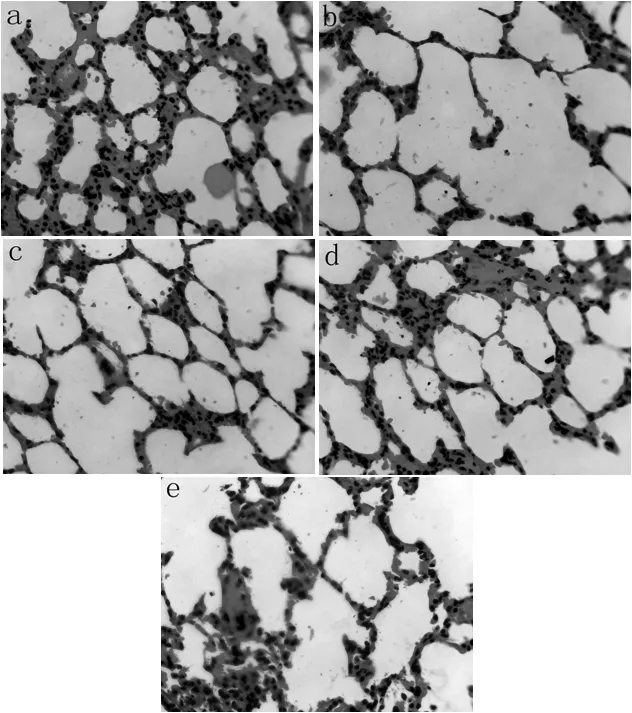
注:a為正常肺組織,b為t0時肺組織,c為t36時C組肺組織,d為t36時A組肺組織,e為t36時B組肺組織
圖3 肺組織病理變化(HE染色,×400)
Figure3 Pathological changes in lung histology
3 討論
百草枯吸收入血后主要蓄積在肺組織內,其水平可達其他組織的10倍以上,這可能與肺組織內存在胺類攝取系統有關[11-12]。關于百草枯中毒肺損傷的機制目前尚不明確,有研究發現百草枯中毒后人體會產生大量的活性氧自由基,如氫氧過氧化物和羥自由基等,引起組織細胞尤其是肺組織的氧化性損傷及肺部病理學改變[13],因此需積極抗氧化治療以減輕百草枯中毒造成的肺組織損傷。甲潑尼龍和地塞米松是急性百草枯中毒臨床治療中的常用激素[14],陳文清[15]進行的一項隨機臨床對照研究發現,甲潑尼龍治療急性百草枯中毒的效果優于地塞米松,早期應用甲潑尼龍可以有效緩解病情,降低病死率。所以,本研究選擇甲潑尼龍進行實驗。鹽酸氨溴索是一種臨床上常用的黏液溶解劑,具有抗氧化、穩定肺泡細胞的作用[16]。有文獻報道氨溴索在肺組織中的水平高出血清20倍,可以減輕百草枯中毒實驗動物的肺損傷[17]。馬玉騰等[18]利用大鼠進行實驗,在給予百草枯中毒大鼠大劑量鹽酸氨溴索治療后,大鼠的急性肺損傷減輕,此項研究表明氨溴索可以減輕百草枯中毒大鼠全身及肺組織內的炎性反應,并通過促進肺表面活性物質的合成進一步減輕肺損傷,保護肺功能。由此推測甲潑尼龍聯用氨溴索治療百草枯中毒肺損傷的效果應該更好。此外,既往的動物實驗多在百草枯染毒后立即進行藥物干預[19],但在實際臨床中由于轉運耗時等各種因素的影響,百草枯中毒患者中毒后多不能立即得到治療,故本實驗在肺組織病理符合ALI/ARDS改變時進行藥物干預。
百草枯中毒所致ALI的主要病理改變為脂質過氧化反應引起肺泡毛細血管膜損傷,進而導致嚴重的肺淤血、肺水腫、肺順應性降低和嚴重的通氣/血流比例失調等一系列ARDS的病理改變[20]。本研究中t0時肺泡組織呈明顯充血水腫,肺間質可見大量紅細胞滲出,肺泡間隔增寬,部分可見透明膜形成,符合ALI/ARDS改變。本實驗結果顯示,在t36時,以甲潑尼龍聯合氨溴索治療家豬的肺損傷最輕,肺組織SP-D水平最高。這表明在治療百草枯中毒所致的ALI方面,氨溴索和甲潑尼龍具有協同作用,提示在百草枯中毒的救治中單用激素治療效果欠佳時可以考慮加用氨溴索。近些年,在危重病的管理中,血流動力學監測處于非常重要的地位,與肺動脈導管相比,PICCO具有創傷小、費用低等優點[21-23]。通過PICCO技術獲得的EVLWI的準確性已經得到研究證實[24],且有研究顯示,ALI/ARDS的重要病理生理特點之一為EVLW增多,EVLW增多是導致低氧血癥的重要原因[25]。本研究t0時,3組家豬的EVLWI均較造模前增多,t12時3組家豬EVLWI均較t0時下降,t24、t36時較t0時升高,其中C組的EVLWI值最小,EVLWI的變化與本實驗中肺損傷的總體變化一致。
總之,甲潑尼龍聯合氨溴索在減輕百草枯中毒家豬ALI方面具有協同作用,二者聯合應用可以更好地改善百草枯中毒家豬的氧合狀況,促進肺表面活性物質的合成。本實驗存在一定的局限性,即由于觀察時間短,對于甲潑尼龍聯合氨溴索能否降低降低急性百草枯中毒家豬的病死率還需進一步探討。
1 Aqarwal R,Srinivas R,Aggarwal AN,et al.Experience with paraquat poisoning in a respiratory intensive care unit in North India[J].Singapore Med J,2006,47(12):1033-1037.
2 王伯良,涂艷陽,仲月霞,等.百草枯致大鼠多臟器損害的觀察[J].中華急診醫學雜志,2010,19(12):1296-1299.
3 劉曉偉,劉盛業,劉志,等.早期血液灌流救治急性百草枯中毒患者臨床療效分析[J].中華急診醫學雜志,2012,21(11):1205-1209.
4 Rocco PR,Souza AB,Faffe DS,et al.Effect of corticosteroid on parenchyma remodeling at lung an early phase of acute lung injury[J].Am J Respir Crit Care Med,2003,168(6):677-684.
5 Afzali S,Gholyaf M.The effectiveness of combined treatment with methylprednisolone and cyclophosphamide in oral paraquat poisoning[J].Arch Iran Med,2008,11(4):387-391.
6 Seifart C,Clostermann U,seifart U,et al.Cell-specific modulation of surfactant proteins by ambroxol treatment[J].Toxicol Appl Pharmacol,2005,203(1):27-35.
7 Stetinova V,Herout V,Kvetina J.In vitro and in vivo antioxidant activity of ambroxol[J].Clin Exp Med,2004,4(3):152-158.
8 Katzenelson R,Perel A,Berkentadt H,et al.Accuracy of transpulmonary thermodilution versus gravimetric measurement of extravascular lung water[J].Crit Care Med,2004,32(7):1550-1554.
9 SekamotoY,Mashiko K,Saito N,et al.Effectiveness of human atrial natriuretic peptide supplementation in pulmonary edema patients using the pulse contour cardiac output system[J].Yonsei Med J,2010,51(3):354-359.
10 Thompson BT,Moss M.A new definition for the acute respiratory distress syndrome[J].Semin Respir Crit Care Med,2013,34(4):441-447.
11 Ghazi-Khansari M,Mohammadi-Karakani A,Sotoudeh M,et al.Antifibrotic effect of captopril and enalaprilon paraquat-induced lung fibrosisin rats[J].J ApplToxicol,2007,27(4):342-349.
12 李曉莉,龔媛,張浩,等.環磷酰胺對百草枯中毒致急性肺損傷的療效及安全性分析[J].中國全科醫學,2013,16(9):3124-3125.
13 LI S,Crooks PA,Wei X,et al.Toxicity of dipyridyl compounds and related compounds[J].Crit Rev Toxicol,2004,34(5):447-460.
14 李海娜,蘭超.急性百草枯中毒肺損傷的激素治療[J].中國全科醫學,2014,17(5):563-565.
15 陳文清.甲強龍治療重度百草枯中毒30例療效分析[J].吉林醫學,2008,29(7):577-578.
16 袁發煥,陳楓,王沂芹,等.超致死劑量百草枯中毒老年患者救治成功1例[J].中華老年多器官疾病雜志,2013,12(6):469-472.
17 Zhi QM,Yang LT,Sun HC.Protective effect of ambroxol against paraquat-induced pulmonary fibrosis in rats[J].Intern Med,2011,50(18):1879-1887.
18 馬玉騰,杜月菊, 張軍立,等.鹽酸氨溴索對百草枯中毒大鼠肺SP-D表達及肺損傷的保護作用[J].中華急診醫學雜志,2013,22(7):737-740.
19 趙文鵬.不同劑量甲潑尼龍對大鼠急性百草枯中毒早期肺損傷的干預研究[D].石河子:石河子大學,2011.
20 Bruells CS,Rossaint R.Ventilation in acute respiratory distress:Lung-protective strategies[J].Klin Intensivmed Notfmed,2012,107(8):596-602.
21 Koo KKY,Sun JCJ,Zhou Q,et al.Pulmonary artery catheters:evolving rates and reasons for use[J].Crit Care Med,2011,39(7):1613-1618.
22 Cowie BS.Does the pulmonary artery catheter still have a role in the perioperative period? [J].Anaesth Intensive Care,2011,39(3):345-355.
23 劉曉偉,劉盛業,劉志.早期監測動脈血二氧化碳分壓對急性百草枯中毒患者預后的預測價值[J].中國全科醫學,2012,15(4):1285.
24 Kimv MY,Kuzkov W,Kuklin VN,et al.Extravoscular lung water assessed by transpulmonary single thermodilution and postmortem gravimetry in sheep[J].Crit Care,2004,8(6):R451-R458.
25 Monnet X,Anguel N,Osman D,et al.Assessing pulmonary permeability by transpulmonary thermodilution allows differentiation of hydrostatic pulmonary edema from ALI/ARDS[J].Intensive Care Med,2007,33(3):448-453.

