雌、孕激素受體和人表皮生長(zhǎng)因子受體2共表達(dá)用于高級(jí)別漿液性卵巢癌患者復(fù)發(fā)預(yù)測(cè)的價(jià)值研究
吳 鵬,朱筧青,鄭智國(guó)
卵巢癌是女性生殖系統(tǒng)常見(jiàn)的腫瘤之一,其死亡率居?jì)D科腫瘤之首。據(jù)報(bào)道Ⅲ期卵巢癌患者的5年生存率僅為29.0%,近幾十年來(lái),其總生存率未得到明顯改善[1]。高級(jí)別漿液性卵巢癌在上皮性卵巢癌中占大多數(shù),超過(guò)2/3[2]。越來(lái)越多的證據(jù)表明高級(jí)別漿液性卵巢癌有別于其他卵巢癌亞型,幾乎所有高級(jí)別漿液性卵巢癌均有P53突變,其他常見(jiàn)突變基因見(jiàn)于控制DNA雙鏈斷裂同源重組修復(fù)途徑,如BRCA1/2、PALB2、RAD51、RAD50、BARD1、CHK2和BRIP1等[3]。因而,近年來(lái)高級(jí)別漿液性卵巢癌受到越來(lái)越多科學(xué)家的關(guān)注。治療后復(fù)發(fā)是影響高級(jí)別漿液性卵巢癌患者存活率的重要因素,大多數(shù)進(jìn)展期高級(jí)別漿液性卵巢癌患者在標(biāo)準(zhǔn)治療(減瘤術(shù)+化療)后幾個(gè)月或幾年內(nèi)復(fù)發(fā)。其復(fù)發(fā)風(fēng)險(xiǎn)明顯受病理分期和術(shù)后殘留灶大小影響,但目前的研究還不足以準(zhǔn)確地預(yù)測(cè)患者復(fù)發(fā)風(fēng)險(xiǎn),因而還需要尋找更多的復(fù)發(fā)預(yù)測(cè)分子標(biāo)志物,以便更好地指導(dǎo)卵巢癌患者個(gè)性化治療[4]。P53、人表皮生長(zhǎng)因子受體2(CerbB-2)、雌激素受體(ER)和孕激素受體(PR)的表達(dá)情況在卵巢癌患者中的預(yù)后價(jià)值已有研究[5-6],而其在高級(jí)別漿液性卵巢癌復(fù)發(fā)的預(yù)測(cè)價(jià)值研究較少。CerbB-2、ER和PR共表達(dá)對(duì)高級(jí)別漿液性卵巢癌中的復(fù)發(fā)預(yù)測(cè)價(jià)值鮮見(jiàn)報(bào)道。本研究應(yīng)用免疫組化技術(shù)檢測(cè)高級(jí)別漿液性卵巢癌中P53、CerbB-2、ER和PR的表達(dá)情況,探討其與患者無(wú)復(fù)發(fā)生存時(shí)間(RFS)的關(guān)系。
1 資料與方法
1.1 一般資料 入選標(biāo)準(zhǔn):(1)Ⅲ~Ⅳ期高級(jí)別漿液性卵巢癌;(2)本院首診并接受手術(shù)和鉑類(lèi)藥物為基礎(chǔ)的化療;(3)標(biāo)準(zhǔn)治療后已治愈且復(fù)發(fā)后來(lái)本院接受后續(xù)治療。根據(jù)以上標(biāo)準(zhǔn),選取2002年9月—2011年2月入住本院的高級(jí)別漿液性卵巢癌患者32例。患者年齡39~69歲,平均(51.8±7.6)歲;宮頸癌國(guó)際婦產(chǎn)科聯(lián)盟(FIGO)分期Ⅲ期30例、Ⅳ期2例,且所有標(biāo)本均經(jīng)本院病理科確診。高級(jí)別漿液性卵巢癌患者RFS≥12個(gè)月為預(yù)后良好,RFS<12個(gè)月為預(yù)后差;以12個(gè)月為界,將患者分為RFS≥12個(gè)月組(18例)和RFS<12個(gè)月組(14例),兩組的平均年齡分別為(51.0±8.1)和(52.8±7.1)歲,差異無(wú)統(tǒng)計(jì)學(xué)意義(t=-0.654,P=0.518)。所有患者或家屬對(duì)研究知情同意。
1.2 方法
1.2.1 標(biāo)本的處理 組織標(biāo)本用10%中性甲酫溶液及時(shí)固定,后經(jīng)梯度乙醇(75%、85%、95%、100%)脫水,二甲苯透明,浸蠟后石蠟包埋。
1.2.2 免疫組化實(shí)驗(yàn) 采用超敏試劑盒(均購(gòu)自正規(guī)試劑公司)檢測(cè)P53、CerbB-2、ER和PR抗體。按試劑盒說(shuō)明書(shū)步驟進(jìn)行染色,檸檬酸高溫修復(fù),二氨基聯(lián)苯胺(DAB)顯色,將已知陽(yáng)性片作為陽(yáng)性對(duì)照。實(shí)驗(yàn)結(jié)果判斷:以CerbB-2陽(yáng)性表達(dá)位于細(xì)胞膜和細(xì)胞質(zhì),P53、ER和PR陽(yáng)性表達(dá)位于細(xì)胞核,呈棕黃色顆粒狀為陽(yáng)性表達(dá)。免疫組化定量分析(半定量)根據(jù)細(xì)胞著色深度及陽(yáng)性細(xì)胞數(shù)分別記分為0~3分,著色深度以多數(shù)細(xì)胞呈色程度為準(zhǔn)。凡細(xì)胞核或細(xì)胞膜內(nèi)著淺棕色者為1分、棕色者為2分、深棕色者為3分、不著色為0分;鏡下視野中陽(yáng)性細(xì)胞占所有細(xì)胞的比例<10%為1分、10%~50%為2分、>50%為3分。根據(jù)上述兩項(xiàng)指標(biāo)的積分?jǐn)?shù)分為4級(jí),0分為陰性(-)、2~3分為弱陽(yáng)性(+)低表達(dá)、4分為陽(yáng)性(++)中表達(dá)、5~6分為強(qiáng)陽(yáng)性(+++)高表達(dá)[7]。
1.2.3 RFS判斷標(biāo)準(zhǔn) 患者接受標(biāo)準(zhǔn)治療后獲得臨床治愈,RFS為從末次化療到復(fù)發(fā)時(shí)間,復(fù)發(fā)標(biāo)準(zhǔn)為臨床復(fù)發(fā)證據(jù)(婦科檢查或影像學(xué)檢查提示腫塊)出現(xiàn)或血清糖類(lèi)抗原125(CA125)持續(xù)升高。

2 結(jié)果
2.1 P53、CerbB-2、ER和PR在高級(jí)別漿液性卵巢癌患者中的表達(dá)情況 P53蛋白主要定位于細(xì)胞核,陽(yáng)性細(xì)胞核被染成棕黃色,胞膜、胞質(zhì)均無(wú)著色;CerbB-2主要表達(dá)于細(xì)胞膜,細(xì)胞膜染成棕黃色,鏡下見(jiàn)陽(yáng)性細(xì)胞呈片狀表達(dá);ER免疫組化染色切片中,可見(jiàn)棕黃色或橘黃色顆粒位于細(xì)胞核內(nèi),胞質(zhì)和胞膜未見(jiàn)染色顆粒;PR陽(yáng)性表達(dá)情況與ER類(lèi)似(見(jiàn)圖1)。32例高級(jí)別漿液性卵巢癌患者中,P53、CerbB-2、ER和PR的陽(yáng)性表達(dá)率見(jiàn)表1。
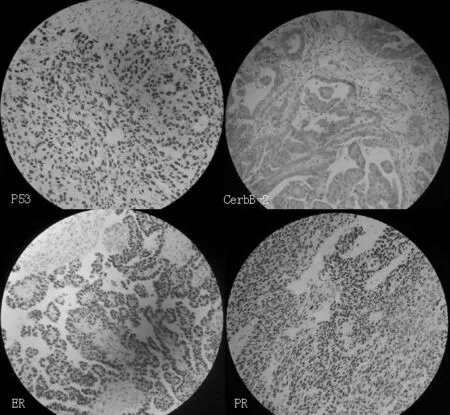
注:CerbB-2=人表皮生長(zhǎng)因子受體2,ER=雌激素受體,PR=孕激素受體
圖1 組織切片中P53、CerbB-2、ER和PR表達(dá)情況(×400)
Figure1 Expression of P53,CerbB-2,ER and PR in tissue sections
2.2 不同RFS的高級(jí)別漿液性卵巢癌患者中P53、CerbB-2、ER和PR陽(yáng)性表達(dá)率的比較 不同RFS的高級(jí)別漿液性卵巢癌患者P53、ER和PR的陽(yáng)性表達(dá)率比較,差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05);RFS<12個(gè)月組CerbB-2的陽(yáng)性表達(dá)率高于RFS≥12個(gè)月組,差異有統(tǒng)計(jì)學(xué)意義(P<0.05,見(jiàn)表2)。
2.3 不同RFS的高級(jí)別漿液性卵巢癌患者CerbB-2、ER和PR共表達(dá)情況 進(jìn)一步對(duì)CerbB-2、ER和PR的共表達(dá)情況進(jìn)行分析。以CerbB-2陰性、ER陽(yáng)性或PR陰性為標(biāo)準(zhǔn),同一個(gè)患者只要符合2個(gè)及以上標(biāo)準(zhǔn)即為共表達(dá)陽(yáng)性(表明患者復(fù)發(fā)風(fēng)險(xiǎn)低),其余情況為陰性。RFS≥12個(gè)月組CerbB-2、ER和PR共表達(dá)陽(yáng)性率高于RFS<12個(gè)月組,差異有統(tǒng)計(jì)學(xué)意義(χ2=7.619,P=0.008,見(jiàn)表3)。
表1 P53、CerbB-2、ER和PR在高級(jí)別漿液性卵巢癌患者中的表達(dá)情況
Table1 Expression of P53,CerbB-2,ER and PR in high-level serous ovarian cancer patients
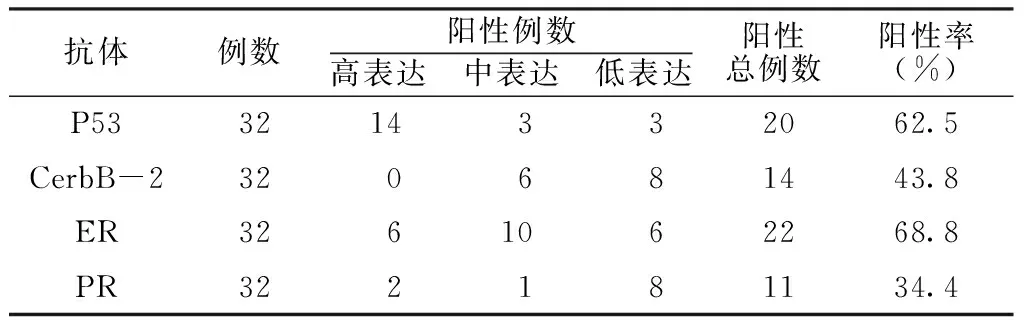
抗體例數(shù)陽(yáng)性例數(shù)高表達(dá) 中表達(dá) 低表達(dá)陽(yáng)性總例數(shù)陽(yáng)性率(%)P533214332062.5CerbB-2320681443.8ER3261062268.8PR322181134.4
表3 不同RFS的高級(jí)別漿液性卵巢癌患者CerbB-2、ER和PR共表達(dá)陽(yáng)性率的比較〔n(%)〕
Table3 Comparison of the positive co-expression rates of CerbB-2,ER and PR in high-level serous ovarian cancer patients with different RFSs

組別例數(shù)CerbB-2、ER、PR共表達(dá)為陽(yáng)性CerbB-2、ER、PR共表達(dá)為陰性RFS≥12個(gè)月組1815(83.3)3(16.7)RFS<12個(gè)月組145(35.7)9(64.3)
3 討論
高級(jí)別漿液性卵巢癌是卵巢癌中最常見(jiàn)的一個(gè)亞型,臨床診斷時(shí)往往為晚期。雖然經(jīng)過(guò)標(biāo)準(zhǔn)治療后大多數(shù)患者能夠獲得臨床治愈,但由于其易復(fù)發(fā)和耐藥等原因,患者的5年生存率僅為35.0%~40.0%[4]。
P53基因是一個(gè)經(jīng)典的抑癌基因,幾乎所有高級(jí)別漿液性卵巢癌患者均存在P53突變[3]。K?bel等[8]通過(guò)對(duì)502例位于骨盆的高級(jí)別漿液性卵巢癌患者分析發(fā)現(xiàn)P53過(guò)表達(dá)預(yù)示著復(fù)發(fā)風(fēng)險(xiǎn)小。本研究顯示,不同RFS的高級(jí)別漿液性卵巢癌患者P53陽(yáng)性表達(dá)率間無(wú)明顯差異,提示P53表達(dá)情況與RFS無(wú)關(guān),這可能與本研究納入分析樣本數(shù)量少和病理分期晚等因素有關(guān)。
CerbB-2是一個(gè)癌基因,多數(shù)研究認(rèn)為CerbB-2表達(dá)陽(yáng)性的卵巢癌患者預(yù)后差[9]。Sueblinvong等[10]研究發(fā)現(xiàn)早期上皮性卵巢癌患者CerbB-2過(guò)表達(dá)與患者預(yù)后無(wú)關(guān)。可見(jiàn)由于納入研究患者的分期不同,即使同一個(gè)分子標(biāo)志物的臨床價(jià)值也有差異。本研究結(jié)果表明RFS<12個(gè)月組CerbB-2的陽(yáng)性表達(dá)率高于RFS≥12個(gè)月組,提示CerbB-2陽(yáng)性患者預(yù)后差。結(jié)合文獻(xiàn)報(bào)道可以推測(cè)CerbB-2在晚期卵巢癌細(xì)胞中起著重要的生物學(xué)功能,其過(guò)表達(dá)時(shí)癌細(xì)胞惡性程度更高。
有研究通過(guò)對(duì)106例卵巢癌患者進(jìn)行分析,ER和PR陽(yáng)性表達(dá)率分別為39.6%和33.0%,ER陽(yáng)性表達(dá)率在高級(jí)別卵巢癌中明顯增加,但ER表達(dá)與預(yù)后沒(méi)有密切關(guān)系,而PR與RFS和總生存期(OS)有一定關(guān)系(基于單變量分析)[6]。本研究發(fā)現(xiàn)ER和PR的陽(yáng)性表達(dá)率分別為68.8%和34.4%,ER陽(yáng)性表達(dá)率明顯高于文獻(xiàn)報(bào)道,可能與本研究對(duì)象均為高級(jí)別漿液性卵巢癌患者有關(guān)。但不同RFS的高級(jí)別漿液性卵巢癌患者ER和PR的陽(yáng)性表達(dá)率間無(wú)明顯差異,提示ER和PR的表達(dá)情況與RFS無(wú)關(guān)。
本研究進(jìn)一步分析發(fā)現(xiàn)CerbB-2陰性、ER陽(yáng)性或PR陰性(其中符合2個(gè)及以上標(biāo)準(zhǔn))的患者復(fù)發(fā)風(fēng)險(xiǎn)低,但還需要更多的病例研究來(lái)驗(yàn)證。另外,CerbB-2、ER和PR的共表達(dá)是否有明確的生物學(xué)功能也還需要進(jìn)一步研究。
有研究表明,對(duì)于完成手術(shù)和化療后臨床已完全緩解的卵巢癌患者,隨訪監(jiān)測(cè)發(fā)現(xiàn)無(wú)癥狀復(fù)發(fā)患者治療后的總生存率(71.9%)明顯高于有癥狀復(fù)發(fā)患者(50.7%)[11]。近年各國(guó)科學(xué)家也致力于卵巢癌首次治療后復(fù)發(fā)控制的藥物研究,如帕唑帕尼(pazopanib)[12]。然而在實(shí)施復(fù)發(fā)控制前最好能明確哪些卵巢癌患者能從中受益,因此,首次治療后對(duì)復(fù)發(fā)風(fēng)險(xiǎn)的有效預(yù)測(cè)和復(fù)發(fā)的早期診斷已經(jīng)成為業(yè)內(nèi)關(guān)注的熱點(diǎn)。本研究提示聯(lián)合檢測(cè)CerbB-2、ER和PR可作為預(yù)測(cè)高級(jí)別漿液性卵巢癌患者復(fù)發(fā)風(fēng)險(xiǎn)的潛在標(biāo)志物,但還需要進(jìn)一步擴(kuò)大樣本量來(lái)驗(yàn)證。
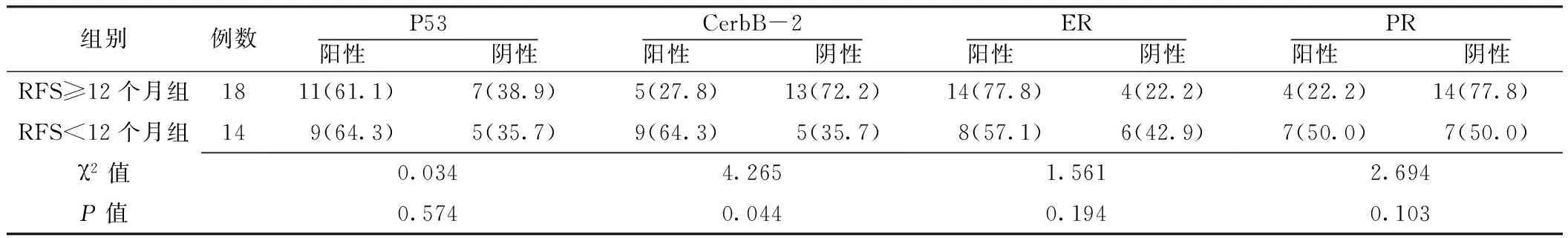
表2 不同RFS的高級(jí)別漿液性卵巢癌患者P53、CerbB-2、ER、PR陽(yáng)性表達(dá)率的比較〔n(%)〕
1 Vaughan S,Coward JI,Bast RC Jr,et al.Rethinking ovarian cancer:recommendations for improving outcomes[J].Nat Rev Cancer,2011,11(10):719-725.
2 Prat J.New insights into ovarian cancer pathology[J].Annals of Oncology,2012,23(Suppl 10):x111-x117.
3 Cancer Genome Atlas Research Network.Integrated genomic analyses of ovarian carcinoma[J].Nature,2011,474(7353):609-615.
4 Berns EM,Bowtell DD.The changing view of high-grade serous ovarian cancer[J].Cancer Research,2012,72(11):2701-2704.
5 Hofstetter G,Berger A,Fiegl H,et al.Alternative splicing of p53 and p73:the novel p53 splice variant p53delta is an independent prognostic marker in ovarian cancer[J].Oncogene,2010,29(13):1997-2004.
6 Tangjitgamol S,Manusirivithaya S,Khunnarong J,et al.Expressions of estrogen and progesterone receptors in epithelial ovarian cancer:a clinicopathologic study[J].International Journal of Gynecological Cancer,2009,19(4):620-627.
7 Remmele W, Stegner HE.Recommendation for uniform definition of an immunoreactive score (IRS) for immunohistochemical estrogen receptor detection(ER-ICA) in breast cancer tissue〗[J].Pathologe,1987, 8(3):138-140.
8 K?bel M,Reuss A,Bois A,et al.The biological and clinical value of p53 expression in pelvic high-grade serous carcinomas[J].The Journal of Pathology,2010,222(2):191-198.
9 Lafky JM,Wilken JA,Baron AT,et al.Clinical implications of the ErbB/epidermal growth factor(EGF) receptor family and its ligands in ovarian cancer[J].Biochim Biophys Acta,2008,1785(2):232-265.
10 Sueblinvong T,Manchana T,Khemapech N,et al.Lack of prognostic significance of HER-2/neu in early epithelial ovarian cancer[J].Asian Pac J Cancer Prev,2007,8(4):502-506.
11 Tanner EJ,Chi DS,Eisenhauer EL,et al.Surveillance for the detection of recurrent ovarian cancer:survival impact or lead-time bias?[J].Gynecologic Oncology,2010,117(2):336-340.
12 Kim K,Ryu SY.Major clinical research advances in gynecologic cancer 2009[J].Journal of Gynecologic Oncology,2009,20(4):203-209.

