L-半胱氨酸與發酵酸漿協同作用優化玉米濕磨工藝
李曉娜,張莉力,穆 靜,李新華,
(1.沈陽農業大學食品學院,遼寧 沈陽 110866;2.遼寧醫學院食品科學與工程學院,遼寧 錦州 121001)
傳統的玉米濕磨工藝是采用0.2%~0.3%的亞硫酸水溶液,在(50±2)℃條件下浸泡玉米粒40~60 h,在浸泡的過程中產生或添加部分乳酸和SO2協同作用,可增強對玉米的浸漬效果[1-2]。SO2具有還原性,可以還原二硫鍵,打破淀粉與蛋白質間的結合,釋放玉米淀粉。但SO2對大氣可造成嚴重污染且對人體的健康造成危害[3-5],在生產的過程中減少SO2的使用,可以減輕環境污染,有利于玉米淀粉產業的進一步發展。目前,一些研究采用酶法或發酵液浸泡玉米粒,或采用分步浸泡粉碎的方法改進玉米淀粉提取工藝取得了一定的效果[6-12]。
L-半胱氨酸是具有活潑巰基(—SH)的氨基酸,酸性條件下穩定,能還原二硫鍵化合物,削弱蛋白質間的結合[13-16]。因而L-半胱氨酸能夠打破玉米淀粉與蛋白的結合作用,提取玉米淀粉。酸漿是在淀粉生產過程中,自然發酵而成的一種微酸味的淡乳白色液體,含有大量乳酸菌,具有凝集淀粉顆粒的能力,淀粉乳加入酸漿后,淀粉顆粒脫離了大部分蛋白質的吸附作用,沉降速度加快,從而使淀粉與蛋白質和一些細纖維分離開[17-21]。本實驗采用加入L-半胱氨酸的玉米酸漿浸泡玉米,利用L-半胱氨酸使包裹在玉米淀粉外層蛋白質的二硫鍵斷裂生成巰基,酸漿能夠迅速沉降玉米淀粉的機理,縮短玉米淀粉與蛋白的分離時間,提高生產效率,以探求不使用亞硫酸水溶液浸泡的環境友好型玉米濕磨工藝。
1 材料與方法
1.1 材料與試劑
玉米:產地錦州,淀粉質量分數71.26%(干基),水分質量分數11.94%;副干酪乳桿菌副干酪亞種L1:生產甘薯淀粉用酸漿中提取,本實驗室保存。
氫氧化鈉、鹽酸、考馬斯亮藍G-250、乙醇、磷酸、牛血清白蛋白、L-半胱氨酸均為分析純。
MRS培養基配方:蛋白胨10.0 g,牛肉膏10.0 g,酵母膏5.0 g,檸檬酸氫二銨2.0 g,乙酸鈉5.0 g,磷酸氫二鉀2.0 g,硫酸錳0.25 g,硫酸鎂0.58 g,葡萄糖20.0 g,吐溫1.0 mL,水1 000 mL,pH值為6.8。
1.2 儀器與設備
WFJ7200型分光光度計 尤尼柯(上海)儀器有限公司;HJ-3調溫磁力攪拌器 金壇市晨陽電子儀器廠;pHS-3C pH計 上海雷磁儀器廠;DHG恒溫鼓風干燥箱 上海精密儀器儀表有限公司。
1.3 方法
1.3.1 酸漿的制作
玉米粒加水磨漿(1∶3,m/V),200 目過濾后調pH值至4.0左右沉降蛋白質,靜置后取上清液,加入乳糖1%,酵母膏1%,煮沸。冷卻后調pH值至6.8左右,濾紙過濾,濾液121 ℃滅菌20 min。冷卻后接入10% MRS培養基活化的副干酪乳桿菌,30 ℃培養48 h,制成純培養玉米酸漿。將純培養的玉米酸漿倒入磨漿后的玉米汁中,沉降蛋白質后,倒出上清液,將上清液接入10%純培養玉米酸漿,制成自然發酵玉米酸漿,之后不斷兌入提取淀粉后的廢棄玉米酸漿,反復發酵培養[17-18,22-23]。
1.3.2 玉米濕磨工藝
50 g玉米粒破碎成6~8瓣→加入酸漿(1∶3,m/V)→加入酸漿體積1%的L-半胱氨酸→30 ℃浸泡48 h→充分攪拌,除去浮于液面上層的胚→加入1 000 mL水磨漿→200 目過濾→濾液30 ℃攪拌1 h→靜置→除去上層漿液及麩質→加入清水洗滌→收集淀粉→烘干。
1.3.3 可溶性蛋白質增量的測定
采用考馬斯亮藍法測定溶液中可溶性蛋白含量[7]。可溶性蛋白質增量為浸泡后浸泡液中可溶性蛋白質含量與浸泡前加入L-半胱氨酸后的浸泡液中可溶性蛋白質含量的差值。
1.3.4 玉米淀粉提取率
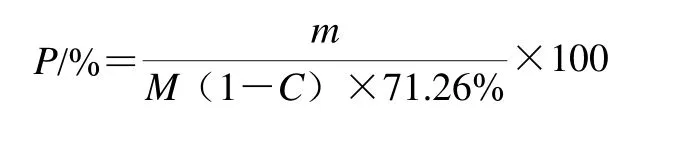
式中:P為玉米淀粉提取率/%;m為提取出的玉米淀粉質量(干基)/g;M為浸泡用玉米質量/g;71.26%為淀粉質量分數;C為玉米水分含量/%。
1.3.5 最佳濕磨工藝參數優化
采用單因素試驗考察浸泡過程中酸漿用量、菌種接入量、L-半胱氨酸用量以及影響菌種活性和L-半胱氨酸作用效果的浸泡溫度、浸泡pH值、浸泡時間對玉米濕磨工藝的影響,每次改變一個因素,測定浸泡液中可溶性蛋白質的增量和淀粉提取率。每組重復3 次取平均值。在單因素試驗的基礎上,采用響應面法優化玉米濕磨工藝參數。
根據單因素試驗結果,選擇對副干酪乳桿菌活力和L-半胱氨酸作用效果均有較大影響的浸泡pH值、浸泡時間以及對浸泡效果影響較大的L-半胱氨酸用量為自變量,淀粉提取率為響應值,設計三因素三水平的二次回歸方程擬合自變量和淀粉提取率之間的函數關系,優化最佳浸泡參數。其他因素取值為:自然發酵酸漿用量比(m(玉米粒質量)∶V(酸漿體積))為1∶4,浸泡溫度30 ℃。試驗設計因素水平見表1。

表1 響應面分析因素水平表Table 1 Factors and levels in response surface analysis
1.3.6L-半胱氨酸與酸漿協同作用濕磨工藝與SO2濕磨工藝比較
分別采用L-半胱氨酸與酸漿協同作用濕磨工藝(浸泡時間為48 h、L-半胱氨酸質量濃度1.5 g/100 mL、浸泡pH 7、自然發酵酸漿用量比(m(玉米粒質量)∶V(酸漿體積))1∶4、浸泡溫度30 ℃)與傳統SO2濕磨工藝((50±2) ℃,乳酸0.5%,SO20.2% 浸泡50 h)提取玉米淀粉。從組分含量、浸泡溫度、浸泡時間等方面評價L-半胱氨酸與酸漿協同下的玉米濕磨工藝。
2 結果與分析
2.1 酸漿用量比對浸泡液中可溶性蛋白質增量和玉米淀粉提取率的影響
由圖1可以看出,當酸漿體積用量與玉米粒質量比為2∶1時,蛋白質的增加量為0.217 5 mg/mL。之后隨著酸漿用量的增大,蛋白質增加。當酸漿用量比為1∶5時,可溶性蛋白質增量最大。但再增加酸漿用量,可溶性蛋白質增量減少。這主要是由于酸漿過少,不利于蛋白質溶出。酸漿用量的增加,加速玉米粒吸水膨脹,進而削弱淀粉與蛋白質間的結合,加速蛋白質溶解[4]。當浸泡液中酸度增加,蛋白質溶解度降低。

圖1 酸漿用量比對浸泡液中可溶性蛋白質增量和玉米淀粉提取率的影響Fig.1 Effect of acid liquid amount on soluble protein increment and the extraction yield of corn starch
浸泡后的玉米加水磨漿后靜置,在酸漿的作用下玉米淀粉迅速沉降,除去上層麩質后收集淀粉烘干。由圖1可以看出,隨著酸漿用量的增加,淀粉質量先增加后減少。當酸漿用量比為1∶4時淀粉提取率最高,為95.45%。隨著酸漿用量的增加,部分蛋白質溶解,有利于釋放玉米淀粉。但酸漿用量增大,溶液酸性增強,副干酪乳桿菌的絮凝活性減弱,不利于酸漿中淀粉與蛋白的分離[24]。實驗同時采用整粒玉米浸泡,加水磨漿后靜置沉淀,淀粉與蛋白質仍有聯結,未分開。這可能是由于L-半胱氨酸分子較大,在浸泡的過程中很難進入玉米胚乳的內部破壞玉米淀粉與蛋白的結合,不能釋放玉米淀粉。所以宜采用碎粒浸泡,酸漿的用量比以1∶4為最佳。2.2L-半胱氨酸用量對浸泡液中可溶性蛋白質增量和玉米淀粉提取率的影響

圖2 L-半胱氨酸用量對玉米淀粉提取率和浸泡液中可溶性蛋白質的影響Fig.2 Effect of L-cysteine amount on soluble protein increment and the extraction yield of corn starch
L-半胱氨酸作為食品添加劑已廣泛應用在面制品中[25-28]。在酸漿中L-半胱氨酸可以破壞玉米淀粉外層蛋白質的二硫鍵,使蛋白質結構展開,提高蛋白質的溶解度。由圖2可知,隨著L-半胱氨酸用量的增加,可溶性蛋白質增量逐漸增大。當L-半胱氨酸質量濃度大于2.0 g/100 mL時可溶性蛋白質增量增加緩慢。在L-半胱氨酸作用下,玉米淀粉游離出來,在副干酪乳桿菌的作用下迅速沉降。當L-半胱氨酸質量濃度0.5 g/100 mL時,淀粉提取率為62.32%,淀粉與蛋白質分離較少。隨著L-半胱氨酸用量的增大,淀粉提取率增加,當L-半胱氨酸質量濃度為1.0 g/100 mL與2.5 g/100 mL時,淀粉提取率分別為89.45%和92.71%。當L-半胱氨酸1.0 g/100 mL之后淀粉提取率增加緩慢。
2.3 浸泡時間對浸泡液中可溶性蛋白質增量和玉米淀粉提取率的影響
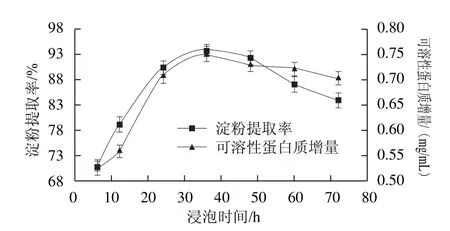
圖3 浸泡時間對玉米淀粉提取率和浸泡液中可溶性蛋白質增量的影響Fig.3 Effect of steeping time on soluble protein increment and the extraction yield of corn starch
發酵酸漿中的副干酪乳桿菌絮凝活性以及L-半胱氨酸的作用效果都與浸泡時間有關。在浸泡過程中,酸漿中的副干酪乳桿菌吸收浸泡液中的營養成分,迅速繁殖生長。副干酪乳桿菌生長的過程中產生乳酸,有助于蛋白質的分解,并能防止腐敗菌生長。隨著浸泡時間的延長,酸漿與玉米碎粒接觸充分,玉米淀粉外層包裹的層層蛋白質被逐漸分解,可溶性蛋白含量增加。由圖3可知,在6~36 h范圍內,可溶性蛋白質增加較快,36 h達到最大,但繼續延長浸泡時間,可溶性蛋白質增量略有減少。可能是由于浸泡液酸性增強導致蛋白質溶解度降低。隨著副干酪乳桿菌的生長,酸漿沉降淀粉的能力增強[24],有利于游離淀粉的分離。當浸泡時間為6~12 h時,淀粉與蛋白質分離效果較差,淀粉外包裹著少部分蛋白,淀粉較黃,酸漿沉降淀粉的速度較慢。當浸泡時間為36 h時,淀粉提取率最高,為93.71%。浸泡時間繼續延長,淀粉提取率下降。這是由于隨著時間的延長,副干酪乳桿菌進入衰亡期,絮凝活性降低,沉降淀粉的能力下降,淀粉與蛋白質分離不徹底[27]。
2.4 浸泡溫度對浸泡液中可溶性蛋白質增量和玉米淀粉提取率的影響
有研究表明,副干酪乳桿菌在25~35 ℃之間生長旺盛和沉降淀粉能力較強,對淀粉和蛋白質等雜質的分離效果較好[24]。溫度略高,可以促進L-半胱氨酸的滲透作用,加快反應速度。由圖4可知,隨著浸泡溫度的升高,可溶性蛋白質增量先增加后降低。當浸泡溫度為30 ℃時,可溶性蛋白質增量最大,為0.578 6 mg/mL。當浸泡溫度為15 ℃時,淀粉提取率較低,僅為51.81%,當浸泡溫度為30 ℃時,淀粉提取率最高為94.78%。因此酸漿與L-半胱氨酸協同作用浸泡玉米的最佳浸泡溫度為30 ℃,此溫度條件下副干酪乳桿菌的活力和產酸能力強,能有效促進蛋白質分解和淀粉沉降。
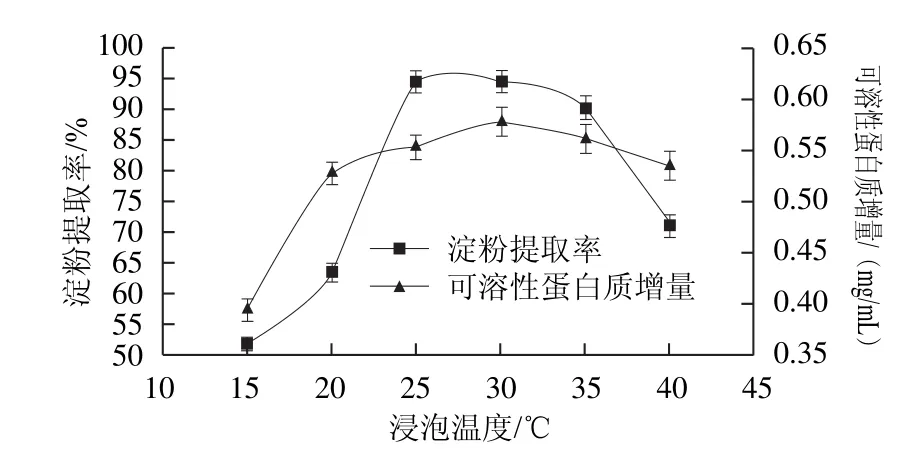
圖4 浸泡溫度對玉米淀粉提取率和浸泡液中可溶性蛋白質增量的影響Fig.4 Effect of steeping temperature on soluble protein increment and the extraction yield of corn starch
2.5 浸泡pH值對浸泡液中可溶性蛋白質增量和玉米淀粉提取率的影響
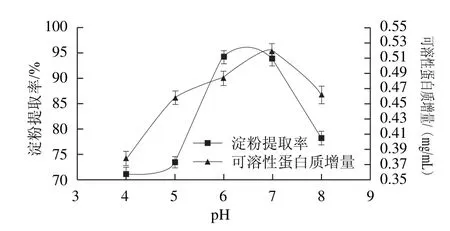
圖5 浸泡pH值對玉米淀粉提取率和浸泡液中可溶性蛋白質增量的影響Fig.5 Effect of pH on soluble protein increment and the extraction yield of corn starch
L-半胱氨酸在酸性溶液中穩定,還原能力強。但溶液過酸,副干酪乳桿菌生長受到抑制[24],產酸和沉降淀粉能力減弱,浸泡效果不好。所以溶液過酸或偏堿性都可能影響蛋白質的溶出和淀粉釋放。由圖5可知,pH值4~7時,可溶性蛋白的增量隨著pH值的增加而增大,當pH值為8時可溶性蛋白的增量減少。可以看出堿性條件下L-半胱氨酸還原二硫鍵的能力較差,不利于蛋白質的溶解。浸泡液的pH值為4~5時,淀粉仍與蛋白質結合,淀粉質量較少且顏色較黃。當pH值為6~8時提取的淀粉質量好,淀粉與蛋白質分離徹底,淀粉較白。這是由于副干酪乳桿菌在pH 6~8條件下生長均較好,且L-半胱氨酸穩定性好,絮凝率也較高,有利于打破玉米淀粉與蛋白質的結合,使玉米淀粉游離出來。
2.6 副干酪乳桿菌接入量對浸泡液中可溶性蛋白質增量和玉米淀粉提取率的影響
在玉米漿中分別接入酸漿體積10%、15%、20%、30%和50%的MRS培養基活化的副干酪乳桿菌,制成不同接種量的酸漿,經反復自然發酵后,浸泡碎玉米粒48 h。由圖6可以看出,菌種接入量增大,副干酪乳桿菌浸泡效果增強。當接種量為10%時,可溶性蛋白質增量為0.293 6 mg/mL,接種量為50%時,可溶性蛋白質增量為0.538 1 mg/mL。但當接種量大于30%時,可溶性蛋白質增加緩慢。菌種接入量增大,副干酪乳桿菌沉降淀粉的能力增強,有效地促進淀粉與蛋白質的分離。當菌種接入量為50%時,在30 s之內與麩質迅速分離,提取率為94.09%。
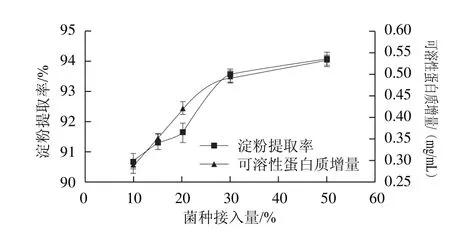
圖6 副干酪乳桿菌接入量對玉米淀粉提取率和浸泡液中可溶性蛋白質增量的影響Fig.6 Effect of inoculum size of Lactobacillus paracasei subsp.paracasei L1 on soluble protein increment and the extraction yield of corn starch
2.7 響應面試驗分析
2.7.1 響應面試驗設計與結果
根據Box-Behnken試驗設計原理,設計響應面試驗[29]。試驗設計與結果見表2。

表2 工藝參數優化響應面試驗設計及結果Table 2 Experimental design and results for response surface analysis
2.7.2 方差分析
通過Design-Expert 8.0軟件的Box-Behnken程序對試驗結果進行響應面分析,經二次回歸擬合后,得出回歸模型參數估計值、方差分析見表3。
對表3中試驗數據進行回歸擬合分析得到回歸方程為:Y=94.18+2.11A+1.05B+2.27C-1.13AB+0.99AC+0.19BC-3.91A2-5.09B2-2.48C2。由表3可知,模型P<0.01,表明響應回歸方程達到了極顯著水平,相關系數R2=0.982 5,表明98.25%的數據可以用此方程來解釋,因而該模型擬合程度良好。RSN(信噪比)為19.374,遠大于4,可知回歸方程可信度很高,試驗誤差較小,因此可用此模型對玉米淀粉提取率進行分析和預測。從模型的失擬性方差分析可以看出,失擬項P>0.05,不顯著,表明所得方程與實際擬合中非正常誤差所占比例小,方程能很好地預測各因素對玉米淀粉提取率的變化。各因素影響程度從大到小的依次排列為浸泡pH值、浸泡時間和L-半胱氨酸用量。其中浸泡pH值(0.000 2)與浸泡時間(0.000 3)均達到極顯著水平,L-半胱氨酸用量(0.012 6)達到了顯著水平。浸泡時間、浸泡pH值和L-半胱氨酸用量二次項對淀粉提取率影響極顯著。浸泡時間和L-半胱氨酸用量的交互作用(0.039 2)影響顯著。

表3 回歸模型方差分析結果Table 3 Analyses of variances for the established regression model
2.7.3 交互作用分析
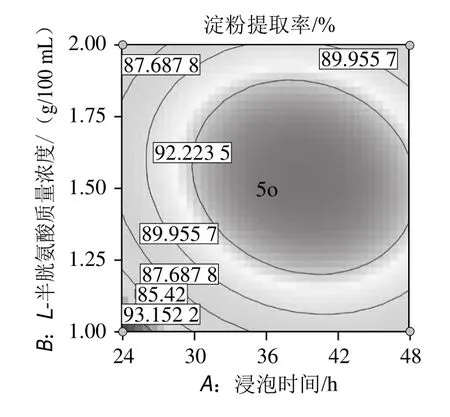
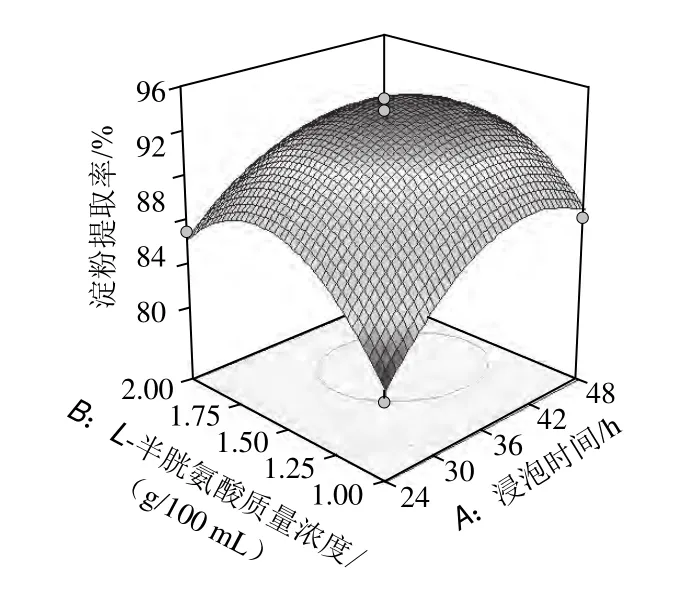
圖7 浸泡時間與L-半胱氨酸用量交互作用的響應面和等高線圖Fig.7 Response surface and contour plots for the interaction between steeping time and L-cysteine amount
根據圖7中響應面及圖中的等高線的形狀分析浸泡時間和L-半胱氨酸用量對淀粉提取率的影響,由圖7可以看出,交互作用顯著,對淀粉提取率的影響較強。隨著L-半胱氨酸用量的增加,淀粉提取率先增加后減少。隨著浸泡時間的延長,淀粉提取率先增加后略有減少。
2.7.4 驗證實驗
通過對回歸模型求解方程,對淀粉提取率的最大值進行預測為93.45%,預測參數為浸泡時間48 h、L-半胱氨酸質量濃度1.5 g/100 mL、浸泡pH值為6.83。根據實際情況,選擇浸泡時間48 h、L-半胱氨酸質量濃度1.5 g/100 mL、浸泡pH 7進行3次驗證實驗,淀粉提取率的平均值為93.21%。與預測值差異為0.24%,說明回歸方程與實際吻合較好,能夠較真實反映酸漿法生產玉米淀粉工藝中淀粉的提取率。
2.8L-半胱氨酸與酸漿協同作用濕磨工藝與SO2濕磨工藝比較

表4 L-半胱氨酸與酸漿協同作用濕磨工藝與SO2濕磨工藝對比Table 4 Comparison of wet milling using sulfur dioxide and synergistic action of L-cysteine and acid liquid
由表4可以看出,由L-半胱氨酸結合玉米酸漿玉米濕磨工藝中淀粉提取率高于傳統SO2濕磨工藝,總絕干物質收率也高于傳統方法。L-半胱氨酸與酸漿協同作用濕磨工藝能夠在較低的溫度條件下提取玉米淀粉,浸泡時間略低于SO2濕磨工藝。由表5可知,浸泡用的玉米酸漿能夠反復發酵使用,不但可以解決傳統方法中的環境污染問題,也有利于節約生產成本。玉米酸漿中具有絮凝活性的副干酪乳桿菌發酵液能夠使玉米淀粉迅速沉降,減少淀粉與麩質的分離時間。L-半胱氨酸試劑成本雖然高于SO2,但用此法能耗低,生產設備損耗小,污水處理費用較低,降低部分生產成本,為環境友好型玉米濕磨工藝提供可能性。

表5 L-半胱氨酸與酸漿協同作用濕磨工藝與SO2濕磨工藝優缺點比較Table 5 Comparisons of the advantages and disadvantages of wet milling using sulfur dioxide and synergistic action of L-cysteine and acid liquid
3 結 論
3.1 適量的玉米酸漿能夠有效促進玉米蛋白的溶解,有利于玉米淀粉提取,但在此工藝中玉米淀粉的提取率也取決于環境條件對副干酪乳桿菌絮凝活性的影響。
3.2 響應面優化設計表明,各因素影響程度從大到小依次為浸泡pH值、浸泡時間和L-半胱氨酸用量。浸泡時間與浸泡pH值是極顯著水平,同時影響副干酪乳桿菌活力和L-半胱氨酸作用效果。最佳提取條件為浸泡浸泡時間48 h、L-半胱氨酸質量濃度1.5 g/100 mL、浸泡pH 7、自然發酵酸漿用量比(m(玉米粒質量)∶V(酸漿體積))1∶4、浸泡溫度30℃,淀粉提取率的最大值為93.21%。
3.3 結果表明,采用發酵酸漿與L-半胱氨酸協同作用浸泡玉米碎粒生產玉米淀粉,能夠在較低的浸泡溫度條件下得到了較為理想的淀粉提取率。其各組分收率與SO2濕磨工藝相近。
由于L-半胱氨酸分子較大,滲透效果差于SO2浸泡法。L-半胱氨酸無法還原包埋于胚乳深處及蛋白質結構內部的二硫鍵,因此需要進一步破碎玉米粒使其與L-半胱氨酸充分接觸。若在生產工藝中采用逆流循環浸泡的方式會進一步降低L-半胱氨酸用量,減少浸泡時間,提高玉米淀粉提取率,降低成本。
與SO2浸泡方法相比,此法浸泡溫度低,能耗低、無污染。但L-半胱氨酸生產成本高于SO2,可以考慮在以后的研究中采用發酵法生產的L-半胱氨酸發酵液來代替食品級L-半胱氨酸純品。也可通過與其他試劑結合使用同時破壞二硫鍵來降低生產成本。
[1]DU L, LI B, LOPES-FILHO J F, et al.Effect of delected organic and inorganic acids on corn wet milling yields[J].Cereal Chemistry, 1996,73(1): 96-98.
[2]陳璥.玉米淀粉工業手冊[M].北京: 中國輕工業出版社, 2009: 62-100.
[3]高嘉安.淀粉與淀粉制品工藝學[M].北京: 中國農業出版社, 2001: 56.
[4]劉亞偉.玉米淀粉生產及轉化技術[M].北京: 化學工業出版社,2003: 32-37.
[5]曹龍奎, 李鳳林.淀粉制品生產工藝學[M].北京: 中國輕工業出版社, 2008: 37.
[6]趙壽經, 黃麗.利用發酵法和酶法綜合技術改進玉米淀粉生產濕法浸泡工藝[J].吉林大學學報: 工學版, 2008, 38(6): 1489-1494.
[7]李鎖霞.玉米淀粉生產兩步浸泡工藝的研究[D].長春: 吉林農業大學, 2011: 8-27.
[8]張丹.基于提高玉米浸泡效果高產蛋白酶菌株的選育[D].長春: 吉林農業大學, 2011: 22-41.
[9]任海松.玉米淀粉的酶法濕磨工藝及其理化性質研究[D].泰安: 山東農業大學, 2007: 22-46.
[10]STEINKE J D, JOHNSON L A.Steeping maize in the presence of multiple enzymes.Ⅰ.Static batchwise steeping[J].Cereal Chemistry,1991, 68(1): 7-12.
[11]LING D, JACKSON D S.Corn wet milling with a commercial enzyme preparation[J].Cereal Chemistry, 1991, 68(2): 205-206.
[12]SINGH V, JOHNSTON D B.Pasting properties and surface characteristics of starch obtained from an enzymatic corn wet-milling process[J].Cereal Chemistry, 2002, 79(4): 523-527.
[13]陳敏元.L-半胱氨酸及其應用的進展[J].化工進展, 1992(2): 26-30.
[14]WERE L, HETTIARACHCHY N S, COLEMAN M.Properties of cysteine-added soy protein-wheat gluten films[J].Journal of Food Science, 1999, 64(3): 514-518.
[15]LAMBERT I A, KOKINI J L.Effect ofL-cysteine on the rheological properties of wheat flour[J].Cereal Chemistry, 2001, 78(3): 226-230.
[16]劉玉婷, 吳宏偉, 尹大偉, 等.半胱氨酸在食品中的應用研究[J].中國調味品, 2009, 34(12): 33-36.
[17]楊愛麗, 張莉力, 尤佳.甘薯淀粉傳統工藝優化[J].中國釀造, 2009,28(9): 83-85.
[18]張莉力, 許云賀, 李新華.甘薯酸漿中微生物絮凝性研究[J].食品工業科技, 2010, 31(6): 172-175.
[19]張莉力, 許云賀, 李新華.自然發酵甘薯酸漿中乳酸菌的篩選與鑒定[J].安徽農業科學, 2009, 37(1): 9-10.
[20]王曉暈.酸漿中乳酸菌的分離鑒定及其在大米淀粉提取中的應用[D].雅安: 四川農業大學, 2010: 21-55.
[21]劉杰.酸漿法生產綠豆淀粉工藝及性質的研究[D].北京: 中國農業大學, 2005: 18-40.
[22]張莉力, 許云賀, 李新華.對甘薯淀粉具有絮凝活性的乳酸菌的分離鑒定及其特性研究[J].食品科學, 2010, 31(7): 228-231.
[23]張莉力.甘薯酸漿絮凝淀粉機理研究及發酵工藝優化[D].沈陽: 沈陽農業大學, 2010: 25-34.
[24]張莉力, 許云賀, 李新華.副干酪乳桿菌副干酪亞種L1的培養條件及絮凝活性研究[J].食品工業科技, 2011, 32(3): 139-141.
[25]李瑞.面團延伸性改良劑的研究[D].無錫: 江南大學, 2011: 12-36.
[26]ANGIOLONI A, ROSA M D.Effects of cysteine and mixing conditions on white/whole dough rheological properties[J].Journal of Food Engineering, 2007, 80(1): 18-23.
[27]ELKHALIFA A E O, El-TINAY A H.Effect of cysteine on bakery products from wheat-sorghum blends[J].Food Chemistry, 2002, 77(2):133-137.
[28]MAJZOOBI M, FARAHNAKY A, JAMALIAN J, et al.Effects ofL-cysteine on some characteristics of wheat starch[J].Food Chemistry,2011, 124(3): 795-800.
[29]MONTGOMERY D C.實驗設計與分析[M].6版.北京: 人民郵電出版社, 2007: 405-462.

