開啟顯微成像的“納米時代”
文- 孫育杰
今年諾貝爾化學獎三位獲獎人,打破了光學成像中長期存在的衍射極限,將熒光顯微成像的分辨率帶入“納米時代”,為生命科學研究帶來巨大變化
10月8日,2014 年諾貝爾化學獎授予了美國科學家埃里克·白茲格(Eric Betzig)、威廉姆·莫納(William Moerner)和德國科學家施泰方·海爾(Stefan Hell),以表彰他們在超高分辨率熒光顯微技術領域的貢獻。正如官方頒獎文中描述,這類技術從方法實現到在科學研究中大展身手雖然不過十幾年時間,但已對多個領域產生顯著推動,并且可以預言在未來將給生命科學研究帶來巨大的變化。
諾貝爾化學獎評選委員會在當天的聲明中說,長期以來,光學顯微鏡的分辨率被認為不會超過光波波長的一半,這被稱為“阿貝分辨率”。借助熒光分子的幫助,今年獲獎者們的研究成果巧妙地繞過了經典光學的這一“束縛”,他們開創性的成就使光學顯微鏡能夠窺探納米世界。如今,納米級分辨率的顯微鏡在世界范圍內廣泛運用,人類每天都能從其帶來的新知識中獲益。
諾貝爾化學獎評選委員會還指出,得獎者的研究允許人類觀察病毒以至細胞內的蛋白質,對了解有關物質的功能作出重大貢獻,例如可用于觀察帕金森癥、腦退化癥和亨廷頓病患者體內的蛋白變化等。

埃里克·貝齊格

斯特凡·黑爾

威廉·莫納
打破衍射極限
我們人眼一般最小能看見大約0.1毫米的東西,而生物的基本單元——細胞的直徑平均約為20微米或0.02毫米,所以對生物微觀世界的觀察需要使用光學顯微鏡。光學顯微技術有很多優點,不但能放大微觀世界,同時還對樣品沒有損害,并且可以特異地觀察目標對象。這種特異性一般是通過熒光顯微技術實現的。熒光是物質吸收光照后發出的光,一般發射光波長比吸收光波長更長,因此可以單獨檢測熒光,對目標實現高靈敏度的檢測。
然而,光學顯微鏡的分辨率是有限的。由于光的衍射,即使一個無限小的光點在通過透鏡成像時也會形成一個彌散圖案,俗稱“艾里斑”。這樣即便兩個物點相距較遠,其彌散斑卻可能很近,以致無法區分。
基于此原理,早在1873年,德國科學家恩斯特阿貝(ErnstAbbe)提出阿貝光學衍射極限,并作為重要成就刻于其墓碑上。根據這一極限,光學顯微鏡的分辨率約為檢測光波長的一半,300納米左右(可見光的波長為400~700納米),或是我們頭發直徑的1/300。超高分辨率熒光顯微技術通過一系列物理原理和化學機制“打破”了這一衍射極限,把光學顯微鏡的分辨率提高了幾十倍,使我們以前所未有的視角觀察生物微觀世界。
探測微觀世界
發展超高分辨率熒光顯微技術,對生物學研究意義非常重大。
目前的超高分辨率熒光顯微技術大體分為三類:受激發射損耗、結構光照明技術和單分子技術。其歷史可以追溯到上個世紀80年代。這次獲得諾貝爾化學獎的三位科學家是這個方向的先驅人物。
1994年,此次獲獎的德國科學家施泰方·海爾當時還是博士后,他最先提出用受激發射損耗的方法(簡稱STED)打破光學衍射極限,并最終在2000年的實驗中得以實現。
STED方法利用了類似于產生激光的受激輻射原理,將一束形似于面包圈的激光光斑套在用于激發熒光的激光光斑外,這個面包圈激光可以抑制其區域內熒光分子發出熒光,這樣通過不斷縮小面包圈的孔徑就可以獲得一個小于衍射極限的熒光發光點,并通過掃描實現超高分辨率的圖像,將光學顯微鏡分辨率提高了近10倍。
施泰方·海爾現為德國哥根廷大學教授和德國馬克斯·普朗克生物物理化學研究所所長。從2000年開始,他不斷改進STED技術,使其更加適用于生物研究。另外,他還通過相似原理發明了一系列的超高分辨率技術,統稱為可逆飽和熒光躍遷(RESOLFT),為超分辨率熒光顯微成像技術的發展做出了巨大貢獻。
基于結構照明原理的超高分辨率技術是美國科學家麥茨·古塔弗森(MatsGustafsson)在2000年發明的,非常適于細胞研究,可惜分辨率只提高了一倍。這個技術基于兩個高空間頻率的圖案重疊可以形成低頻率莫爾條紋的原理,通過解析莫爾條紋實現超高分辨率成像。可惜古塔弗森于2011年51歲時因癌癥去世,英年早逝,無緣分享這次的諾貝爾獎。
超分辨熒光顯微鏡技術真正成熟并得以在生物研究中廣泛應用,是2006年同時出現的兩種基于隨機重構原理的超高分辨率光學成像技術。當時是由哈佛大學莊小威教授(隨機光學重構顯微術STORM技術)、埃里克·貝齊格(光活化定位顯微術PALM技術)及薩繆爾·海斯(SamuelHess,熒光活化定位顯微術fPALM技術)三個研究組分別同時獨立發明的。它們的原理非常像,都是基于熒光分子的光轉化能力和單分子定位,通過用光控制每次僅有少量隨機離散的單個熒光分子發光,并準確定位單個熒光分子艾里光斑的中心,把多張圖片疊加形成一幅超高分辨率圖像。
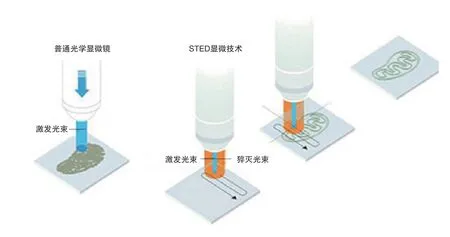
STED顯微技術的原理
這種“以時間換空間”的思路非常巧妙,把熒光成像的分辨率一下子提高了20倍左右。
這次獲獎的威廉·莫納現為美國斯坦福大學講座教授,是單分子熒光技術的先驅人物。1989年,他任職于美國IBM研究中心時在世界上首次實現了單個分子的光吸收的測量。1997年,他與因為綠色熒光蛋白獲得2008年諾貝爾化學獎的錢永健合作發現了綠色熒光蛋白的光轉化效應。
而埃里克·白茲格是美國霍華德·休斯醫學研究所的教授,是熒光顯微技術領域的領軍人物。他最早在1992年就實現了近場超高分辨率熒光成像,其后在1994年提出了基于單分子信號實現超高分辨率成像的思想,并于2006年在實驗中得以實現。
值得指出的是莊小威教授作為STORM超分辨技術的發明人,其研究團隊一直領導并推進著超高分辨率顯微技術的發展和應用,是近8年來這個領域最活躍的研究團隊。
超高分辨率成像作為一類很新的技術,突破了光學成像中的衍射極限,把傳統成像分辨率提高了10~20倍,好比一個近視眼的人突然戴上了合適的眼鏡,這一技術因此成為研究細胞結構的利器。
過去七八年間,超高分辨率成像技術不斷推進,先后實現了多色、三維和活細胞高速成像。其生物應用也很廣泛,包括細胞膜蛋白分布、細胞骨架、線粒體、染色質和神經元突觸等。超高分辨率技術一經出現就引起廣泛關注,先是在2006年被世界著名《科學》期刊評為年度十大技術突破,接著被生物醫學方法學最好的期刊《自然-方法》評為2008年度方法。在近期《自然-方法》十周年特刊評出的10年10大技術中,超高分辨率成像和單分子技術也都位列榜中。
跨界諾貝爾獎
就像利用哈勃天文望遠鏡認識宇宙,人類對微觀世界的了解極大地依賴于光學顯微技術。今年諾貝爾化學獎三位獲獎人打破了光學成像中長期存在的衍射極限,將熒光顯微成像的分辨率帶入到“納米時代”,讓我們能更精確地窺探微觀世界,這將為疾病研究和藥物研發帶來革命性的變化,也將為世界上方興未艾的腦計劃提供關鍵支持。
有趣的是,這次的三位諾貝爾化學獎得主都是物理學博士,而這次獲獎的成果也是典型的跨界研究,結合物理思想、光學技術和化學探針,為生物學研究提供了前所未有的強大工具,是一個典型的技術諾貝爾獎。
事實上,生命科學和醫學領域大量的懸疑正持續吸引具有不同背景的專業人才加入到研究隊伍中來,這種交叉融合的方式將會大大促進生物醫學研究的進步。毋庸置疑,未來我們還將看到更多像這樣的跨界諾貝爾獎!
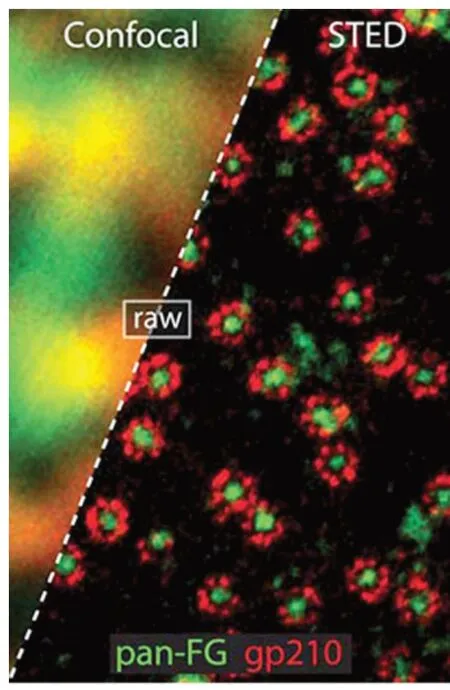
常規的共聚焦顯微鏡(左)與STED顯微鏡(右)效果對比圖

