羥基喜樹堿聯合甲氧胺對SHG44膠質瘤細胞增殖作用的影響
胡玨 王鴻 呂慶華 鄭英 朱永堅 鄭鳴之
·論著·
羥基喜樹堿聯合甲氧胺對SHG44膠質瘤細胞增殖作用的影響
胡玨 王鴻 呂慶華 鄭英 朱永堅 鄭鳴之★
目的觀察羥基喜樹堿(hydroxycamptothecin, HCPT)單獨及與甲氧胺(methoxyamine,MX)聯合用藥在抑制神經膠質瘤(SHG44)膠質瘤細胞增殖過程中是否具有協同作用,以期減少HCPT用量,降低毒副反應,為HCPT聯合MX應用于抗膠質瘤治療提供理論支持。方法聯合運用HCPT與堿基切除修復抑制劑MX,用MTT法、流式細胞等方法檢測聯合用藥的體外抑瘤效果及可能的機制。結果HCPT聯合甲氧胺能顯著抑制SHG44膠質瘤細胞增殖,隨著濃度增加和作用時間延長,其增殖抑制效應也隨之增強。流式細胞檢測結果表明,HCPT聯合MX組凋亡細胞比例明顯增多,但與單獨HCPT用藥組比較未見明顯差異。結論HCPT聯合MX對SHG44膠質瘤細胞具有顯著增殖抑制作用,且具有明顯劑量-時間依賴性。
羥基喜樹堿 甲氧胺 協同作用 MTT
神經膠質瘤(SHG44)是最常見的顱內惡性腫瘤,手術不易全切,且化療效果差。提高化療效果的重要途徑之一是尋找高效低毒的化療增敏劑[1~3]。羥基喜樹堿(hydroxycamptothecin, HCPT)是從珙桐科植物喜樹中提取分離的生物堿,通過抑制DNA拓撲異構酶I(TopoI)來達到治療惡性腫瘤的目的[4]。多位學者發現羥基喜樹堿可誘導腫瘤細胞凋亡,但體內試驗和臨床效應不明顯。甲氧胺(methoxyamine, MX)是堿基切除修復的小分子抑制劑。有報道甲氧胺可增強烷化劑和放療的抗腫瘤效果[5]。作者自2009年10月至2012年10月以(SHG44)為模型,探討羥基喜樹堿聯合甲氧胺對膠質瘤細胞增殖作用的影響及其可能的作用機制。
1 材料與儀器
1.1 材料與試劑 羥基喜樹堿注射液(貴州漢方制藥有限公司提供);甲氧胺(Sigma公司,美國);人腦膠質瘤細胞系SHG44購自上海細胞生物研究所;DEME高糖培養液(青霉素100U/ml、鏈霉素100μg/ml,GIBCO公司產品);細胞周期測定試劑盒、流式細胞儀(Bection Dikinson公司產品);CO2培養箱(Forma公司產品);Multiskan MK3酶標儀(Thermo Labsystems公司產品)。新生牛血清(杭州四季青生物工程材料有限公司產品);二甲基亞砜(DMSO,上海生物工程有限公司產品);噻唑藍(MTT)。
1.2 儀器 細胞培養超凈工作臺;倒置顯微鏡;37℃、5%CO2恒溫細胞培養箱;酶標儀;流式細胞儀。
2 方法
2.1 細胞培養 SHG44細胞株,在含有10 %胎牛血清、100U/ml青霉素和100μg/ml鏈霉素的DMEM高糖培養基內,于37℃,5%CO2細胞培養箱中孵育,常規傳代培養。
2.2 分組與藥物作用 經預實驗后,分組:(1)羥基喜樹堿(HCPT):6.25、25、50、100μg/ml。(2)甲氧胺(MX):10、30、60、120mM。(3) 聯合用藥組(HCPT +MX):合用比例1:1。制成細胞懸液,1×104/孔個細胞接種于96孔培養板中,每孔體積100μl。在37℃、5%CO2及飽和濕度條件下培養1d。加入不同濃度藥物的培養基,對照組只加細胞培養液不加藥。每個劑量組均設3個平行孔,再入培養箱中于相同條件下孵育。
2.3 MTT比色分析 分別培養24h、48h、72h后,棄去培養液,加入含10%MTT(5mg/ml)的無血清液DMEM培養液,繼續培養3h后吸去上清液,加入150 μl DMSO,震蕩10 min,使所形成的MTT結晶物溶解。用酶聯免疫檢測儀于570 nm處測定每孔吸光度(A)值,計算生長抑制率。用直線回歸方程計算藥物對膠質瘤細胞的IC50值(腫瘤細胞生長抑制率達50 %時化療藥物濃度)。細胞增殖抑制率(%)=[1-(OD實驗組-OD空白組)/(OD對照組-OD空白組)]×100%
2.4 流式細胞儀檢測細胞周期 消化細胞制成懸液(2×105/ml),每孔加2ml培養于6孔板,24h后加入各處理因素,按設計條件繼續培養。收集上清液,0.25%胰酶消化貼壁細胞,與上清液一起收集,水平離心機1000r/min離心8min,去上清液,用PBS洗1遍。70%乙醇固定,4℃過夜,離心去除乙醇,PBS清洗2次。加入100μLRNA酶(lmg/ml)37℃水浴30min,置冰上2min終止RNA酶消化。加入PI染液(150μl/ml)1m1,室溫避光30min。流式細胞儀檢測,每次計數1萬個細胞。以PI熒光讀數為橫坐標,細胞數為縱坐標,在流式細胞儀上計數細胞周期各期的細胞數目,以上實驗重復4次。
2.5 統計學分析 全部實驗結果均來自至少3組平行實驗,計量數據用(x±s)表示,組間差異性比較采用SPSS10.0軟件進行分析,以One-Way ANOVA進行方差分析后,以Student-Newman-Keuls檢驗行組間比較,P<0.05為差異有統計學意義。
3 結果
3.1 羥基喜樹堿聯合甲氧胺對膠質瘤SHG44細胞株增殖的抑制作用 10mM的甲氧胺與不同濃度的羥基喜樹堿合用,作用72 h后,顯著增強羥基喜樹堿對SHG 44細胞的抑制作用,羥基喜樹堿單用時,IC50值為0.31mM,與10mM的甲氧胺合用時,IC50值為0.093mM,羥基喜樹堿單用是合用的3.33倍。甲氧胺濃度升高時,其增強羥基喜樹堿抑制作用更明顯,與30mM甲氧胺合用時,IC50值為0.076mM,羥基喜樹堿單用是合用的4.08倍。與60mM、120mM甲氧胺合用時,IC50值分別為0.056mM、0.0047mM。結果見表1。圖1。
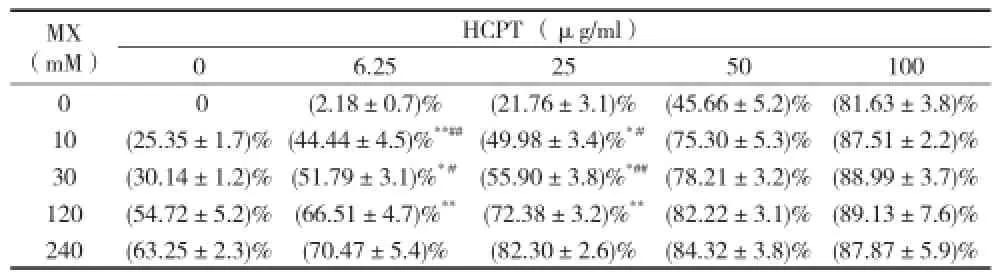
表1 羥基喜樹堿聯合甲氧胺對膠質瘤SHG44細胞株增殖的抑制作用[(x±s)n=6]
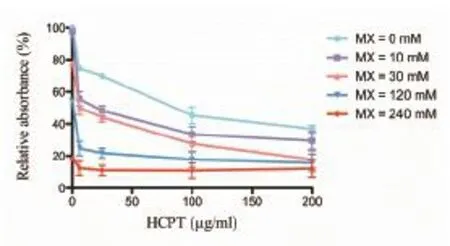
圖1 羥基喜樹堿聯合甲氧胺對膠質瘤SHG44細胞株增殖的抑制作用
3.2 羥基喜樹堿聯合甲氧胺對膠質瘤SHG44細胞凋亡的影響 羥基喜樹堿聯合甲氧胺組和單獨羥基喜樹堿組細胞于藥物作用48h和72h時出現了明顯的凋亡,而且其凋亡率明顯高于空白對照組,流式細胞儀檢測DNA倍體含量較空白對照組出現明顯的亞二倍體凋亡峰,即Ap峰(Fig2)。羥基喜樹堿聯合甲氧胺組細胞在作用48h和72h時的凋亡率稍高于單獨羥基喜樹堿組,但差異無統計學意義,圖2,見表2。
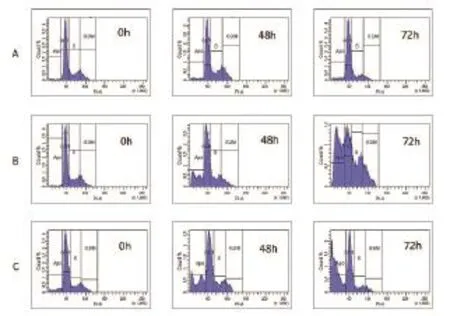
圖2 SHG44膠質瘤細胞凋亡的流式細胞儀檢測注:A組為空白對照組;B組為單獨羥基喜樹堿組;C組為羥基喜樹堿聯合甲氧胺組;羥基喜樹堿聯合甲氧胺組和單獨羥基喜樹堿組細胞于藥物作用48h和72h時DNA倍體含量較空白對照組出現明顯的亞二倍體凋亡峰。

表2 三組SHG44膠質瘤細胞凋亡率的比較[(x±s)%]
4 討論
與細胞死亡相關的DNA損傷程度因不同藥物而異,對DNA損傷的監測可通過藥物作用后細胞存活的情況來反映。由于抑制DNA堿基切除修復有可能協同增強化療藥的抗瘤活性[6],在實驗中,作者利用MTT試驗,觀察BER抑制劑甲氧胺聯合羥基喜樹堿對膠質瘤細胞增殖作用的影響。結果發現,甲氧胺與不同濃度羥基喜樹堿合用,作用72h后,能顯著增強羥基喜樹堿對膠質瘤細胞株的抑制作用,且作用時間越長,濃度越大,其抑制作用越強,具有時間-劑量依賴性。而流式細胞實驗的結果顯示,羥基喜樹堿單用或與甲氧胺聯用,細胞凋亡比例上升,表明甲氧胺能增強羥基喜樹堿對膠質瘤SHG44細胞造成的DNA損傷,誘導細胞凋亡,可能是其能增強羥基喜樹堿抗腫瘤活性的機制之一。
DNA拓撲異構酶I(topoisomerase I,Topo I)是生物體內廣泛存在的必需酶,參與DNA復制、轉錄、重組和修復等所有關鍵的核過程,是細胞生存的必需酶[7]。多種腫瘤細胞Topo I的含量遠高于正常細胞,是選擇性抗腫瘤藥物的理想作用靶點。喜樹堿(camptothecin,CPT)來源于我國特有的珙桐科植物喜樹(camptotheca acuminate)。1985年,Hsiang等揭示了喜樹堿抑制拓撲異構酶I(TopoI)新的作用機制[8],逐漸成為世界性研究熱點。喜樹堿類藥物導致細胞凋亡的直接原因是由于其S期細胞毒性,使細胞終止在G2期[9]。處于S期細胞DNA大量復制,與拓撲異構酶I抑制劑遭遇形成DNA復合體機會增多,從而使DNA斷裂點增多導致對喜樹堿類藥物誘導的凋亡最為敏感,約比G1或G2期細胞敏感1000倍[10]。但是Topo I抑制劑單獨用藥療效欠佳,且易產生耐藥。由于Topo I抑制劑耐藥細胞株多不對其他化療藥產生交叉耐藥,故通過不同機制的化療藥物配伍,如與Topo II抑制劑、TAX、鉑類、烷基抗癌藥等聯合應用可提高療效并避免或減少耐藥的產生[11]。
堿基切除修復(base excision repair,BER)途徑可以消除和替換烷化劑及內源性自由基等活性化學物質引起的局限性核苷酸殘基損傷。至少有25種不同的基因參與這一途徑。堿基切除修復可能是增強化療藥抗腫瘤效果的潛在治療靶點[12]。甲氧胺是一種堿基切除修復的小分子抑制劑[13]。Yan L[14]等的研究顯示體外和人腫瘤異種移植模型中甲氧胺均能增強替莫唑胺的細胞毒作用。Liu L[15]等為改進患卵巢癌患者治療方法,通過BER抑制劑甲氧胺和N-methypurine DNA glycosylase(MPG)的過度表達操縱DNA堿基切除修復途徑,結果顯示替莫唑胺和甲氧胺聯合應用對沒有較佳化療方法的患者是不錯的選擇。迄今為止,尚無以DNA修復路徑為靶點的藥物進入臨床。因此,BER抑制劑甲氧胺與化療藥物聯用,可降低化療藥劑量,減少化療藥的毒副作用,同時克服其非特異性細胞毒作用,是極有前途的治療方案。本研究的結果證實:(1)甲氧胺對羥基喜樹堿治療膠質瘤具有協同作用。(2)羥基喜樹堿與甲氧胺協同作用具有時間、劑量依賴效應。(3)初步證明兩者協同效應通過誘導腫瘤細胞凋亡實現。后續實驗將集中在進一步闡明作用的分子機制。
1 Neyns B, Sadones J, Joosens E, et al. Stratified phase II trial of cetuximab in patients with recurrent high-grade glioma.Ann Oncol, 2009, 20(9): 1596~1603.
2 Lv S, Teugels E, Sadones J, et al. Correlation between IDH1 gene mutation status and survival of patients treated for recurrent glioma. Anticancer Res,2011,31(12):4457~4463.
3 Y.J.Zhu,J.Hu, and D.H. Xu, et al. Effect of nano-liposome sustained elemene in inducing cell apoptosis of C6 glioma. Zhongguo Zhong Xi Yi Jie He Za Zhi. 2008, 28(7): 637~639.
4 宋金春,黃嶺,陳佳麗. 肺靶向羥基喜樹堿脂質體的制備及體外釋藥性質研究.中國藥學雜志,2008,43(20):1564~1567.
5 Fishel ML, He Y, Smith ML, et al. ,Manipulation of base excision repair to sensitize ovarian cancer cells to alkylating agent temozolomide. Clin Cancer Res, 2007,13(1): 260~267.
6 Lee D, Kang SY, Suh YL, et,al.Clinicopathologic and genomic features of gliosarcomas.J eurooncol. 2012, 107(3):643~650.
7 Wang, J.C., DNA topoisomerases. Annu Rev Biochem, 1996. 65: 635~692.
8 Hsiang YH, Hertzberg R, Hecht S, et al.Camptothecin induces proteinlinked DNA breaks via mammalian DNA topoisomerase I. J Biol Chem, 1985, 260(27): 14873~14878.
9 Ozeki T, Kaneko D, Hashizawa K, et al.Combination therapy of surgical tumor resection with implantation of a hydrogel containing camptothecin-loaded poly(lactic-co-glycolic acid) microspheres in a C6 rat glioma model.Biol Pharm Bull. 2012,35(4):545~550.
10 Takimoto, C.H., J. Wright,S.G. et al. Clinical applications of the camptothecins. Biochim Biophys Acta, 1998,1400(1-3): 107~119.
11 Aisner J, Musanti R, Beers S, et al., Sequencing topotecan and etoposide plus cisplatin to overcome topoisomerase I and II resistance: a pharmacodynamically based Phase I trial. Clin Cancer Res, 2003,9(7): 2504~2509.
12 Wood RD, Mitchell M, Lindahl T. Human DNA repair genes. Mutat Res. 2005,577(1-2):275~283.
13 Taverna P, Liu L, Hwang HS, et al. Methoxyamine potentiates DNA single strand breaks and double strand breaks induced by temozolomide in colon cancer cells. Mutation Research 2009,485:269~281.
14 Yan L, Bulgar A, Miao Y, et al. Combined treatment with temozolomide and methoxyamine: blocking apurininc/pyrimidinic site repair coupled with targeting topoisomerase IIalpha. Clin Cancer Res. 2007, 13(5):1532~1539.
15 Liu L, Yan L, Donze JR. Gerson SLBlockage of abasic site repair enhances antitumor efficacy of 1,3-bis-(2-chloroethyl)-1-nitrosourea in colon tumor xenografts. Mol Cancer Ther. 2003,2(10):1061~1066.
ObjectiveTo improve the glioma suppression effect of hydroxycamptothecin (HCPT)and reduce its side-effects by changing its pharmaceutical delivery form. To clarify whether a synergetic effect exists between HCPT and methoxyamine (MX)on the inhibition of glioma cell proliferation and provide theoretical basis for the further usage of HCPT in the treatment of glioma.MethodsMTT and flow cytometry (FCM) were applied to determine the growth inhibition effect of using HCPT alone or in combination with MX on SHG4 cell line.ResultsDifferent concentrations of HCPT and MX were used alone or in combination and this combination usage showed a higer inhibition rate than using HCPT or MX alone. FCM results showed more cells were stopped at the G2 phase in the HCPT + MX group. However, the difference was not statistically signif cant between HCPT + MX group and HCPT group.ConclusionHCPT could inhibit the proliferation of SHG44 cell and the combination of MX could increase this inhibitory effect on SHG44, suggesting a synergistic effect between HCPT and MX.
Hydroxycamptothecin Methoxyamine Synergy MTT
浙江省自然基金項目(Y2091211);浙江省醫藥衛生科技項目(2009B004);浙江省中醫藥科技計劃項目(2009CA044,2007CA060)
310053 浙江醫學高等專科學校(胡玨 王鴻 鄭鳴之)
310000 浙江大學醫學院附屬第二醫院(呂慶華 朱永堅)
310013 杭州 中國人民解放軍第117醫院(鄭英)
*通訊作者

