氣體擴散耦合順序注射分光光度法測定葡萄酒中的二氧化硫
劉 晶 王美艷 范世華
(東北大學 理學院 分析科學研究中心,沈陽 110004)
0 前言
亞硫酸鹽通常指二氧化硫及能夠產生二氧化硫的無機性亞硫酸鹽,在食品加工中廣泛用作漂白劑、防腐劑和抗氧化劑;二氧化硫是葡萄酒釀造過程中不可缺少的添加劑,其主要功能是防腐殺菌、澄清、抗氧化和增酸、增色、改善果酒風味等[1],但過量使用亞硫酸鹽類食品添加劑會破壞食品的營養素。人類若食用過量的亞硫酸鹽會產生頭痛、惡心、暈眩、氣喘、蕁麻疹等過敏反應[2]。目前亞硫酸鹽的安全性問題已引起越來越多的關注。
SO32-定量測定方法有高效液相色譜法[3]、氣相色譜法[4]、離子色譜法[5]、熒光光譜分析法[6]、化學發光法[7]、分光光度分析法[8]等。在我國測定二氧化硫常用的方法是鹽酸副玫瑰苯胺-甲醛比色法。但鹽酸副玫瑰苯胺-甲醛比色法手工操作繁瑣、空白背景大、重現性差,所使用的試劑四氯汞鉀和甲醛等毒性較強,易對環境造成新的污染;同時該方法對鹽酸的加入量要求十分苛刻,因此在應用上受到一定限制。而順序注射法與分光光度分析法聯用技術在無機離子及有機物測定方面得到了很好的應用[9-10]。本文基于孔雀綠與二氧化硫的褪色反應,將順序注射進樣氣體擴散分離與光度分析法聯用,快速、準確地測定了葡萄酒中SO2的含量。
1 實驗部分
1.1 儀器與試劑
SIS-4100四道順序注射系統(北京吉天儀器公司):由注射泵、8位選擇閥和5 mL針筒組成,注射器和多位閥的操作由計算機控制;722光柵分光光度計(上海第三分析儀器廠);氣體擴散膜(自行加工);PCL-711B數據采集卡(Advantech CO.,臺灣)。
無水亞硫酸鈉(CP)、乙二胺四乙酸二鈉、磷酸二氫鉀、磷酸氫二鈉、鹽酸(36%~38%),購自沈陽市試劑廠;孔雀石綠(BS)購自國藥集團化學試劑有限公司;無水碳酸鈉和碳酸氫鈉購自上海虹光化工廠。上述試劑除另有說明,皆為分析純,水為二次去離子水。
EDTA鈉鹽溶液(0.001 mol/L)、磷酸鹽標準緩沖溶液(0.025 mol/L)、孔雀綠儲備溶液(4×10-3mol/L)、二氧化硫標準儲備溶液(1 000 mg/L)。
孔雀綠工作溶液:準確移取10 mL磷酸鹽標準緩沖溶液(0.125 mol/L)于50 mL容量瓶中,加入適量水稀釋后,再加入一定體積的孔雀綠標準儲備溶液,稀釋后定容至刻度,搖勻,配制成適當濃度的孔雀綠工作溶液。
1.2 實驗方法
按照圖1所示的實驗流路,SI系統通過八位選擇閥的一個閥位通道對整個流路用水進行沖洗后,將含有孔雀綠指示劑的溶液吸入儲存管并反向推至氣體擴散膜的接收液流通道;然后沖洗儲存管路后再依次將試樣、試劑順序地吸入儲存管,并反向將其推入給予液流通道進行化學反應,產生的氣態二氧化硫經PTFE膜擴散進入給予液流通道,最后將給予液流中的指示劑溶液推入流通池,在波長615 nm處實時記錄吸光度信號。測定試劑空白的吸光度A0和顯色反應后溶液的吸光度A,并計算吸光度差值A0-A。全部操作過程在計算機控制下按一定程序完成。
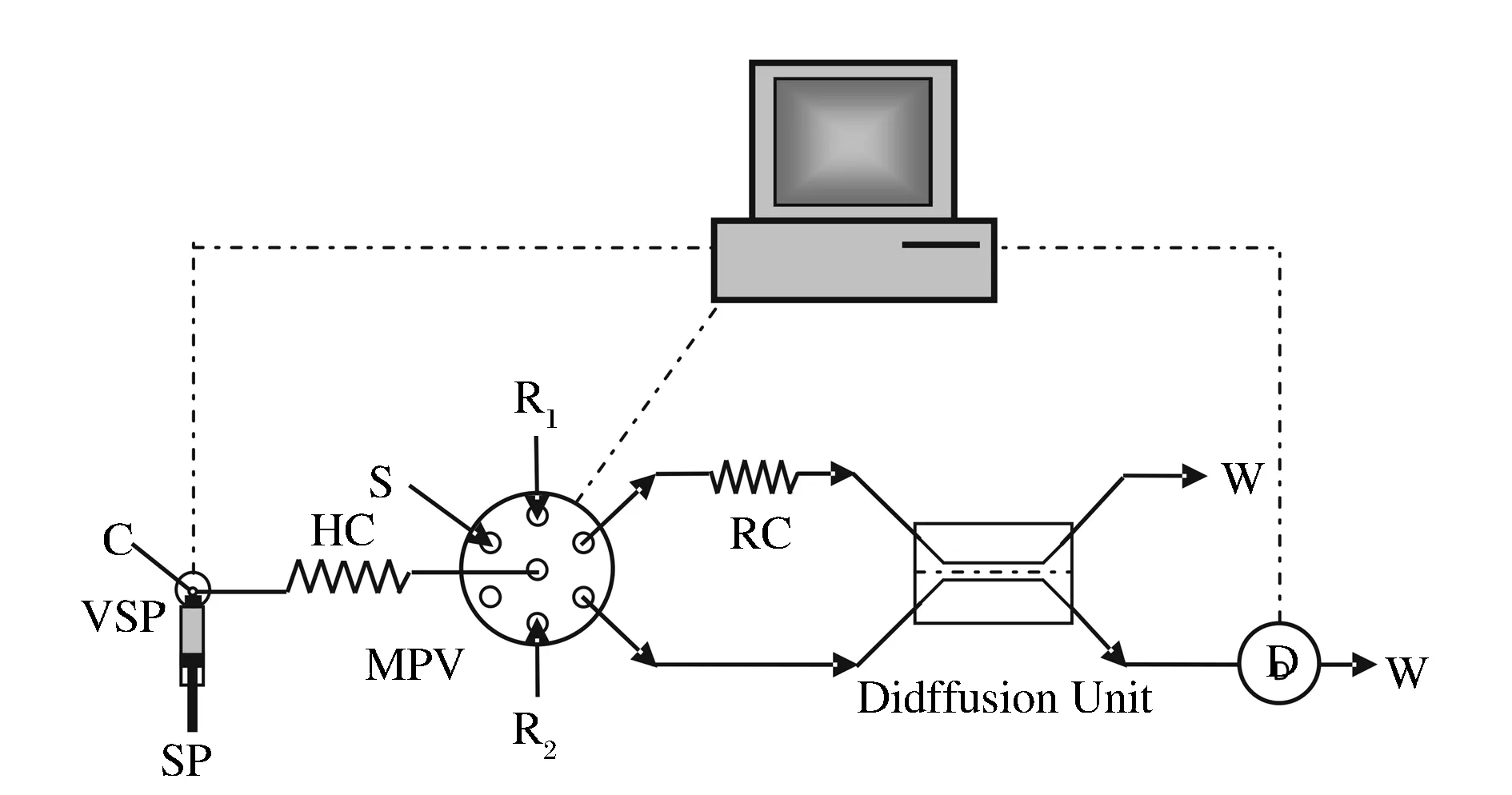
圖1 氣體擴散-順序注射分光光度法測定流路圖Figure 1 Schematic diagram of SIA system with gas diffusion for spectrophotometric determination.C—載流;VSP—兩位閥;SP—注射泵;MPV—八位選擇閥;D—檢測器;W—廢液;HC—儲存管(i.d. 0.8 mm,管長200 cm);RC—反應管(i.d. 0.8 mm,管長30 cm);R1—HCl溶液;R2—孔雀綠溶液;S—試樣溶液
2 結果與討論
2.1 吸收波長的選擇
反應產物的吸收光譜見圖2。在350~750 nm的范圍內,顯色產物在615 nm處的吸光度最大,實驗選定615 nm 為檢測波長。
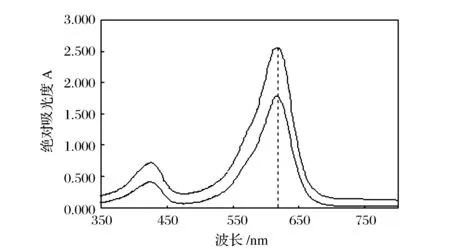
圖2 吸收光譜曲線Figure 2 Absorption spectra.
2.2 檢測流速的選擇
實驗采用氣體擴散分離裝置在順序注射進樣條件下將待測組分與基體分離,因此需要優化試樣與鹽酸混合反應后流經給予液流通道的速度即給予液流速V1和吸收了擴散SO2的孔雀綠指示劑溶液進入檢測器的速度即接收液流速V2。
給予液流速V1對吸光度差值的影響如圖3。給予液流通道是試樣與試劑反應生成SO2的通道,流速V1越小,試劑與試樣在管路中的留存時間及反應時間就越長,所生成的SO2越多,通過氣體擴散分離器后轉化為SO32-的量越大,與指示劑進行加成反應的程度也就越大,指示劑褪色也就越明顯。在實驗中兼顧靈敏度及取樣頻率,選擇其流速V1為1.2 mL/min。
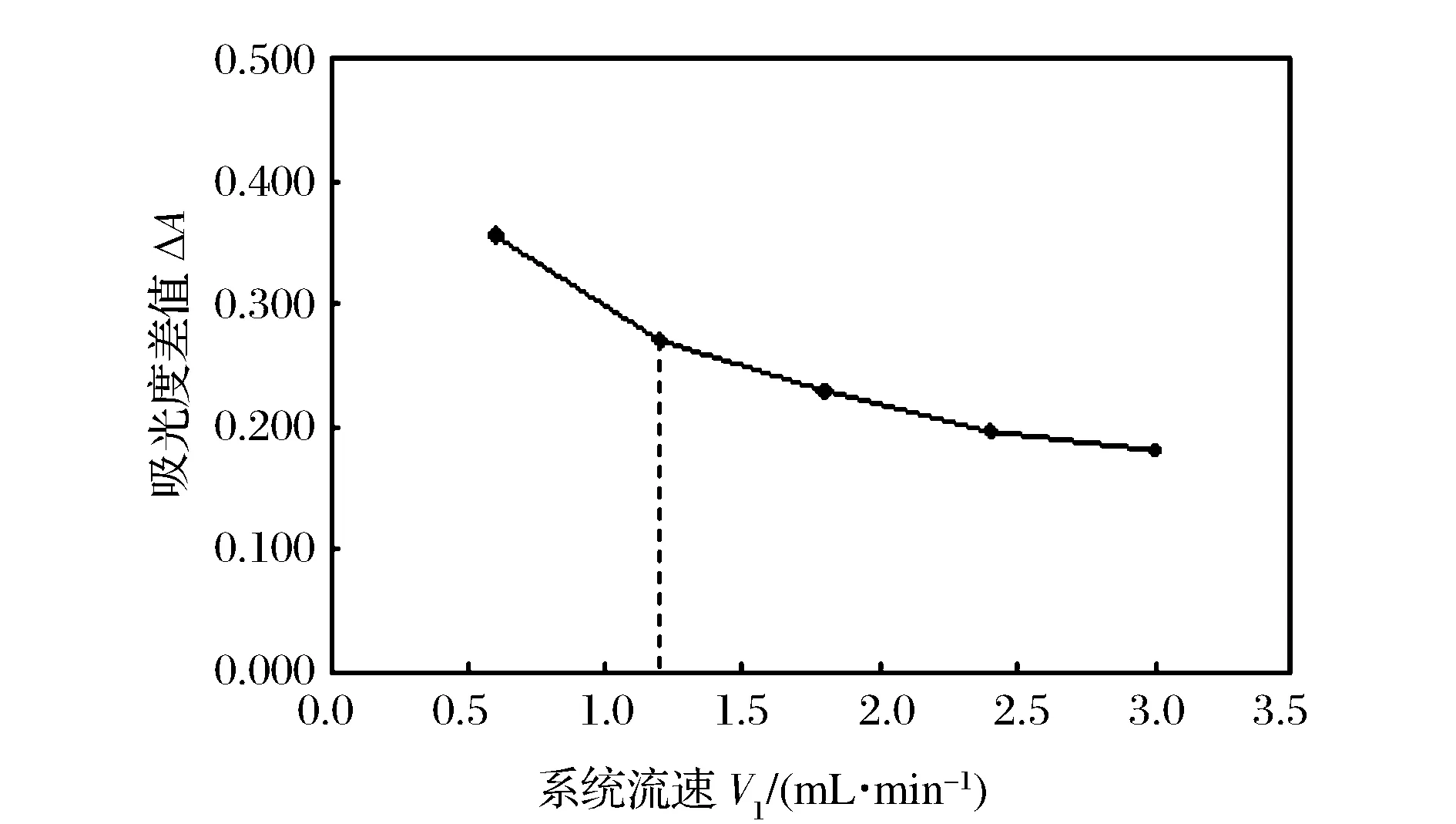
圖3 給予液流速V1對吸光度差值的影響 Figure 3 Effect of V1 flow rate on relative absorbance.
接收液流速V2對吸光度差值的影響如圖4。由圖可知,吸光度差值隨系統流速V2的增加而明顯降低。這是因為在實驗中,接收液流通道中的孔雀綠指示劑在弱堿性條件下,與經擴散進入通道的SO2轉化為SO32-后發生加成反應,使孔雀綠結構發生改變,從而導致其褪色。由于加成反應的反應速率較為緩慢,若流速V2過快,減少了反應時間,會使SO32-無法充分與指示劑發生加成反應,降低反應進行的程度,進而導致吸光度差值較小。流速V2為1.2 mL/min時,可以獲得相對高的靈敏度和較大的取樣頻率,因此實驗中選擇1.2 mL/min作為最佳的系統流速V2值。
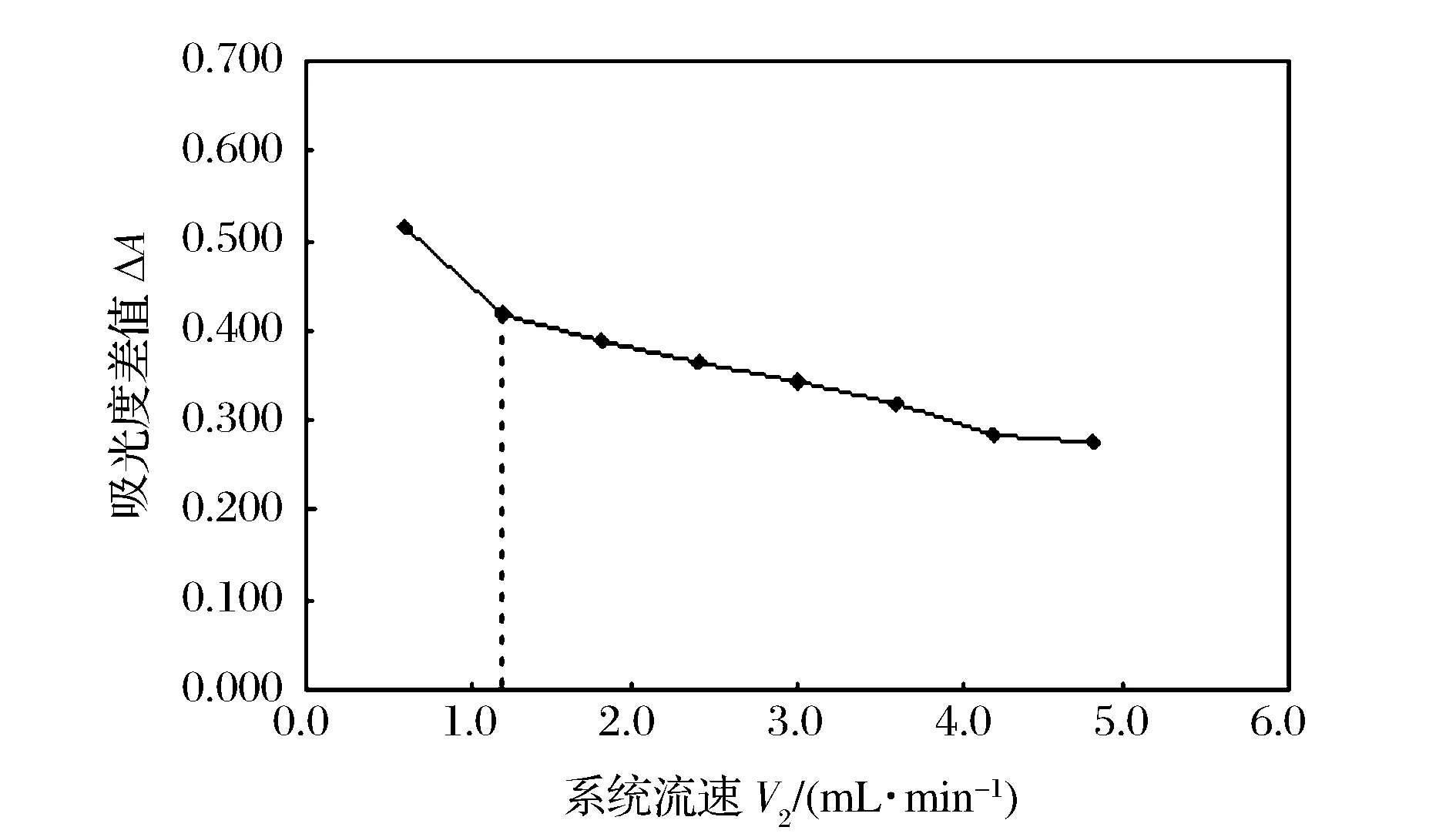
圖4 給予液流速V2對吸光度差值的影響 Figure 4 Effect of V2 flow rate on relative absorbance.
2.3 試樣體積的選擇
實驗觀察到,隨著試樣體積的增加,吸光度總值增加。這是因為隨著與鹽酸發生反應的試樣增多,產生的SO2也增多,因此吸光度差值迅速增大;試樣體積增大到200 μL以后趨于平緩,這是由于在管路中進行的化學反應發生在試樣與試劑相互滲透的界面上,當樣品體積增大到200 μL時,過多的試樣溶液在管路中無法與鹽酸進一步接觸滲透,所以產生的SO2量沒有明顯增多,因此吸光度差值增加較緩慢。兼顧靈敏度和分析速度,實驗選擇200 μL作為試樣的最佳進樣體積。
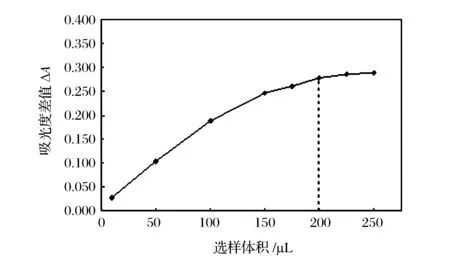
圖5 試樣體積對吸光度差值的影響Figure 5 Effect of sample volume on relative absorbance.
2.4 鹽酸溶液和孔雀綠溶液體積的選擇
實驗結果表明,吸光度差值隨鹽酸體積的增加而逐漸增加,但增加幅度不是很明顯。實驗確定選擇100 μL作為鹽酸的最佳體積,孔雀綠溶液的體積對吸光度差值的影響如圖6所示。孔雀綠溶液為本實驗的指示劑,其體積的增加,可以減少兩端載流對擴散膜處的指示劑區帶的稀釋,從而保證給予液流區帶中央部位(與位于擴散單元中給予液流相對應部位)能有較高濃度的孔雀綠與擴散過來的SO2發生反應,以增加靈敏度并獲得較好的重現性。當孔雀綠體積在100~200 μL范圍內變化時,吸光度差值隨孔雀綠體積的增加而逐漸增大;當體積達到200 μL并繼續增大時,吸光度差值基本不再變化,因此選擇200 μL作為孔雀綠溶液的最佳體積。
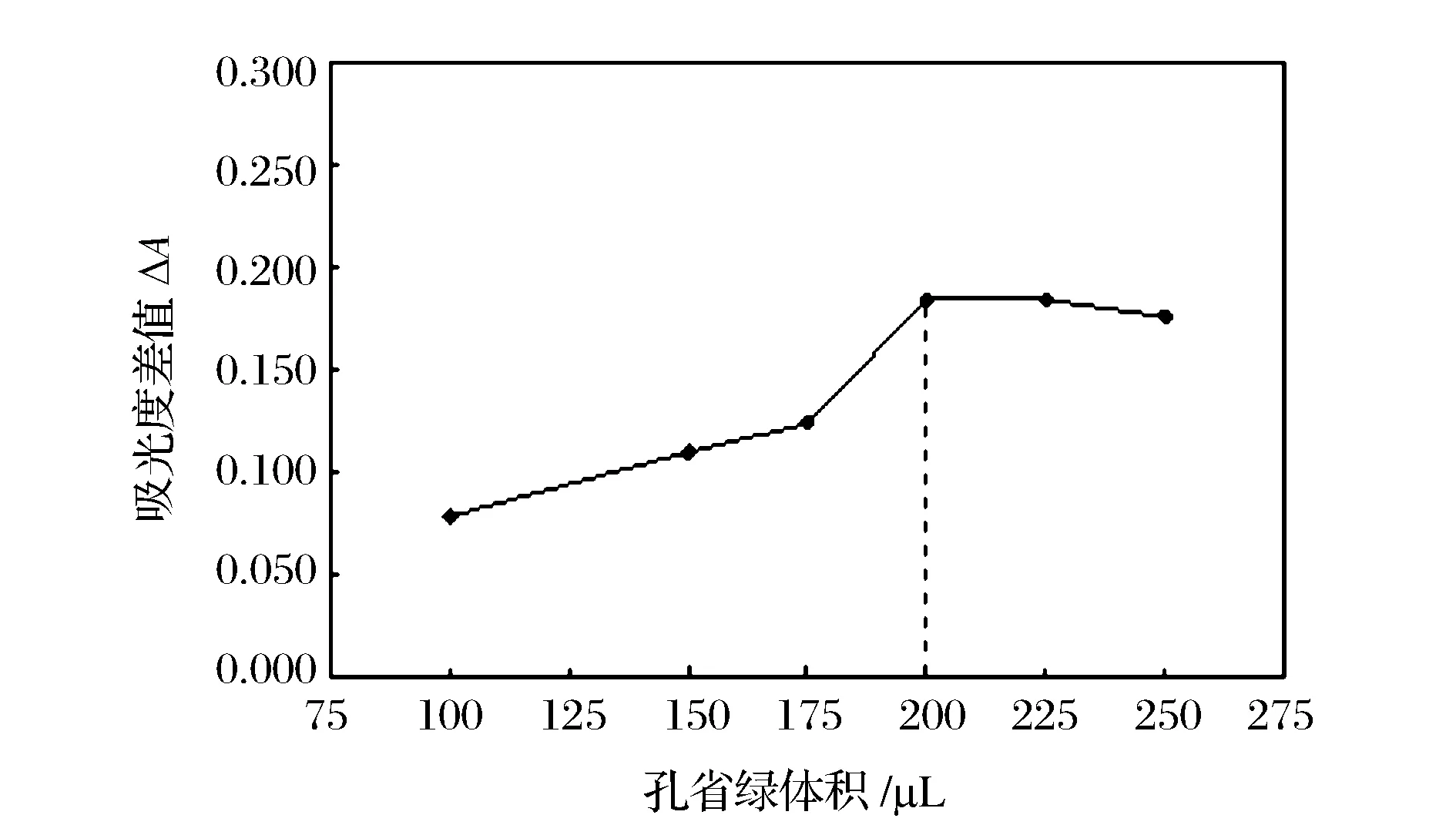
圖6 孔雀綠體積對吸光度差值的影響 Figure 6 Effect of MG volume on relative absorbance.
2.5 鹽酸濃度的選擇
實驗結果表明,系統中所使用的鹽酸濃度不同會直接影響吸光度差值的大小。隨著鹽酸濃度的增加,吸光度差值也隨之增加;當濃度達到0.5 mol/L時吸光度差值達到最大;繼續增加鹽酸濃度,吸光度差值則緩慢降低,如圖7所示。實驗選擇0.5 mol/L作為HCl的最佳工作濃度。

圖7 HCl濃度對吸光度差值的影響 Figure 7 Effect of HCl concentration on relative absorbance.
2.6 孔雀綠溶液濃度的選擇
試樣中產生的SO2透過氣體擴散膜進入到孔雀綠溶液中,在堿性條件下SO2轉化為SO32-后,與孔雀綠發生加成反應使其褪色,因此孔雀綠溶液的濃度直接影響空白溶液的吸光度值及加成反應的褪色程度。如圖8所示,吸光度差值隨孔雀綠濃度的增大而顯著增大,但濃度太高會導致吸光度超過儀器的線性響應范圍。為保證其空白吸光度控制在光度計的線性響應范圍內并獲得較高的靈敏度,選擇2.0×10-4mol/L作為孔雀綠的最佳濃度,此時空白信號的吸光度約為1.40。

圖8 孔雀綠濃度對吸光度差值的影響 Figure 8 Effect of MG concentration on relative absorbance.
2.7 共存組分的干擾
在氣體擴散分離過程中,氣體擴散膜將大部分的非揮發性基體組分隔離在給予液流通道的一側,消除了其對指示劑褪色反應的干擾,然而在基體組分中仍可能存在酸性條件下轉化為氣態的氣體組分(如二氧化碳等),同樣也可以透過擴散膜進入到接收液中,對測定產生干擾。本實驗對HCO3-,CO32-的干擾情況進行了考察。
在上述優化的最佳實驗條件下,以20 μg/mL的SO32-標準溶液作為測試溶液,在相對誤差±5%的允許范圍內,NaHCO3,Na2CO3的允許倍數分別為150和20倍。
2.8 方法的分析性能
在選定的實驗參數下,當接收液流速V2為1.2 mL/min時,在1.0~5.0 μg/mL的濃度范圍內,吸光度差值與二氧化硫濃度呈線性響應關系。線性回歸方程為:ΔA=0.031 4c+0.004 4(r=0.999 4,n=6),其中c為二氧化硫濃度,ΔA為吸光度差值。以空白溶液吸光度的3倍標準偏差與標準曲線斜率的比值作為方法的檢出限(3σ),計算得檢出限為0.33 μg/mL。
當接收液流速V2為4.2 mL/min時,在5.0~50.0 μg/mL的濃度范圍內,吸光度差值與二氧化硫濃度呈線性響應關系。線性回歸方程為:ΔA=0.007 7c+0.0327(r=0.997 8,n=7)。連續11次重復一定濃度的樣品溶液的相對標準偏差(RSD)在0.29%~0.43%,精密度良好。
為了驗證方法的準確性,對兩種葡萄酒樣品進行加標回收率考察。按實驗中的操作方法,在兩種葡萄酒的進樣量均為200 μL的條件下,分別測定其吸光度差值,由標準曲線計算出樣品中SO2的濃度。測定結果及加標回收率見表1。
表1實際樣品加標回收率
Table1Resultsofrecoverytest/(mg·L-1)

由表1可知,兩種葡萄酒樣品的加標回收率在98.7%~104.7%(n=3)。
3 結語
實驗首次提出單泵單閥式順序注射進樣體系與氣體擴散分離裝置聯用,基于在微堿性條件下,亞硫酸根離子可與孔雀綠溶液發生加成反應并使其褪色的原理,測定了葡萄酒中二氧化硫的含量。流路簡單,所使用的指示劑毒性小,不附著管路、易于沖洗,用于葡萄酒中二氧化硫的測定,取得比較滿意的結果。
[1] 尚云青,唐若瑩,俞捷,等.干紅葡萄酒中二氧化硫測定方法的比較研究[J].食品工程,2013(1):41-44.
[2] 方長云,段彬伍,孫成效,等.充氮蒸餾-鹽酸副玫瑰苯胺比色法測定蔬菜及其制品中的亞硫酸鹽[J].食品科學,2013,34(22):213-217.
[3] 彭曉俊,鄧愛華,龐晉山.高效液相色譜柱后衍生測定脫水蔬菜中的亞硫酸鹽[J].分析科學學報,2012,28(1):83-86.
[4] 孫艷平,李濤.頂空氣相色譜火焰光度檢測器檢測山藥中的二氧化硫[J].山西醫學雜志,2010,39(8):1024.
[5] 邵宏宏,周向陽,胡忠陽,等.離子色譜閥切換法測定硫磺熏蒸中藥材中的二氧化硫[J].中國無機分析化學,2012,2(增刊):57-58.
[6] 彭月,李雪蓮,銀玲,等.熒光衍生法測定中藥二氧化硫殘留量研究[J].中國中藥雜志,2013,38(2):212-216.
[7] 張紅兵,胡云霞,連靠奇,等.滲透汽化流動注射高錳酸鉀-羅丹明B化學發光法測定食品中的亞硫酸鹽[J].中國衛生檢驗雜志,2013,23(8):1846-1848,1851.
[8] 廖文生,劉中勇,趙群,等.鄰菲啰啉-Fe3+分光光度法測定食品中的亞硫酸鹽[J].檢驗檢疫學刊,2012,22(3):39-41.
[9] 王夕云.順序注射光度分析法測定環境水中總有機碳和鉬的研究[D].沈陽:東北大學,2008.
[10] 王夕云,陳志霞,范世華.順序注射催化光度分析法測定環境水樣中痕量鉬[J].中國無機分析化學,2011,1(3):27-31.

