強化阿托伐他汀對不穩定性心絞痛患者冠狀動脈介入治療術后CD4+T淋巴細胞微小核糖核酸-21表達的影響*
劉洋,李浪,蘇強,周游,王江友,孫羽涵,楊棟
強化阿托伐他汀對不穩定性心絞痛患者冠狀動脈介入治療術后CD4+T淋巴細胞微小核糖核酸-21表達的影響*
劉洋,李浪,蘇強,周游,王江友,孫羽涵,楊棟
目的:探討強化阿托伐他汀對不穩定性心絞痛患者經皮冠狀動脈介入治療(PCI)術后CD4+T淋巴細胞微小核糖核酸-21(microRNA-21,miRNA-21)表達的影響。
阿托伐他汀;微小核糖核酸-21;經皮冠狀動脈介入治療術;PDCD4; CD4+T淋巴細胞
(Chinese Circulation Journal, 2014,29: 26.)
經皮冠狀動脈介入治療(PCI)是目前治療冠心病先進而有效的手段之一,在迅速開通病變冠狀動脈恢復心肌血供的同時常常也可引起術后心肌損傷,是臨床常見而棘手的并發癥,是患者近遠期預后不良的獨立預測因子,臨床上缺乏有效的防治方法。因此,探索術后心肌損傷機制與防治的研究日益受到人們的重視。
既往研究發現,不穩定性心絞痛急性反應期可激活CD4+T淋巴細胞,并致使腫瘤壞死因子-α、白細胞介素-10等炎癥因子分泌異常,CD4+T淋巴細胞尤其Th1細胞,參與了不穩定動脈粥樣硬化斑塊的發生、發展過程[1]。PCI可誘發或促進不穩定斑塊破裂,導致外周血T淋巴細胞的顯著激活,誘導促炎因子腫瘤壞死因子-α分泌增加,促進心肌局部炎癥的發生發展[2]。
微小核糖核酸(MicroRNA,miRNA)是一類廣泛存在基因組非編碼區的小分子RNA。近年發現,miRNA調控CD4+T淋巴細胞活化、分化,參與免疫炎癥反應[3]。新近研究發現miRNA-21通過負調控其靶基因程序性細胞死亡因子4(PDCD4)從而限制過度激活的炎癥反應[4]。有研究表明,miRNA-21表達上調可減少促炎因子腫瘤壞死因子-α分泌,促進抑炎因子白細胞介素-10釋放,抑制CD4+T淋巴細胞亞型Th1細胞過度活化的炎癥反應[5,6]。因而miRNA-21在CD4+T淋巴細胞介導的免疫炎癥反應中具有重要作用。
Patti等[7]研究結果表明,PCI術前2天給予80 mg大劑量的阿托伐他汀,可以有效的降低炎癥指標C反應蛋白水平,明顯減輕術后心肌損傷,推測該效益可能歸因于阿托伐他汀抗炎作用。雖然目前他汀類藥物在防治PCI術后心肌損傷中的作用機制尚未完全闡明,但眾多研究已表明他汀具有抑制心肌炎癥反應作用,而術后心肌CD4+T淋巴細胞被激活,誘發心肌炎癥反應是明確的[8]。 因此我們的研究目的觀察強化阿托伐他汀對不穩定性心絞痛患者PCI圍術期CD4+T淋巴細胞miRNA-21表達的影響,為PCI術后心肌損傷的臨床防治提供理論依據。
1 資料與方法
實驗對象:選取2011-11至2012-05入住我院行擇期PCI的不穩定性心絞痛患者68例(男58例,女10例),年齡(63±10)歲,隨機分為強化他汀組(術前2天給予阿托伐他汀80 mg/d,術后改為阿托伐他汀40 mg/d,n=34)和常規他汀組(術前及術后均給予阿托伐他汀20 mg/d,n=34),兩組均為術前2天首次服用阿托伐他汀。不穩定性心絞痛患者均經冠狀動脈造影證實存在冠狀動脈狹窄,有行PCI指征,且術前心肌酶學標記物肌酸激酶同工酶(CK-MB)和肌鈣蛋白I陰性,無他汀應用禁忌證,初發心絞痛、勞累惡化性心絞痛和靜息性心絞痛等。排除標準:合并嚴重感染或腫瘤患者;嚴重肝腎功能不全者;他汀類藥物過敏者;腦卒中;左心室射血分數<30%;急診PCI。
試劑:人淋巴細胞分離液(中國),Dynabeads?FlowComp?人 CD4淋巴細胞試劑盒(挪威 ),RevertAid?FistStrand cDNA逆轉錄試劑盒(立陶宛),Fase Start Universal SYBR Green 實時熒光定量聚合酶鏈式反應試劑盒(美國),All-in-one?微小核糖核酸實時熒光定量逆轉錄-聚合酶鏈式反應(qRT-PCR)試劑盒(美國),miRNA-21引物(美國),PDCD4 mRNA、甘油醛磷酸脫氫酶mRNA引物(中國),兔抗人PDCD4單抗(美國),GAPDH單抗(中國),人腫瘤壞死因子-α 酶聯免疫法試劑盒(美國),人白細胞介素-10超敏酶聯免疫法試劑盒(中國)。
標本采集:強化他汀組和常規他汀組術前、術后16~24 h均抽血檢查肌酸激酶同工酶、肌鈣蛋白I、超敏C反應蛋白(由我院檢驗科檢測)及新鮮外周血,其中取1 ml新鮮外周血自然凝固20 min,2000 rpm離心10 min,收集血清用酶聯免疫法檢測腫瘤壞死因子-α和白細胞介素-10。余下用肝素抗凝后分離細胞。本試驗遵照廣西醫科大學醫學倫理委員會人體試驗管理規范執行。標本采集均獲患者知情同意并簽署同意書。
細胞提取:根據Ficoll-Paque密度梯度離心法提取兩組患者外周血單個核細胞(PBMC)細胞,嚴格按照Dynabeads?FlowComp?人 CD4淋巴細胞磁珠分選試劑盒說明書操作分選CD4+T淋巴細胞。分選出的細胞同樣做細胞計數,同時用0.4%臺盼藍染色觀察并計算出活細胞存活率,存活率>90%的CD4+T淋巴細胞留下備用。
實時熒光定量逆轉錄-聚合酶鏈式反應檢測miRNA-21、PDCD4 mRNA表達量:按照 Trizol操作說明提取CD4+T淋巴細胞的總RNA,根據RevertAid?FistStrand cDNA逆轉錄試劑盒說明書和All-in-one?miRNA實時熒光定量逆轉錄-聚合酶鏈式反應試劑盒說明書分別將PDCD4 mRNA及miRNA-21逆轉錄成cDNA。根據Fase Start Universal SYBR Green實時熒光定量聚合酶鏈式反應試劑盒說明書和All-in-one?miRNA實時熒光定量逆轉錄-聚合酶鏈式反應試劑盒說明書分別加入不同組分,總反應體系均為20 μl。miRNA-21及內參U6引物由GeneCopeia公司提供(引物ID分別為:hsmq-0057和hsnRNAU6),PDCD4引物:上游:5’-AACTGTGCCAACCAGTCCAA-3’,下游:5’-TCTTCTCAAATGCCCTTTCATC-3’;GAPDH引物:上游:5’-GAGTCAACGGATTTGGTCGT-3’下游:5’- GACAAGCTTCCCGTTCTCAG-3’,按試劑盒說明設置反應體系及參數,每個樣本均做復孔檢測,同時每次反應均設置陰性孔。實時熒光定量逆轉錄-聚合酶鏈式反應產物經過測序檢測。結果采用2-ΔΔCT法比較。
蛋白免疫印跡法檢測各組 PDCD4 蛋白的表達:分選出的CD4+T淋巴細胞中加入100 μl蛋白裂解液混勻,然后在4℃下13 201×g離心20 min,提取上清轉移至新離心管中,然后用二辛可寧酸(BCA)法[15]檢測蛋白濃度,內參為甘油醛磷酸脫氫酶(GAPDH)。配置12%分離膠和5%濃縮膠,進行十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳,半干法轉膜40 min,5%脫脂奶粉封閉1 h,一抗(稀釋比例1:2500)4℃敷育過夜,脫色搖床上用磷酸鹽吐溫洗脫液洗膜5次,紅外熒光二抗(稀釋比例1:5000)室溫敷育2 h后在雙色紅外激光成像系統掃描成像。odyssey 3.0軟件分析目標條帶及內參條帶灰度值,以目標PDCD4條帶灰度值與內參甘油醛磷酸脫氫酶條帶灰度值的比值作為目的蛋白的相對表達量。
酶聯免疫法檢測各組腫瘤壞死因子-α和白細胞介素-10濃度:將收集的血清標本及培養基上清和elisa試劑盒常溫下放置約30 min,根據試劑盒說明書操作,于酶標儀下讀取450 nm的OD值,根據標準曲線計算出樣本的濃度。
統計學處理:應用SPSS 13.0統計軟件對數據做統計學分析。計量資料以均數±標準差表示,正態性分析采用Kolmogorov-Smirnov檢驗,兩組間比較采用成組設計t檢驗,多組間比較采用單因素方差分析,兩兩比較用LSD檢驗;計數資料以頻數和構成比表示,采用卡方檢驗。P<0.05表示差異有統計學意義。
2 結果
2.1兩組一般臨床資料比較
兩組在既往冠心病史、吸煙史、高血壓、糖尿病史、藥物治療、術前CK-MB及肌鈣蛋白I等方面差異均無統計學意義(P均>0.05)。表1
表1 兩組患者一般資料比較
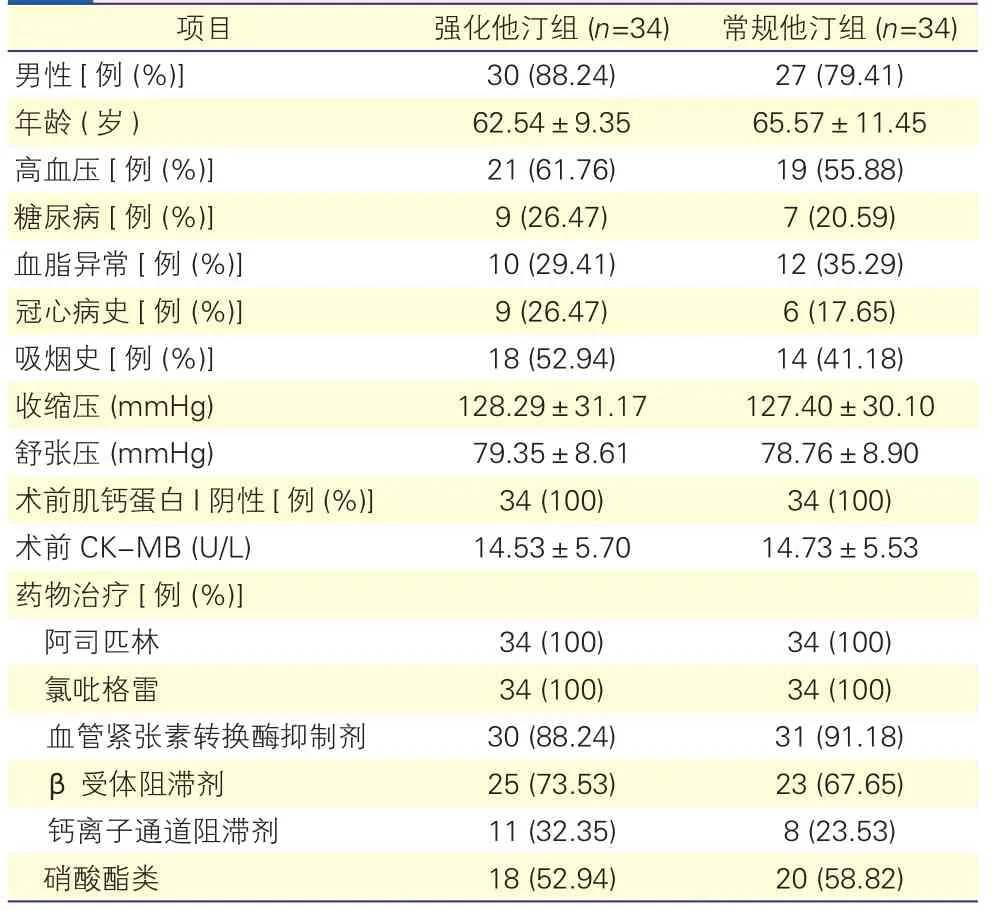
表1 兩組患者一般資料比較
注:CK-MB:肌酸激酶同工酶。1 mmHg=0.133 kPa
項目 強化他汀組 (n=34) 常規他汀組 (n=34)男性[例 (%)] 30 (88.24) 27 (79.41)年齡 (歲) 62.54±9.35 65.57±11.45高血壓[例 (%)] 21 (61.76) 19 (55.88)糖尿病[例 (%)] 9 (26.47) 7 (20.59)血脂異常[例 (%)] 10 (29.41) 12 (35.29)冠心病史[例 (%)] 9 (26.47) 6 (17.65)吸煙史[例 (%)] 18 (52.94) 14 (41.18)收縮壓 (mmHg) 128.29±31.17 127.40±30.10舒張壓 (mmHg) 79.35±8.61 78.76±8.90術前肌鈣蛋白I陰性[例 (%)] 34 (100) 34 (100)術前CK-MB (U/L) 14.53±5.70 14.73±5.53藥物治療[例 (%)]阿司匹林 34 (100) 34 (100)氯吡格雷 34 (100) 34 (100)血管緊張素轉換酶抑制劑 30 (88.24) 31 (91.18) β受體阻滯劑 25 (73.53) 23 (67.65)鈣離子通道阻滯劑 11 (32.35) 8 (23.53)硝酸酯類 18 (52.94) 20 (58.82)
2.2兩組患者支架置入情況比較
兩組病變血管部位、病變血管支數及支架置入數等差異均無統計學意義(P均>0.05)。表2
2.3兩組患者心肌損傷標記物術后高于正常高值的發生率比較
強化他汀組肌鈣蛋白I高于正常高值1~5倍的發生率低于常規他汀組(17%和30%),高于正常高值5倍以上的發生率也低于常規他汀組(30%和56%),差異均有統計學意義(P均<0.05)。強化他汀組CK-MB高于正常高值的發生率也低于常規他汀組(分別為25%和38%),差異均有統計學意義(P均<0.05)。
表2 兩組患者病變血管部位、支數及支架置入情況比較
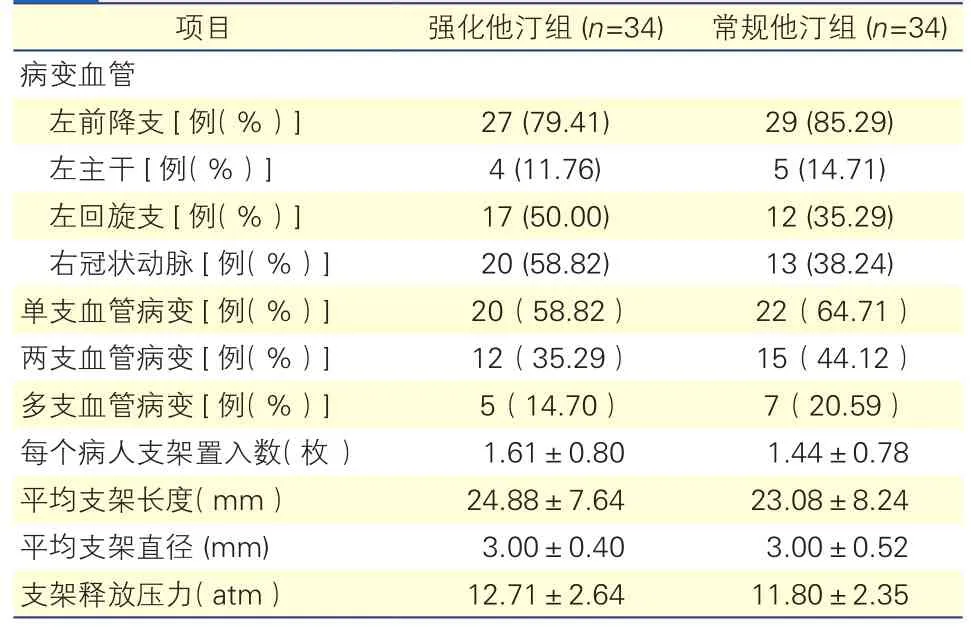
表2 兩組患者病變血管部位、支數及支架置入情況比較
注:1 atm=101.325 kPa
項目 強化他汀組 (n=34) 常規他汀組 (n=34)病變血管左前降支[例(%)] 27 (79.41) 29 (85.29)左主干[例(%)] 4 (11.76) 5 (14.71)左回旋支[例(%)] 17 (50.00) 12 (35.29)右冠狀動脈[例(%)] 20 (58.82) 13 (38.24)單支血管病變[例(%)] 20(58.82) 22(64.71)兩支血管病變[例(%)] 12(35.29) 15(44.12)多支血管病變[例(%)] 5(14.70) 7(20.59)每個病人支架置入數(枚) 1.61±0.80 1.44±0.78平均支架長度(mm) 24.88±7.64 23.08±8.24平均支架直徑 (mm) 3.00±0.40 3.00±0.52支架釋放壓力(atm) 12.71±2.64 11.80±2.35
2.4兩組患者PCI術前術后超敏C反應蛋白、miRNA-21、PDCD4 mRNA、PDCD4蛋白、腫瘤壞死因子-α、白細胞介素-10表達量的比較
常規他汀組術后超敏C反應蛋白、PDCD4 mRNA、PDCD4蛋白、腫瘤壞死因子-α較術前明顯升高,差異有統計學意義(P<0.05)。強化他汀組術后miRNA-21、白細胞介素-10表達量較術前明顯升高,PDCD4 mRNA、PDCD4蛋白較術前明顯降低,差異均有統計學意義(P<0.05)。表3,圖1
表3 兩 組 患 者PCI術 前 術 后 超 敏C反 應 蛋 白、miRNA-21、PDCD4 mRNA、PDCD4蛋白、腫瘤壞死因子-α、白細胞介素-10表達量的比較
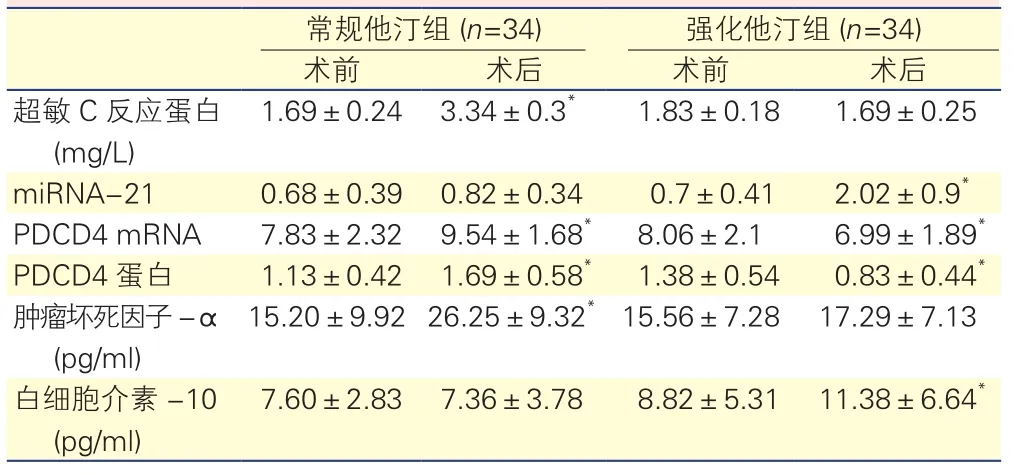
表3 兩 組 患 者PCI術 前 術 后 超 敏C反 應 蛋 白、miRNA-21、PDCD4 mRNA、PDCD4蛋白、腫瘤壞死因子-α、白細胞介素-10表達量的比較
注:與本組術前比較*P<0.05。PCI:經皮冠狀動脈介入治療 miRNA-21:微小核糖核酸-21;PDCD4:程序性細胞死亡因子
常規他汀組 (n=34) 強化他汀組 (n=34)術前 術后 術前 術后超敏C反應蛋白(mg/L) 1.69±0.24 3.34±0.3* 1.83±0.18 1.69±0.25 miRNA-21 0.68±0.39 0.82±0.34 0.7±0.41 2.02±0.9*PDCD4 mRNA 7.83±2.32 9.54±1.68* 8.06±2.1 6.99±1.89*PDCD4蛋白 1.13±0.42 1.69±0.58* 1.38±0.54 0.83±0.44*腫瘤壞死因子-α (pg/ml) 15.20±9.92 26.25±9.32*15.56±7.28 17.29±7.13白細胞介素-10 (pg/ml) 7.60±2.83 7.36±3.78 8.82±5.31 11.38±6.64*
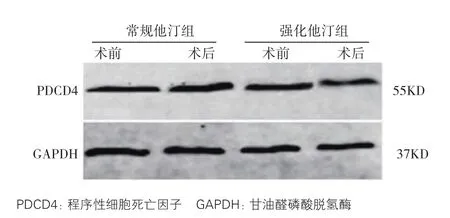
圖1 兩組患者PCI術前后PDCD4蛋白表達量電泳圖
3 討論
PCI是冠心病介入治療目前最有效手段之一,在開通病變冠狀動脈的同時常常也可引起心肌損傷,主要臨床表現為心肌損傷標記物肌鈣蛋白I水平的升高,預后不良。術中經皮球囊擴張、支架置入等擠壓斑塊,損傷血管內皮,誘導單核細胞合成炎性細胞因子等激發炎癥反應。PCI術后心肌損傷與炎癥反應密切相關,是圍術期心肌損傷的重要病因之一[9]。阿托伐他汀在血管成形術中減少心肌損傷的系列研究結果表明[7],PCI前給予強化他汀治療可減少術后心肌損傷,改善患者預后。在本研究中,與常規他汀組(阿托伐他汀20 mg/d)比較,術前2天給予強化他汀(阿托伐他汀80 mg/d)治療可有效降低術后心肌損傷標記物肌鈣蛋白I及CK-MB高于正常高值的發生率,更能減少PCI術后肌鈣蛋白I高于正常高值5倍的發生率(2012年全球心肌梗死工作組將PCI術后心肌梗死定義為超過肌鈣蛋白I 99%正常高值達5倍以上),這說明了PCI術前給予強化他汀藥物治療更能減少術后心肌損傷,起到心肌保護作用。超敏C反應蛋白是急性期蛋白,與炎癥反應程度呈正相關[10]。PCI術后兩組患者超敏C反應蛋白均比術前升高,常規他汀組升高更為明顯,而強化他汀組可以緩解超敏C反應蛋白上升趨勢,表明術前強化他汀治療能有效減輕PCI術后炎癥反應,起到術后心肌保護作用。
既往研究表明,冠心病患者體內存在CD4+T淋巴細胞的過度激活[11],尤其CD4+T淋巴細胞亞型Th1細胞過度增殖,并致使腫瘤壞死因子-α、白細胞介素-10等各種炎癥因子的分泌失衡,參與了不穩定粥樣斑塊的發生、發展過程[1],PCI術則進一步加重CD4+T淋巴細胞介導的炎癥反應[2]。miRNA-21既往發現具有心肌保護作用,主要參與心肌細胞的生長及分化[12],抑制血管生成[13]。Yin等[14]通過動物實驗證實,缺血再灌注損傷可使大鼠心肌細胞中miRNA-21的表達顯著上調,將miRNA-21注入大鼠體內可顯著減少缺血再灌注損傷所致的心肌細胞梗死面積,從而起到心肌保護效應,這一效應可能與miRNA-21具有潛在調控炎癥反應的作用有關[15]。
研究發現,miRNA-21具有抑制免疫炎癥反應的作用。Lu等[16]的研究發現抑制CD4+T淋巴細胞miRNA-21表達能加重Th1介導的炎癥反應,減少Th2細胞分泌抗炎因子,表明促進miRNA-21表達可抑制CD4+T淋巴細胞亞型Th1過度激活的炎癥反應。PDCD4是miRNA-21的靶基因[4],研究發現敲除小鼠PDCD4基因后,小鼠抵抗炎癥的能力增加,淋巴細胞分泌白細胞介素-10炎癥因子明顯增多,腫瘤壞死因子-α濃度減少[17]。在CD4+T淋巴細胞中,miRNA-21負調控PDCD4蛋白表達[18]。將miRNA-21前體轉染至CD4+T淋巴細胞誘導miRNA-21表達增加,可明顯抑制PDCD4蛋白表達,導致白細胞介素-10分泌增多[19],抑制miRNA-21表達可使腫瘤壞死因子-α表達增加[6]。這些結果提示上調miRNA-21表達,可負調控其靶基因PDCD4蛋白,從而促進CD4+T淋巴細胞分泌白細胞介素-10增多,抑制腫瘤壞死因子-α表達。
阿托伐他汀在血管成形術中減少心肌損傷的系列研究發現,PCI術前給予大劑量阿托伐他汀,能夠有效的降低炎癥因子水平,減少術后心肌損傷的發生率,明顯改善患者近、遠期預后[7]。阿托伐他汀能夠抑制T淋巴細胞的生長、增殖、活性,促進白細胞介素-10表達增加,抑制腫瘤壞死因子-α。腫瘤壞死因子-α是啟動級聯炎癥反應的關鍵因子,與PCI術后心肌損傷密切相關[20]。白細胞介素-10又稱細胞因子合成抑制因子,能抑制多種炎癥因子包括腫瘤壞死因子-α分泌,減輕炎癥反應發生、發展[21]。Derkacz等[22]的表明,血清白細胞介素-10的增加可有效減少PCI術后心肌炎癥損傷。
本研究發現,PCI術前給予80 mg大劑量的阿托伐他汀, CD4+T淋巴細胞miRNA-21表達增多,其靶標PDCD4表達減少,血清白細胞介素-10分泌增多,腫瘤壞死因子-α濃度減少,而常規組miRNA-21上調不明顯,PDCD4蛋白表達增加,腫瘤壞死因子-α濃度增多,這些結果提示,強化阿托伐他汀減少PCI術后心肌損傷,可能部分通過上調CD4+T淋巴細胞miRNA-21的表達,抑制靶蛋白PDCD4,促進血清白細胞介素-10分泌,降低腫瘤壞死因子-α濃度而起效。這一發現,為PCI術后心肌損傷的防治提供了新的理論思路。
[1] Kriszbacher I, Koppan M, Bodis J, et al. Inflammation, atherosclerosis, and coronary artery disease. N Engl J Med, 2005, 353: 429-430.
[2] 趙獻明, 李浪, 陸永光, 等. 冠狀動脈微栓塞后大鼠心肌組織炎癥細胞因子表達和心功能的動態變化及關系. 中國循環雜志, 2009, 24: 258-262.
[3] Pauley KM, Satoh M, Chan AL, et al. Upregulated miR-146a expression in peripheral blood mononuclear cells from rheumatoid arthritis patients. Arthritis Res Ther, 2008, 10: R101.
[4] Sheedy FJ, Palsson-McDermott E, Hennessy EJ, et al. Negative suppressor PDCD4 by the microRNA miR-21 regulation of TLR4 via targeting of the proinf l ammatory tumor. Nat Immunol, 2011, 11: 141-147.
[5] Zhong WW, Hai FL, Ji FS, et al. Inductive microRNA-21 impairs anti-mycobacterial responses by targeting IL-12 and Bcl-2. FEBS Letters, 2012, 586: 2459-2467.
[6] Sawanta DV, Wu H, Kaplan MH, et al. The Bcl6 target gene microRNA-21 promotes Th2 differentiation by a T cell intrinsic pathway. Mol Immunolo, 2013, 54: 435-442.
[7] Patti G, Pasceri V, Colonna G, et al. Atorvastatin pretreatment improves outcomes in patients with acute coronary syndromes undergoing early percutaneous coronary intervention: results of the ARMYDA-ACS randomized trial. J Am Coll Cardiol, 2007, 49: 1272-1278.
[8] Smith PK, Krohn RI, Hermanson GT, et al. Measurement of protein using bicinchoninic acid. Anal Biochem, 1985, 150: 76-85.
[9] Saadeddin SM, Habbab MA, Sobki SH, et al. Minormyocardial injury after elective uncomplicated successful PTCA with or without stenting: detection by cardiac troponins. Catheter Cardiovasc Interv, 2001, 53: 188-192.
[10] 劉梅林, 梁文奕. 高敏C-反應蛋白在冠心病患者診治中的臨床意義. 中國循環雜志, 2012, 27: 165-167.
[11] Methe H, Brunner S, Wiegand D, et al. Enhanced T-helper-1 lymphocyte activation patterns in acute coronary syndromes. J Am Coll Cardiol, 2005, 45: 1939-1945.
[12] Cheng Y, Ji R, Yue J, et al. MicroRNAs are aberrantly expressed in hypertrophic heart: do they play a role in cardiac hypertrophy. Am J Pathol, 2007, 170: 1831-1840.
[13] Sabatel C, Malvaux L, Bovy N, et al. MicroRNA-21 Exhibits Antiangiogenic Function by Targeting RhoB Expression in Endothelial Cells. PLoS One, 2011, 6: e16979.
[14] Yin C, Wang X, Kukreja RC. Endogenous microRNAs induced by heat-shock reduce myocardial infarction following ischemiareperfusion in mice. FEBS Lett, 2008, 582: 4137-4142.
[15] Roy1 S, Khanna1 S, Syed-Rehan A, et al. MicroRNA expression in response to murine myocardial infarction: miR-21 regulates fi broblast metalloprotease-2 via phosphatase and tensin homologue. Cardiovascular Research, 2009, 82: 21-29.
[16] Lu TX, Hartner J, Lim EJ, et al. MicroRNA-21 limits in vivo immune response-mediated activation of the IL-12/IFN-gamma pathway, Th1 polarization, and the severity of delayed-type hypersensitivity. Immunol, 2011, 187: 3362-3373.
[17] Hilliard A, Hilliard B, Zheng SJ, et al. Translational regulation of autoimmune inflammation and lymphoma genesis by programmed cell death 4. J Immunol, 2006, 177: 8095-8102.
[18] Garchow BG, Bartulos Encinas O, Leung YT, et al, Silencing of microRNA-21 in vivo ameliorates autoimmune splenomegaly in lupus mice. EMBO Mol Med, 2011, 3: 605-615.
[19] Stagakis E, Bertsias G, Verginis P, et al. Identif i cation of novel microRNA signatures linked to human lupus disease activity and pathogenesis: miR-21 regulates aberrant T cell responses through regulation of PDCD4 expression. Ann Rheum Dis, 2011, 70: 1496-1506.
[20] Kehmeier ES, Lepper W, Kropp M, et al. TNF-α, myocardial perfusion and function in patients with ST-segment elevation myocardial infarction and primary percutaneous coronary intervention. Clin Res Cardiol, 2012, 101: 815-827.
[21] Moore KW, de Waal Malefyt R, Coffman RL. Interleukin-10 and the interleukin-10 receptor. Annu Rev Immunol, 2001, 19: 683-765.
[22] Derkacz A, Protasiewicz M, Poreba R, et al. Effect of the intravascular low energy laser illumination during percutaneous coronary intervention on the inflammatory process in vascular wall. Lasers Med Sci, 2012, 28: 763-768.
Effect of Intensive Atorvastatin Up-regulating CD4+T Lymphocyte MicroRNA-21 Expression on Reducing the Post PCI Myocardial Injury in Patients With Unstable Angina Pectoris
LIU Yang, LI Lang, SU Qiang, ZHOU You, WANG Jiang-you, SUN Yu-han, YANG Dong.
Department of Cardiology, The First Aff i liated Hospital of Guangxi Medical University, Nanning (530021), Guangxi, China Corresponding Author: LI Lang, Email: drlilang@163.com
Objective: To explore the intensive atorvastatin up-regulating CD4+T lymphocyte microRNA-21 (miRNA-21) expression on reducing the post PCI myocardial injury in patients with unstable angina pectoris (UAP).Methods: A total of 68 UAP patients received elective PCI in our hospital from 2011-11 to 2012-05 were enrolled and randomized into 2 groups. Intensive group, the patients were treated by atorvastatin 80 mg/d before PCI and 40 mg/d after PCI. Routine group, the patients received atorvastatin 20 mg/d before and after PCI, n=34 in each group. The creatine kinase-MB (CK-MB), Troponin I (CTnI) and high sensitivity C-reactive protein (hs-CRP) were examined before and at 16-24 h after the operation. The miRNA-21 and programmed cell death 4 (PDCD4 ) mRNA in CD4+T lymphocyte were detected by RT-PCR, the PDCD4 protein expression was measured by Western blot analysis, the interleukin-10 (IL-10) and tumor necrosis factor-α (TNF-α) were checked by ELISA.Results: ①In Intensive group, the incidence for CTnI at 1-5 times higher or above 5 times higher than normal value and the incidence for CK-MB higher than normal value were all lower than those in Routine group, all P<0.05. ②In Routine group, the post operational hs-CRP and TNF-α levels, the PDCD4 mRNA and protein expressions were signif i cantly increased thanthey were before the operation, all P<0.05.③In Intensive group, the post operational miRNA-21 and IL-10 expressions were increased, the PDCD4 mRNA and protein expressions were decreased than they were before the operation, P<0.05.Conclusion: The intensive atorvastatin treatment may reduce the post PCI myocardial injury, which might be related to upregulating CD4+T lymphocyte miRNA-21 expression and therefore, resulted in decreased expression of target protein PDCD4.
Atorvastatin; MicroRNA-21; Percutaneous coronary intervention; Programmed cell death 4; CD4+T lymphocyte
2013-08-22)
(編輯:王寶茹)
國家自然科學基金資助項目(81260042,81160046),廣西碩士研究生科研創新項目(YCSZ2013033) , 廣西科學研究與技術開發計劃資助項目(桂科攻1140003A-19)
530021 廣西壯族自治區南寧市,廣西醫科大學第一附屬醫院 心血管內科
劉洋 碩士研究生 主要研究方向:冠心病介入治療及其防治 Email:timedie@foxmail.com 通訊作者:李浪 Email:drlilang@163.com
R54
A
1000-3614(2014)01-0026-05
10.3969/j.issn.1000-3614.2014.01.008
方法:入選2011-11至2012-05在我院住院行擇期PCI術的不穩定性心絞痛患者68例,隨機分為強化他汀組(阿托伐他汀術前80 mg/d,術后40 mg/d,n=34)和常規他汀組(阿托伐他汀術前術后均20 mg/d,n=34)。分別于PCI術前、術后16~24 h抽血檢查肌酸激酶同工酶(CK-MB)、肌鈣蛋白I、超敏C反應蛋白及新鮮外周血。實時熒光定量逆轉錄-聚合酶鏈式反應法(qRT-PCR)檢測CD4+T淋巴細胞miRNA-21、程序性細胞死亡因子4(PDCD4)mRNA表達,蛋白免疫印跡法檢測CD4+T淋巴細胞PDCD4蛋白表達,酶聯免疫法檢測血清白細胞介素-10、腫瘤壞死因子-α的濃度。
結果:強化他汀組肌鈣蛋白I高于正常高值1~5倍及高于5倍以上的發生率低于常規他汀組;強化他汀組CK-MB高于正常高值的發生率也低于常規他汀組,差異均有統計學意義(P均<0.05)。常規他汀組術后超敏C反應蛋白、PDCD4 mRNA、PDCD4蛋白、腫瘤壞死因子-α較術前明顯升高,差異有統計學意義(P<0.05)。強化他汀組術后miRNA-21、白細胞介素-10表達量較術前明顯升高,PDCD4 mRNA、PDCD4蛋白較術前明顯降低,差異均有統計學意義(P<0.05)。
結論: 強化阿托伐他汀減輕PCI術后心肌損傷可能與上調PCI術后CD4+T淋巴細胞miRNA-21表達,導致其靶蛋白PDCD4表達減少有關。

