微生物燃料電池的研究應用進展
王維大,李浩然,馮雅麗,唐新華,杜竹瑋,杜云龍
(1 北京科技大學土木與環境工程學院,北京 100083;2 中國科學院過程工程研究所生化工程重點實驗室,北京100190;3 新加坡國立大學土木與環境工程學院水研究中心,新加坡 117576)
微生物燃料電池(MFC)是通過產電菌代謝可生物降解的有機物,并將代謝產生的電子傳遞到外電路輸出電能,因其獨特的能源環境效應而受到了科研人員的廣泛關注,原理及應用如圖1所示。
目前,微生物燃料電池的研究已經歷了近十年的快速發展時期,每年研究報道呈指數型增長,在提高MFC的功率輸出、降低內阻、優化MFC結構及降低成本等方面進行了大量的研究,功率密度增長了幾個數量級[1],研究成果為其將來的工業化應用提供了強有力的支撐,并且隨著研究的深入,拓展出了微生物電解電池(MEC)、微生物脫鹽電池(MDC)、微生物傳感器、合成生物制品等新型發展方向,從而在產電的同時,實現污水處理、脫氮脫硝、制取燃料、合成化學品等,這使其具有了獨特的技術及功能上的優勢,顯現出了廣闊的應用前景。本文作者較為全面地概述了近幾年MFC的研究現狀及其應用進展,為將來的研究工作提供一定的參考與借鑒。
1 微生物燃料電池
1.1 產電微生物及其群落
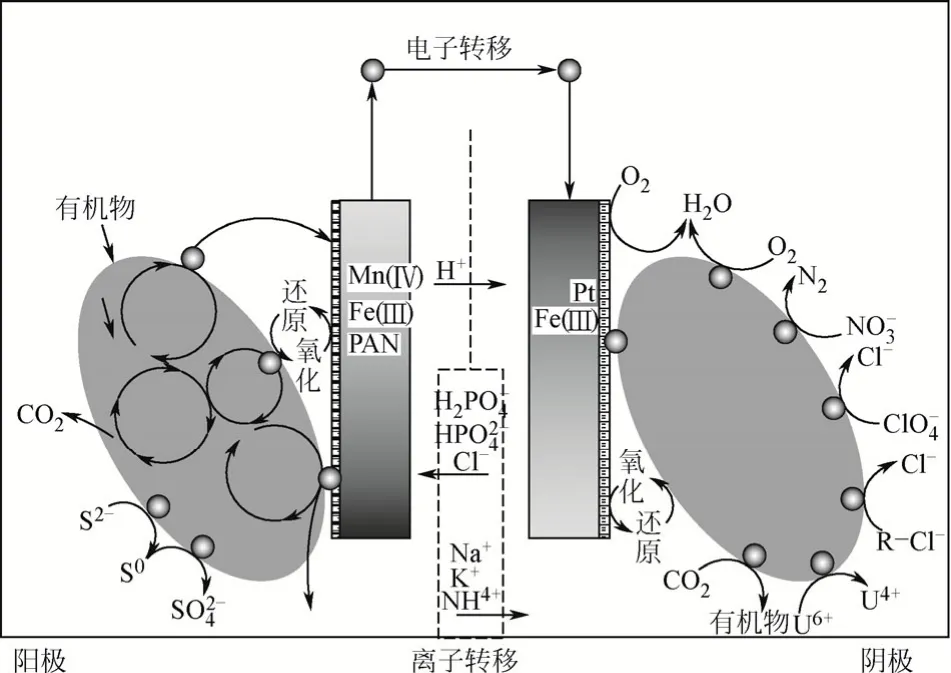
圖1 微生物燃料電池及其應用原理圖
目前,無介體微生物是MFC研究的主流,這類微生物可以自我產生電子介體或者通過自身的細胞組織進行電子傳遞,如細胞膜電子傳遞鏈和納米導線,解決了需電子介體微生物燃料電池的高運行成本問題,同時也保證了功率密度的高效輸出。目前,研究報道無需外加介體的產電微生物主要有Shewanella putrefacien、Geobacter sulferreducen、 Geobacter metallireducens、 Geopsychrobacter electrodiphilus、 Thermincola.sp.、 Rhodoferax ferrireducens、Lysinibacillus sphaericus等。國內的周良等[2-3]基于水-礦-微生物系統鐵錳循環轉化過程(圖2),最早開始采用Geobacter metallireducens、Rhodoferax ferrireducens構建無介體微生物燃料電池,闡述了異化金屬還原菌代謝的電子傳遞方式,并探索了微生物燃料電池用于廢水處理的可能。鄧麗芳等[4]分離出了一種肺炎克雷伯氏菌,并對其電子傳遞機制進行了研究,提出了克雷伯氏菌 MFC中的2,6-二叔丁基苯醌穿梭機制。Luo等[5]從利用活性污泥啟動的 MFC中分離出了一種兼性厭氧產電菌Tolumonas osonensisa,其為革蘭陽性菌,可降解多種有機物,并對菌體細胞進行了通透性處理,其產電功率得到了明顯的提高,拓寬了 MFC的實際應用。
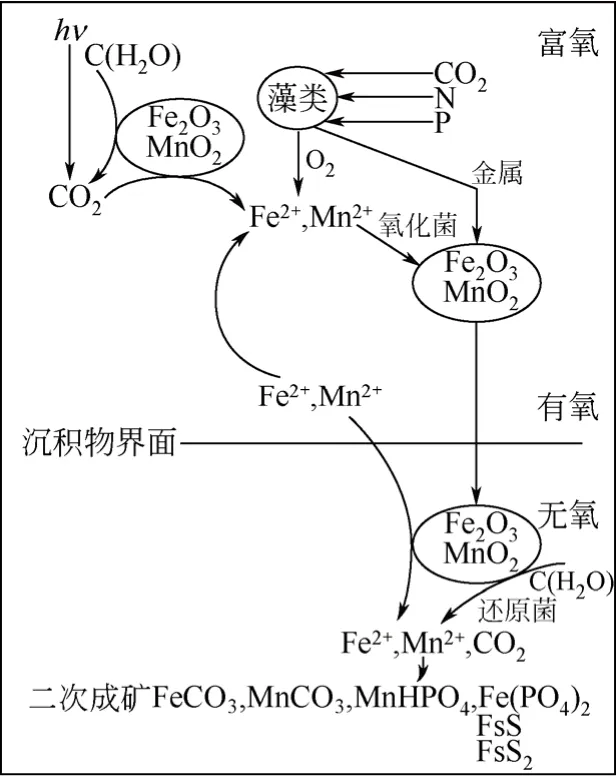
圖2 水-礦-微生物系統鐵錳循環轉化過程
對于MFC陽極微生物的電子轉移機制,普遍認可的方式主要有細胞接觸轉移、電子中介體轉移和納米導線轉移 3種。在納米導線方面,Lovley等[6]認為,諸如Desulfovibrio desulfuricans等產電微生物的微生物納米線能更長距離地傳導電子,穿越這種桿菌生物膜的菌絲網讓生物膜具有了與廣泛應用于電子工業的人造導電聚合物相媲美的導電性,電子可在其上傳導,傳導的距離可為細菌體長的幾千倍,這種細菌的蛋白微絲就像真正的金屬導線一樣,這種作用代表了生物學領域一個基本的新特性。Reguera等[7-8]用電導探針原子力顯微鏡測定了Geobacter sulfurreducen表面菌毛的電導率并研究了Shewanella納米導線的在100mV的電壓下電子傳遞速率,相對于其他電子傳遞方式,納米導線具有更優良的導電性。Ntarlagiannis等[9]向一根石英砂柱底部接種Shewanella oneidensis MR-1,并持續地投加乳酸作為電子供體,讓氧氣自然擴散于砂柱頂部,結果檢測到明顯的生物電流信號,掃描電鏡證實在細菌或細菌礦物間形成了大量絲狀的導電網絡(圖3),說明微生物產生的納米導線可能在土壤中交織在一起,這個結果推進了人們對環境表層電子轉移機制的理解。納米導線的發現,不僅給微生物燃料電池在提高產電效率方面帶來了希望、設計和制造廉價高效的生物陽極,還為環境污染修復、細胞生物信息學以及納米生物電子學方面提供了潛在的應用前景,因此,生物納米導線的人工制備方法是今后研究的主題之一[10]。

圖3 沉積物界面微生物電纜傳遞電子示意圖
對于MFC中陽極系統的微生物群落結構,有關研究表明,利用混合菌種構建MFC要優于純菌構建MFC的性能,因為混合接種的MFC中微生物具有高度的生物多樣性,這些微生物隨著不同的運行條件的變化而變化,其中產電菌通過產電過程直接或間接獲得能量,從而逐漸成為該體系中的優勢微生物。Li等[11]研究了導電聚合物生物陰極應用和微生物群落結構的變化,結果表明導電聚合物改性后,陰極微生物群落中優勢菌由β-Proteobacteria變為α,γ-Proteobacteria.Rubaba等[12]研究了不同膜電極裝置 MFC的產電性能和群落結構,結果表明產電性能最好時,其細菌群落結構中乳酸發酵和鐵還原菌屬占主導地位,通過對其分離與篩選,主要為革蘭陽性菌 Propioniferax sp.P7,表明該細菌在MFC中構建電子傳遞網絡發揮了積極作用。MFC中微生物群落由于存在很大的差異,因此,產電微生物與其他微生物之間的相互作用以及整個陽極系統菌種的演替規律還有待于進一步研究。
1.2 電極材料
降低成本是推進MFC實用化的必經之路,開發廉價高效的電極材料是降低MFC成本的關鍵。MFC的電極分為陽極和陰極,其作為微生物和催化劑的載體,以及電子轉移的導體,須具有良好的導電性、穩定性,一定的機械強度,廉價的成本以及電極表面與微生物具有良好的相容性。
1.2.1 陰極材料
21世紀初,微生物燃料電池的研究重點是功率輸出的提高,經過十年左右的研究工作,其功率密度輸出提高了100多倍。近年來,研究重心更偏向于微生物燃料電池的應用化研究。
目前在MFC中應用最多的還是鉑催化劑,但金屬鉑價格昂貴。近幾年來,非貴金屬氧化物催化劑由于其來源廣泛、價格低廉,被廣泛應用于多種電池體系,如 PbO2、MnOx、TiO2、鐵氧化物等,其中,MnO2和TiO2是目前研究較多的MFC陰極催化劑。Liu等[13-14]利用納米二氧化錳作為陰極催化劑,構建了 MFC處理模擬生活污水,其最大功率密度可達722mW/m3,具有催化性能好、價格低廉等優點。Lu等[15]以涂載了TiO2的石墨板為陰極電極,分別比較了可見光照射和黑暗條件下陰極負載TiO2的MFC性能,并進一步與鉑電極和石墨電極性能進行了對比,其功率密度比石墨陰極 MFC高230%,低于陰極負載鉑催化劑MFC的功率密度。Wang等[16]利用羰基鐵熱解修飾MFC陰極,結果表明,陰極修飾后的MFC最大輸出電壓、功率密度和最小表觀內阻分別為 220mV、925mW/m3和278Ω,其性能略高于鉑碳修飾陰極的電池。
過渡金屬大環化合物對氧具有電化學還原活性,尤其是過渡金屬卟啉和酞菁化合物。由于大環類化合物的脫金屬作用比較強,在中性或者堿性的環境中是穩定的,因此,這類催化劑適合成為中性操作條件下MFC的陰極催化劑。過渡金屬大環化合物的中心離子通常為Fe、Co、Ni等,其中以Fe和Co形成的配合物具有較高的氧還原活性。有研究人員[17]以鐵酞菁(FePc)和鈷卟啉(CoTMPP)作雙室MFC陰極催化劑,這兩種陰極催化劑的性能均接近于貴金屬鉑催化劑的水平。也有研究人員[18]將鐵鈷雙核雙金屬酞菁化合物作為MFC陰極催化劑進行了研究,結果表明,具有非常好的電催化活性。
導電聚合物因其對氧氣具有較好的還原催化性在MFC領域占有很重要的比重。Yuan等[19]將聚吡咯與碳黑復合物(Ppy/C)用于陰極,研究了其作為陰極催化劑的作用。經過循環伏安掃描及線性伏安掃描分析發現,修飾了 Ppy/C后,氧化還原反應電位正移了約 260mV,電池的最大功率密度為401.8mW/m2,大于碳黑陰極(90.9mW/m2)和鐵陰極(336.6mW/m2)的功率密度,雖低于鉑電極的功率密度,但是單位成本的能源輸出比鉑電極高了15倍。他們還研究了聚苯胺-碳黑-酞菁鐵(PANI/C/FePc)對氧氣還原反應的催化作用[20],運行結果顯示,PANI/C/FePc陰極催化劑的最大功率輸出達到了630.5mW/m2,大于C/FePc(336.6mW/m2)和Pt(575.6mW/m2)陰極的功率輸出。Fu等[21]在雙室微生物燃料電池中,研究了普魯士藍/聚苯胺(PB/PANI)復合物的催化效果。通過電化學檢測發現,PB/PANI具有很強的電化學反應活性;微生物燃料電池的運行結果顯示,電池的輸出功率能夠達到13.12W/m3,與清潔碳陰極系統中加入K3Fe(CN)6所得到的功率輸出相似(12.67W/m3)。Lai等[22]通過煅燒聚苯胺和鐵復合物制備了一種新型的碳氮金屬催化劑,其最大功率密度為 10.17W/m3,高于 Pt/C為催化劑的MFC,證明了碳氮金屬催化劑在MFC中是一種潛在可替代Pt/C的催化劑。
1.2.2 陽極材料
微生物燃料電池系統的無介體產電菌群主要是異化金屬還原菌,由于這些菌與過渡態金屬之間的親和作用,研究人員開始使用過渡態金屬氧化物作為電極修飾劑,以促進微生物燃料電池系統產電能力的提升。研究比較成熟的金屬化合物主要有Fe3O4、MnO2、WC等。
經修飾后的陽極能夠通過靜電吸附、與外膜表面的細胞色素酶作用等方式促進產電菌群在陽極表面的黏附,同時通過過渡金屬本身晶格上電子的不穩定性促進了電子的傳遞。李少華等[23]將 NaVO3及 K3[VO(O)2(OOC-COO)]分別用于陽極及陰極催化,使電池最大輸出功率提高了15倍。M yers等[24]研究發現,S.putrefaciens的呼吸電子傳遞過程與Fe3+、Mn4+的厭氧還原過程有直接關聯,在厭氧條件下,微生物80%的呼吸色素都分布于細胞外膜表面。Lies等[25]的研究也發現 Shewanella oneidensis MR-1細胞在納米多孔玻璃珠表面成膜的同時伴隨著包裹在其中的三價鐵的還原。
金屬化合物修飾得到的電極比表面積一般較小,不利于微生物的大量附著,同時金屬化合物的催化效能適用面較窄。隨著多孔性陽極材料、新產電復合菌群的應用,電極修飾的方法已逐漸以非金屬修飾法為主,如氨氣下高溫焙燒,電化學氧化及納米、高分子材料修飾等。氨氣保護下高溫處理及電化學氧化處理兩種方法是對陽極材料本體進行處理,活化電極表面基團,增大活性面積等。Cheng等[26]成功地將氨修飾的碳布材料應用到了微生物燃料電池中。碳布進行了氨基修飾后,由于氨基基團的存在,材料本體上的表面電荷得到了顯著增加(從0.38meq/m2增加到3.99meq/m2),微生物與電極表面間的靜電作用得到了顯著增強,同時氨基與微生物表面的羧基形成肽鍵,增強它們之間的相互作用。由此,微生物燃料電池的產電性能得到了提高,最大功率密度得到了提升(達 115W/m3),同時啟動時間也降低了許多(減少50%)。Wang等[27]通過對碳布進行不同的前處理發現,氨氣氛圍下高溫處理使得電極表面的氮碳比增大,電池功率達到了51W/m3,與空白實驗對比有了很大的提高。
電化學氧化修飾法主要是通過在酸性溶液中的電解,增加電極表面的羧基基團。雖然微生物表面凈電荷為負電,電極表面羧基的增加會增大靜電排斥力,但是由于微生物表面存在著大量細胞色素,其上含有許多活性基團,羧基可以與細胞色素上的活性基團形成強烈的氫鍵等化學鍵作用[28],增強了微生物與電極之間的化學相互作用。因而電極表面羧基化在微生物燃料電池產電性能的優化中具有一定的應用前景。Tang等[29]通過在硫酸條件下對石墨氈進行電解,發現石墨氈表面的羧基基團增加,生物膜在電極上的電化學活性顯著提高。電池的啟動時間從 170h減少到 70h,最大輸出功率密度從(967±40)mW/m2增加到(1630±50)mW/m2,庫侖效率從38.4%增大到57.1%。而納米、高分子材料修飾則是對電極本體進行外接修飾基團,改變電極表面的活性基團或表面空間結構性質等,從而優化微生物燃料電池系統的陽極效率,典型的納米、高分子材料修飾物有導電聚合物、碳納米管等。Feng等[30]在吡咯(pyrrole)與蒽醌-2,6-二磺酸鈉(AQDS)的混合溶液中采用恒電位的方法在碳氈表面制得一層導電聚合物薄膜(Ppy/AQDS),并將其作為陽極應用到一個雙室微生物燃料電池中。通過與陽極未經修飾的微生物燃料電池進行對比研究發現,當在陽極表面修飾上一層導電聚合物膜后,微生物燃料電池的功率提高了13倍,陽極的比表面積增加了,電極上吸附的微生物數量也有增多。電極上固定AQDS作為一種電子轉移介體,也進一步提高了電子傳遞的效率。
Li等[31]研究了導電聚合物對微生物燃料電池產電及電極表面生物多樣性的影響。研究中使用導電聚苯胺以及聚(苯胺-鄰氨基酚)對陽極進行修飾,發現修飾后的電極可以縮短電池的啟動時間,電池的功率輸出相較于清潔電極分別提高了35%、18%。同時,變性梯度凝膠電泳分析結果顯示,修飾后電極上的微生物種類增多了,兩類修飾電極上微生物種群所占的比例也不相同。Zou等[32]將聚吡咯做成納米結構修飾到陽極上,并且對比了不同納米結構的作用優劣。通過循環伏安法及電化學阻抗測定,發現修飾了纖維聚吡咯的電極內阻(4.3Ω)要小于球狀聚吡咯的電極內阻(12.6Ω),同時纖維聚吡咯電極的功率輸出密度(3.4mW/m2)要大于球狀聚吡咯電極的功率輸出密度(3.1mW/m2),由此顯示出納米纖維聚吡咯在電極上的作用要優于球狀納米聚吡咯的作用。Qiao等[33]合成了一種具有高比表面積、孔徑分布均勻的納米聚苯胺-二氧化鈦復合物。實驗結果表明,當聚苯胺所占質量分數為30%時,復合物的電催化及生物催化性能最好,功率密度達到了1495mW/m2,是之前有關研究報道的兩倍。Lai等[34]對HSO摻雜聚苯胺修飾MFC陽極進行了研究,結果表明:修飾后電池最大功率輸出為5.16W/m3,內阻為90Ω,啟動時間縮短至4天。經聚苯胺修飾后負載生物量增多,防止了聚苯胺的脫落,并促進了電子的轉移。
碳納米管也被應用于微生物燃料電池的陽極修飾之中并取得了一定的研究進展,而更多的研究報告集中在碳納米管及聚合物復合修飾電極的應用。Zou等[35]采用原位化學聚合的方法在碳納米管(CNTs)上聚合形成的了一層聚吡咯膜,制得聚吡咯/碳納米管(PPy-CNTs)修飾電極。通過循環伏安法、電化學阻抗譜圖及放電實驗測試,PPy-CNTs修飾電極相比于平板碳紙電極具有更加優良的電化學特性。電池的輸出功率隨著修飾密度的增大而增加。在大腸桿菌微生物燃料電池中,5mg/m2PPy-CNTs修飾密度的條件下,最大功率輸出為228mW/m2,遠大于其他使用電子傳遞中介體的大腸桿菌燃料電池。Kim等[36]采用多壁碳納米管-聚丙烯腈復合物修飾碳紙陽極,研究結果顯示復合物含有 5%(質量分數)的多壁碳納米管時,微生物燃料電池的功率輸出最大,電極的電化學活性最高。
隨著研究的深入,相信會有更多的導電聚合物被用于微生物燃料電池的研究中,用于提高微生物燃料電池的性能與功率輸出,為其工業化應用做出積極的影響。
1.3 MFC與MEC的放大
反應器的中試放大是微生物燃料電池工業應用的一個必經之路,但其由于涉及微生物、材料、技術以及經濟等方面,給MFC實際應用帶來了諸多困難。目前,制約微生物燃料電池的放大的因素主要包括:①電池功率密度較低,離實際應用相差較遠;②電極材料,特別是鉑催化劑價格昂貴;③微生物燃料電池長期運行容易造成電極和膜的污染,運行成本高和操作難度大。

圖4 堆棧式微生物燃料電池堆
由于單個微生物燃料電池內阻較大,輸出功率低,廢水處理能力有限,并且電池的功率會隨著單電池體積的增大而增大,電池的功率密度卻是隨著體積的增大而減小,這種規律決定了微生物燃料電池的放大應該是將多個相同的單電池有機地組合起來。因此,對于MFC放大的研究,目前主要包括兩個方面:一方面是對反應器串并聯的研究;另一方面是中試研究。在反應器串并聯研究方面,李頂杰等[37]研究了不同聯接形式對電池組宏觀功率的影響,明確指出了通過混聯消除反極現象的方法。Aelterman等[38]將6個微生物燃料電池串/并聯起來(圖4),陽極和陰極都為石墨棒,以乙酸鈉為底物,鐵氰化物為陰極電解質,當電池并聯時產生59W/m3的最大功率密度,庫侖效率為 78%;串聯時產生51W/m3的最大功率密度,庫侖效率為 12%。電池功率比單個電池提高了不少,但是電池電壓不平衡,電極的反極使得某些電池產生負電壓,嚴重影響電池的運行。Shin等[39]設計的由5個雙極板微生物燃料電池構成的電池組,以葡萄糖為底物,以鐵氰化物為陰極電解質,得到最大功率密度為1300mW/m2,而使用純氧時,最大功率密度為230mW/m2,他們使用電容器將產生的電能儲存起來,點亮了一個小燈泡。Rahimnejad等[40]利用釀酒酵母菌作為生物催化劑,構建了由4個單元組成的微生物燃料電池堆,運行結果表明,其最大電流和功率分別為6447mA/m2和2003mW/m2,庫侖效率達到了 22%。Oh等[41]將兩個微生物燃料電池串聯起來,研究微生物燃料電池的電壓反向問題。最初,兩個電池的輸出電壓相同,但幾個周期后,其中的一個電池輸出電壓降低,接下來是輸出電壓反向,導致電池總電壓從380mV降到80mV。這表明底物消耗不均會導致電池的電壓反向。Li等[42]對一個10L的蛇形微生物燃料電池堆(圖5)處理啤酒廢水的長期運行進行了考察,結果表明該電池堆的開路電壓為 23.0V,最高功率密度為 4.1W/m3(0.7A/m3)。經過長時間的運行,對電池堆的性能進行了電化學測試,其性能下降的原因在于陰極而不是陽極,對陰極處理后其產電功率迅速的到了恢復,為MFCs的放大提供了一定的理論基礎。不論哪種形式的裝置,串并聯電路時,往往單個電池的性能決定著電池堆的工作性能,電池內阻的差異是導致反極現象的主要因素,對于不同內阻的 MFC分組連接,可減少由MFC內阻差異而導致電能輸出的下降[37]。
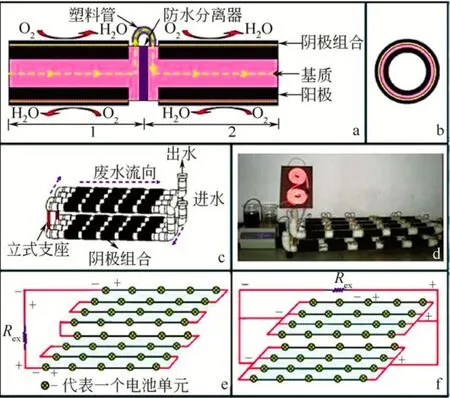
圖5 蛇形式微生物燃料電池堆
在中試研究方面,昆士蘭大學 Keller、Rabaey與福斯特(Foster)啤酒廠合作,建成了世界上第一個中試規模的MFC(圖6),該MFC為單室,由12個模塊構成,每個高3m,總容積大約1m3,其中陽極采用碳纖維刷,陰極采用石墨纖維刷,陽極置于裝置的內部,陰極包裹于裝置的外部,利用啤酒廢水發電,可承受的有機負荷為10gCOD/ (L?d)。另外,美國賓州州立大學的研究人員[43]在納帕(Napa)葡萄酒公司構建了一個MEC裝置(圖7),該裝置采用浸泡的碳刷陽極和不銹鋼陰極,共有24個模塊,每個模塊有6個電極,總體積約為1m3,其裝置的性能仍在研究中。在國內,中國海洋大學的付玉彬等[44]構建了海洋沉積物微生物燃料電池,利用串并聯升壓的方式,在膠州灣淺海成功驅動小型電子裝置的運行。

圖6 管狀微生物燃料電池中試裝置(www.m icrobialfuelcell.org)
2 微生物燃料電池的應用
2.1 廢水處理

圖7 微生物電解電池的中試裝置
利用微生物燃料電池處理廢水可以實現廢水到電能的一步轉化,在處理廢水的同時使廢水資源化。結合微生物燃料電池的原理和廢水中的污染物成分,包括單室和雙室微生物燃料電池廢水處理,而雙室 MFC又分為陽極室廢水處理、陰極室廢水處理以及中間室廢水處理。
大部分廢水處理的研究是在陽極室中進行的,廢水中所含的有機物主要是以碳源和電子供體的形式被陽極微生物所利用,其總能量的消耗途徑主要包括未被氧化的能量、微生物的合成與代謝、陰極的活化電勢、電阻和擴散消耗以及陰極再生,整個陽極系統有20%~30%被轉化為電能,如圖8所示。廢水中有機物是否可生化降解是MFC處理廢水的關鍵,因為其直接影響著能量的轉換,目前,在MFC陽極處理的有機物主要包括易生物降解的廢水,例如市政污水[45]、食品加工廢水[46]、釀酒廢水[47]等;對于難降解的有機污染物,需要添加易降解的有機物作為共基質,即在共代謝的條件下被有效降解。另外,含硫廢水中的硫離子也可在 MFC陽極中作為電子供體被產電微生物所利用[48]。
在MFC陰極室,無氧氣存在時,高氧化還原電勢的物質在陰極表面得到電子發生還原反應,如果采用某種污染物作為電子受體,則該污染物接受電子被還原為無污染或低毒性的物質,該過程可以直接接受陰極電子發生還原反應,如硝基苯廢水[50]、染料廢水[51]等;也可在微生物的作用下發生間接還原,即利用微生物作為生物催化劑構建生物陰極,這些微生物利用陰極作為電子供體而利用污染物作為電子受體,從而達到在新陳代謝的過程中還原污染物而獲得ATP,該原理通常用來處理較難被還原的污染物,改變其溶解性、毒性、放射性等,如含氮廢水[52]、氯代烴廢水[53]和重金屬廢水[54]等。對于含氮廢水,也可以通過好氧陰極來實現,一部分氧用作電子受體,另一部分用于含氮廢水的好氧降解,此外,陰陽兩室可以協同作用來降解污染物。
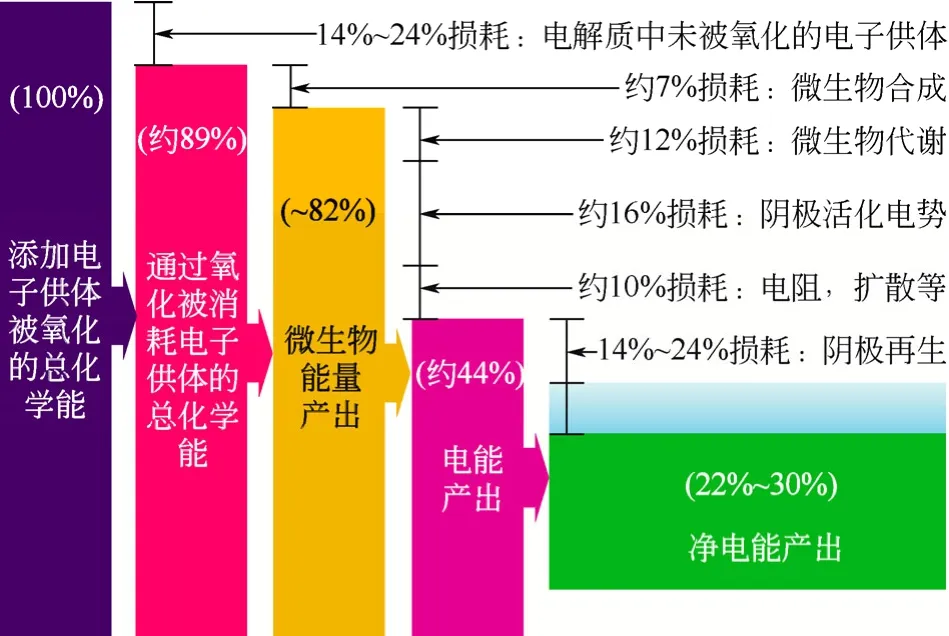
圖8 外阻為200Ω,Ag2O/Ag陰極微生物燃料電池的能量回收
中間室是指雙室MFC陰陽兩極室加入一組陽、陰離子交換膜,這兩種膜之間形成空間,所形成的電池也稱為微生物脫鹽電池。該電池中間室主要用于含鹽廢水的凈化,如苦咸水、海水等[55],也可結合廢水處理和產氫實現多重功能[56],因此,MFC中間室在鹽水淡化的處理上有著廣闊的應用前景。
2.2 微生物電合成
近幾年,在微生物燃料電池領域的研究熱點已經從生物產電轉變為制備化學品,使陽極釋放的能量能夠以化學品的形式在陰極儲存,目前,在微生物電合成方面,所產物質主要包括氫氣、H2O2以及低分子有機物。
2.2.1 制氫
用于產氫的微生物燃料電池通常被稱為微生物電解電池(MEC),是微生物燃料電池領域的一個重要方向,其優勢在于比發酵產生的氫更多,而且能把氫氣儲存起來,彌補了微生物燃料電池產電功率密度低的缺點,因此,微生物電解電池有著廣闊的應用前景。
目前,MEC同 MFC一樣,在改進反應器結構[57]、低成本高效陰極的開發[58]的同時,對反應器的放大也進行了研究,Heidrich等[59]構建了一個120L的微生物電解電池,利用生活污水產氫,每個周期運行3個月,其COD的容積負荷和能耗分別為0.14kg/(m3?d)和2.3KJ/(gCOD),較低于活性污泥的COD容積負荷和能耗,反應器每天產生0.015L的氫氣,庫侖效率為55%。Yu等[60]設計了一個3.7L裝有膜電極的微生物電解電池,并對其性能進行了考察,在電壓為1.2V,乙酸鈉作為有機物,其反應器氫氣產生速率為0.12m3/(m3?d)。Gil-Carrera等[61]利用一個中試微生物電解電池處理低濃度生活污水,在能耗較低[1.6kW?h/(kgCOD)]的情況下,COD的濃度可下降85%,氫氣的產量與有機物的降解量及陰極的性能有關。雖然,較多的研究人員投入于MEC的中試研究,但是MEC用于工業化還比較遠,仍需進一步對其影響因素和運行特性進行探索。
2.2.2 制備H2O2及合成Fenton試劑
H2O2是一種重要的化工原料,但目前工業生產存在能耗高的缺點。利用微生物燃料電池制備H2O2,是基于微生物在陽極室氧化廢水中的有機物,在陰極通過溶解氧的不完全反應產生,是一種低成本的生產方法。Rozendal等[62]對生物電化學系統陽極降解廢水中有機物,陰極產生 H2O2進行了研究,結果表明在工作電壓0.5V下,H2O2的濃度為 0.13%時,系統的產出能力為(1.9±0.2)kgH2O2/ (m3?d),所需能源大部分源于乙酸鹽,能耗需求低。如果這個過程能在工業上應用,H2O2的質量分數需要提高到 2%~3%。此外,在陰極原位合成 H2O2的同時,若加入Fe2+即形成了Fenton試劑,可用于處理難生化降解廢水。Fu等[63]研究了產 H2O2的MFC與原位Fenton反應結合降解偶氮燃料進行了研究,體系消耗1mmolFe2+時,對于傳統 MFC的Fenton系統,1h內染料的降解比例為82.5%;對于電化學MFC的Fenton系統,添加0.5mmolFe3+時,染料的降解比例達到76.43%,陰極電勢可保持1h,最大功率密度為28.3W/m3,該研究為難生物降解廢水綠色可持續處理同時產電提供了一條新途徑。Li等[64]考察了利用黃鐵礦作為陰極 Fenton催化劑對垃圾滲濾液中難降解有機物的去除效果,結果表明,黃鐵礦涂覆石墨陰極其最大功率密度為4.2W/m3,比單純石墨陰極高 133%;垃圾滲濾液的色度和COD去除率為77%和78%。Zhu等[65]利用MFC作為電Fenton反應器的能量來源處理有機污染物,結果表明在一個循環(22h),系統中總有機碳的去除75%±2%,苯酚被轉化為可生化降解的有機酸,該系統對工業廢水中特定污染物的處理是節能且低成本的。若能利用微生物燃料電池合成雙氧水或Fenton試劑,有機地結合到廢水處理工藝中,將會使微生物燃料電池更具發展前景。
2.2.3 合成生物化學品
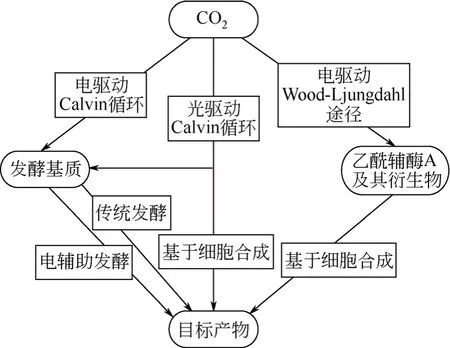
圖9 生物化學品的生產途徑[67]
微生物電化學合成是將電流作為微生物催化還原或氧化能量的來源,對CO2進行固定,轉換成燃料或生物化學品的一種新技術[66]。目前,相關生物化學品的制備途徑如圖9所示[67],目標產物是通過陽光和CO2來合成或工業發酵獲得,也可通過利用電能固定二氧化碳直接生產或引起乙酰輔酶A和它的衍生物的形成,進一步合成所需產物。相關研究表明,在生物陰極MFC中,利用陽極降解有機物提供電子,而生物陰極合成有價值的生物化學品,如乙醇[68]、2,3-丁二醇[69]、甲烷[70]以及乙酸鹽[71]等,其合成的過程經濟高效,完全可以用于新興的生物合成工業中。
2.3 微生物傳感器
生物傳感器是指能提供定量或者半定量分析的一種裝置,包括生物識別元素和信號傳輸放大元素。由于微生物燃料電池的電流(電壓)或電子庫侖量與電子供體的含量之間存在對應關系,因此微生物燃料電池能用于某些底物含量的測定,如有機碳[72]、廢水 BOD[73]以及有毒物質[74]等,其中用于廢水中 BOD 測定的研究最為成熟,已有相關報道[75]。
微生物傳感器的輸出和輸入信號之間在一定范圍內存在良好的相關性,因此,適用于成分多樣且不確定的廢水水質,對MFC應用領域的擴大具有重要意義。
3 結 語
MFC能夠利用廢水及廢棄物等生物質資源作為能源,降解污染物的同時產生電能,在環境保護和新能源開發的大力推動下,MFC具有巨大的產業化前景。將來還需從下面幾個方向努力。
(1)在MFC中菌種方面,從極端環境中(如深海底泥、高溫環境等)篩選耐受能力強的產電菌,進一步研究產電菌電子的產生、傳遞機理,微生物群落的多樣性及其演替規律,對高效產電微生物進行基因改造等。
(2)優化MFC的結構、電極材料和運行方式等,尤其是空氣陰極以及生物陰極方面,以使其能應用于實際生產中。
(3)微生物電化學合成是近兩年微生物燃料電池新的發展方向,有待于進一步深入研究。
[1] Zhang F,Saito T,Cheng S,et al.M icrobial fuel cell cathodes w ith poly (dimethylsiloxane) diffusion layers constructed around stainless steel mesh current collectors[J].Environmental Science & Technology,2010,44(4):1490-1495.
[2] 周良,劉志丹,連靜,等.利用微生物燃料電池研究 geobacter metallireducens異化還原鐵氧化物[J].化工學報,2005,56(12):2398-2403.
[3] Liu Z,Du Z,Lian J,et al.Improving energy accumulation of m icrobial fuel cells by metabolism regulation using Rhodoferax ferrireducens as biocatalyst[J].Letters in Applied M icrobiology, 2007,44(4):393-398.
[4] 鄧麗芳,李芳柏,周順桂,等.克雷伯氏菌燃料電池的電子穿梭機制研究[J].科學通報,2009(19):2983-2987.
[5] Luo J,Yang J,He H,et al.A new electrochem ically active bacterium phylogenetically related totolumonas osonensis and power performance in MFCs[J].Bioresource Technology,2013,139:141-148.
[6] Lovley D R,Stolz J F,Nord G L,et al.Anaerobic production of magnetite by a dissim ilatory iron-reducing m icroorganism[J].Nature,1987,330(6145):252-254.
[7] Reguera G,M cCarthy K D,Mehta T,et al.Extracellular electron transfer via m icrobial nanow ires[J].Nature,2005,435(7045):1098-1101.
[8] Reguera G,Nevin K P,Nicoll J S,et al.Biofilm and nanow ire production leads to increased current in geobacter sulfurreducens fuel cells[J].Appl.Environ.Microbiol.,2006,72(11):7345-7348.
[9] Ntarlagiannis D,Atekwana E A,Hill E A,et al.M icrobial nanow ires:Is the subsurface “hardwired”[J].Geophysical Research Letters,2007,34(17):L17035.
[10] 許杰龍,周順桂,袁勇,等.有“生命”的電線:淺析微生物納米導線電子傳遞機制及其應用[J].化學進展,2012(9):1794-1800.
[11] Li C,Ding L,Cui H,et al.Application of conductive polymers in biocathode of m icrobial fuel cells and m icrobial community[J].Bioresource Technology,2012,116:459-465.
[12] Rubaba O,Araki Y,Yamamoto S,et al.Electricity producing property and bacterial community structure in m icrobial fuel cell equipped w ith membrane electrode assembly[J].Journal of Bioscience and Bioengineering,2013,116(1):106-113.
[13] Liu X W,Sun X F,Huang Y X,et al.Nano-structured manganese oxide as a cathodic catalyst for enhanced oxygen reduction in a microbial fuel cell fed w ith a synthetic wastewater[J].Water Research,2010,44(18):5298-5305.
[14] Roche I,Katuri K,Scott K.A microbial fuel cell using manganese oxide oxygen reduction catalysts[J].Journal of Applied Electrochemistry,2010,40(1):13-21.
[15] Lu A,Li Y,Jin S,et al.Microbial fuel cell equipped with a photocatalytic rutile-coated cathode[J].Energy & Fuels,2009,24(2):1184-1190.
[16] Wang P,Lai B,Li H,et al.Deposition of Fe on graphite felt by thermal decomposition of Fe(CO)5for effective cathodic preparation of m icrobial fuel cells[J].Bioresource Technology,2013,134:30-35.
[17] HaoYu E,Cheng S,Scott K,et al.M icrobial fuel cell performance w ith non-Pt cathode catalysts[J].Journal of Power Sources,2007,171(2):275-281.
[18] Zhou M,Chi M,Luo J,et al.An overview of electrode materials in m icrobial fuel cells[J].Journal of Power Sources,2011,196(10):4427-4435.
[19] Yuan Y,Zhou S,Zhuang L.Polypyrrole/carbon black composite as a novel oxygen reduction catalyst for m icrobial fuel cells[J].Journal of Power Sources,2010,195(11):3490-3493.
[20] Yuan Y, Ahmed J, Kim S.Polyaniline/carbon black composite-supported iron phthalocyanine as an oxygen reduction catalyst for m icrobial fuel cells[J].Journal of Power Sources,2011,196(3):1103-1106.
[21] Fu L,You S J,Zhang G Q,et al.Pb/pani-modified electrode used as a novel oxygen reduction cathode in m icrobial fuel cell[J].Biosensors and Bioelectronics,2011,26(5):1975-1979.
[22] Lai B,Wang P,Li H,et al.Calcined polyaniline-iron composite as a high efficient cathodic catalyst in m icrobial fuel cells[J].Bioresource Technology,2013,131:321-324.
[23] 李少華,杜竹瑋,祝學遠,等.Rhodoferax ferrireducens微生物燃料電池中釩化合物的催化性能[J].過程工程學報,2007(3):589-593.
[24] M yers C R,M yers J M.Localization of cytochromes to the outer membrane of anaerobically grown shewanella putrefaciens MR-1[J].Journal of Bacteriology,1992,174(11):3429-3438.
[25] Lies D P,Hernandez M E,Kappler A,et al.Shewanella oneidensis MR-1 uses overlapping pathways for iron reduction at a distance and by direct contact under conditions relevant for biofilms[J].Appl.Environ.Microbiol.,2005,71(8):4414-4426.
[26] Cheng S,Logan B E.Ammonia treatment of carbon cloth anodes to enhance power generation of m icrobial fuel cells[J].Electrochemistry Communications,2007,9(3):492-496.
[27] Wang X,Cheng S,Feng Y,et al.Use of carbon mesh anodes and the effect of different pretreatment methods on power production in m icrobial fuel cells[J].Environmental Science & Technology,2009,43(17):6870-6874.
[28] Crittenden S R,Sund C J,Sumner J J.Mediating electron transfer from bacteria to a gold electrode via a self-assembled monolayer[J].Langmuir,2006,22(23):9473-9476.
[29] Tang X,Guo K,Li H,et al.Electrochem ical treatment of graphite to enhance electron transfer from bacteria to electrodes[J].Bioresource Technology,2011,102(3):3558-3560.
[30] Feng C,Ma L,Li F,et al.A polypyrrole/anthraquinone-2,6-disulphonic disodium salt (ppy/aqds)-modified anode to improve performance of m icrobial fuel cells[J].Biosensors and Bioelectronics,2010,25(6):1516-1520.
[31] Li C,Zhang L,Ding L,et al.Effect of conductive polymers coated anode on the performance of m icrobial fuel cells and its biodiversity analysis[J].Biosensors and Bioelectronics,2011,26(10):4169-4176.
[32] Zou Y,Pisciotta J,Baskakov I V.Nanostructured polypyrrole-coated anode for sun-powered m icrobial fuel cells[J].Bioelectrochemistry,2010,79(1):50-56.
[33] A llen R M,Bennetto H P.M icrobial fuel cells[J].Applied Biochemistry and Biotechnology,1993,39(1):27-40.
[34] Lai B,Tang X,Li H,et al.Power production enhancement w ith a polyaniline modified anode in m icrobial fuel cells[J].Biosensors and Bioelectronics,2011,28(1):373-377.
[35] Nandy A,Kumar V,Kundu P P.Utilization of proteinaceous materials for power generation in a mediatorless microbial fuel cell by a new electrogenic bacteria Lysinibacillus sphaericus VA5[J].Enzyme and Microbial Technology,2013,53(5):339-344.
[36] Kim S I,Roh S H.Multiwalled carbon nanotube/polyarcylonitrile composite as anode material for microbial fuel cells application[J].Journal of Nanoscience and Nanotechnology,2010,10(5):3271-3274.
[37] 李頂杰,何輝,盧翠香,等.串/并聯微生物燃料電池的性能[J].過程工程學報,2009(2):338-343.
[38] Aelterman P,Rabaey K,Pham H T,et al.Continuous electricity generation at high voltages and currents using stacked m icrobial fuel cells[J].Environmental Science & Technology,2006,40(10):3388-3394.
[39] Shin S,Choi Y,Na S,et al.Development of bipolar plate stack type m icrobial fuel cells[J].Bulletin-korean Chemical Society,2006,27(2):281.
[40] Rahimnejad M,Ghoreyshi A,Najafpour G,et al.A novel microbial fuel cell stack for continuous production of clean energy[J].International Journal of Hydrogen Energy,2012,37(7):5992-6000.
[41] Oh S E,Logan B.E.Voltage reversal during microbial fuel cell stack operation[J].Journal of Power Sources,2007,167(1):11-17.
[42] Zhuang L,Yuan Y,Wang Y,et al.Long-term evaluation of a 10-liter serpentine-type m icrobial fuel cell stack treating brewery wastewater[J].Bioresource Technology,2012,123:406-412.
[43] Logan B E.Scaling up m icrobial fuel cells and other bioelectrochem ical systems[J].Applied Microbiology and Biotechnology,2010,85(6):1665-1671.
[44] 付玉彬,李建海,趙仲凱,等.海底生物燃料電池作為電源驅動小型電子器件的應用研究[J].中國海洋大學學報:自然科學版,2012(6):93-98.
[45] Navanietha Krishnaraj R,Karthikeyan R,Sheela Berchmans,et al.Functionalization of electrochem ically deposited chitosan films w ith alginate and prussian blue for enhanced performance of microbial fuel cells[J].Electrochimica Acta,2013,112:465-472.
[46] Mansoorian H J,Mahvi A H,Jaafari A J,et al.Bioelectricity generation using two chamber m icrobial fuel cell treating wastewater from food processing[J].Enzyme and Microbial Technology,2013,52(6-7):352-357.
[47] Wen Q,Wu Y,Zhao L,et al.Production of electricity from the treatment of continuous brewery wastewater using a m icrobial fuel cell[J].Fuel,2010,89(7):1381-1385.
[48] Liang F Y,Deng H,Zhao F.Sulfur pollutants treatment using m icrobial fuel cells from perspectives of electrochem istry and m icrobiology[J].Chinese Journal of Analytical Chemistry,2013,41(8):1133-1139.
[49] Xie X,Ye M,Hsu P C,et al.M icrobial battery for efficient energy recovery[J].Proceedings of the National Academy of Sciences,2013,110(40):15925-15930.
[50] Li J,Liu G,Zhang R,et al.Electricity generation by two types of m icrobial fuel cells using nitrobenzene as the anodic or cathodic reactants[J].Bioresource Technology,2010,101(11):4013-4020.
[51] Solanki K,Subramanian S,Basu S.M icrobial fuel cells for azo dye treatment with electricity generation:A review[J].Bioresource Technology,2013,131:564-571.
[52] Zhang X,Zhu F,Chen L,et al.Removal of ammonia nitrogen from wastewater using an aerobic cathode m icrobial fuel cell[J].Bioresource Technology,2013,146:161-168.
[53] Huang L,Chai X,Quan X,et al.Reductive dechlorination and m ineralization of pentachlorophenol in biocathode m icrobial fuel cells[J].Bioresource Technology,2012,111:167-174.
[54] Li Z,Zhang X,Lei L.Electricity production during the treatment of real electroplating wastewater containing Cr6+using microbial fuel cell[J].Process Biochemistry,2008,43(12):1352-1358.
[55] Cao X,Huang X,Liang P,et al.A new method for water desalination using m icrobial desalination cells[J].Environmental Science & Technology,2009,43(18):7148-7152.
[56] Mehanna M,Kiely P D,Call D F,et al.M icrobial electrodialysis cell for simultaneous water desalination and hydrogen gas production[J].Environmental Science & Technology,2010,44(24):9578-9583.
[57] Guo K,Tang X,Du Z,et al.Hydrogen production from acetate in a cathode-on-top single-chamber m icrobial electrolysis cell w ith a m ipor cathode[J].Biochemical Engineering Journal,2010,51(1-2):48-52.
[58] Tenca A,Cusick R D,Schievano A,et al.Evaluation of low cost cathode materials for treatment of industrial and food processing wastewater using m icrobial electrolysis cells[J].International Journal of Hydrogen Energy,2013,38(4):1859-1865.
[59] Heidrich E,Dolfing J,Scott K,et al.Production of hydrogen from domestic wastewater in a pilot-scale m icrobial electrolysis cell[J].Applied Microbiology and Biotechnology,2013,97(15):6979-6989.
[60] Jia Y H,Ryu J H,Kim C H,et al.Enhancing hydrogen production efficiency in m icrobial electrolysis cell w ith membrane electrode assembly cathode[J].Journal of Industrial and Engineering Chemistry,2012,18(2):715-719.
[61] Gil-Carrera L,Escapa A,Moreno R,et al.Reduced energy consumption during low strength domestic wastewater treatment in a sem i-pilot tubular m icrobial electrolysis cell[J].J.Environ Manage,2013,122:1-7.
[62] Rozendal R A,Leone E,Keller J,et al.Efficient hydrogen peroxide generation from organic matter in a bioelectrochemical system[J].Electrochemistry Communications,2009,11(9):1752-1755.
[63] Fu L,You S J,Zhang G Q,et al.Degradation of azo dyes using in-situ fenton reaction incorporated into H2O2-producing microbial fuel cell[J].Chemical Engineering Journal,2010,160(1):164-169.
[64] Li Y,Lu A,Ding H,et al.M icrobial fuel cells using natural pyrrhotite as the cathodic heterogeneous fenton catalyst towards the degradation of biorefractory organics in landfill leachate[J].Electrochemistry Communications,2010,12(7):944-947.
[65] Zhu X,Logan B E.Using single-chamber m icrobial fuel cells as renewable power sources of electro-fenton reactors for organic pollutant treatment[J].Journal of Hazardous materials,2013,252-253:198-203.
[66] Lovley D R,Nevin K P.Electrobiocommodities:Powering m icrobial production of fuels and commodity chem icals from carbon dioxide w ith electricity[J].Current Opinion in Biotechnology,2013,24(3):385-390.
[67] Rabaey K,Girguis P,Nielsen L K.Metabolic and practical considerations on microbial electrosynthesis[J].Current Opinion in Biotechnology,2011,22(3):371-377.
[68] K?pke M,M ihalcea C,Brom ley J C,et al.Fermentative production of ethanol from carbon monoxide[J].Current Opinion in Biotechnology,2011,22(3):320-325.
[69] K?pke M,M ihalcea C,Liew F,et al.2,3-butanediol production by acetogenic bacteria,an alternative route to chem ical synthesis,using industrial waste gas[J].Appl.Environ.Microbiol.,2011,77(15):5467-5475.
[70] Villano M,Aulenta F,Ciucci C,et al.Bioelectrochem ical reduction of CO2to CH4via direct and indirect extracellular electron transfer by a hydrogenophilic methanogenic culture[J].Bioresource Technology,2010,101(9):3085-3090.
[71] Nevin K P,Hensley S A,Franks A E,et al.Electrosynthesis of organic compounds from carbon dioxide is catalyzed by a diversity of acetogenic m icroorganisms[J].Appl.Environ.Microbiol.,2011,77(9):2882-2886.
[72] Peixoto L,M in B,Martins G,et al.In situ m icrobial fuel cell-based biosensor for organic carbon[J].Bioelectrochemistry,2011,81(2):99-103.
[73] Di Lorenzo M,Curtis T P,Head I M,et al.A single-chamber microbial fuel cell as a biosensor for wastewaters[J].Water Research,2009,43(13):3145-3154.
[74] Shen Y,Wang M,Chang I S,et al.Effect of shear rate on the response of m icrobial fuel cell toxicity sensor to Cu (Ⅱ)[J].Bioresource Technology,2013,136:707-710.
[75] 杜竹瑋,佟萌,李少華,等.在線測定樣品中生化需氧量的裝置及方法:中國,101315347[P].2007-05-29.

