擬穴青蟹(Scylla paramamosain)血卵渦鞭蟲病的流行病學分析*
劉 順 戴瑜來 周素明 鄭曉葉 王國良
(寧波大學 應用海洋生物技術教育部重點實驗室 寧波 315211)
血卵渦鞭蟲是一種呈世界范圍分布的能夠感染多種海水甲殼動物的寄生性原蟲(許文軍等,2007a;Hamish,2012)。主要引起甲殼動物肌肉、血淋巴、肝胰腺等液化病變癥狀,可在不同規格階段、不同季節暴發流行(Shields,1994)。Chatton等(1931)首次報道法國綠蟹(Carcinus maenas)感染血卵渦鞭蟲病,此后陸續在美國、加拿大、澳大利亞、法國等地區的藍蟹(Callinectes sapidus)(Newmanet al,1975)、白氏雪蟹(Chionoecetes bairdi)(Meyerset al,1987)、蛛雪蟹(Chionoecetes opilio)(Tayloret al,1995)、挪威龍蝦(Nephrops norvegicus)(Fieldet al,1998)、Necora puber(Wilhelmet al,1996)、遠海梭子蟹(Portunus pelagicus)(Shields,1992)、北方黃道蟹(Cancer borealis)(MacLeanet al,1978)、斑點蝦(Pandalus platyceros)(Johnson,1986)等重要經濟物種中發現該病。國內許文軍等(2007b,2007c,2010)已對鋸緣青蟹(Scylla serrata)、三疣梭子蟹(Portunus trituberculatus)、脊尾白蝦(Exopalaemon carinicauda)感染該病的情況進行相關研究,因其發病率高、流行范圍廣、危害嚴重,已引起業界的廣泛關注。近年來浙江地區擬穴青蟹血卵渦鞭蟲病頻發,嚴重制約青蟹養殖業持續健康發展。國外關于血卵渦鞭蟲病的病原生活史(Appletonet al,1998;Liet al,2011a)、發病規律(Fieldet al,1992;Shieldset al,2005)、傳播、擴散方式等流行病學相關研究已有較詳細的報道(Meyerset al,1996;Liet al,2011b),而國內有關血卵渦鞭蟲病的流行病學研究尚未見報道。為了解血卵渦鞭蟲病發病原因、流行規律及危害情況,作者于 2012年 4—11月對溫州地區養殖擬穴青蟹血卵渦鞭蟲病的流行情況進行了研究,以期為病害的預防和控制提供數據參考和科學依據。
1 材料與方法
1.1 樣品來源
參照 Shields等(2005)的方法,對溫州瑞安閣巷養殖區的5個監測池塘,自2012年4月起分批次采集擬穴青蟹樣本,4—6月和 9—11月每月采集一次,6—9月每半月采集一次。具有典型病癥的擬穴青蟹依發病程度每次采集數量在 0—300只范圍,用于病原體檢測、組織病理觀察和發病率與環境因子相關性分析,正常青蟹采自同一養殖區。
1.2 病原體檢測
用消毒注射器從蟹的血竇中抽取少量血淋巴,取約 15μL于載玻片上,用等量美蘭染色后于光鏡下觀察。并參照施慧等(2008)的方法,進行血卵渦鞭蟲的 PCR檢測。同時進行白斑綜合征病毒檢測和細菌學分析。
1.3 組織樣品制備及觀察
分別取患病青蟹與正常青蟹肝胰腺、心肌、步足肌、鰓等組織,10%海水福爾馬林固定,常規石蠟包埋切片(厚度4—6μm),H&E染色,Olympus顯微鏡下觀察并拍照保存。
1.4 環境因子檢測
由瑞安市水產技術推廣站檢疫與環境檢測實驗室,定期對5個監測池塘的水質進行檢測分析。溫度、pH、鹽度等按常規方法現場檢測,溶解氧、亞硝酸鹽、氨氮等采集水樣后固定并帶回實驗室,按 GB 3097-1997海水水質標準方法測定(中華人民共和國環境保護局,1997)。
日平均氣溫、平均氣壓、降雨量等數據由瑞安市氣象局提供。
1.5 流行病學數據采集
根據溫州市擬穴青蟹養殖的面積、分布等整體情況,分別對溫州地區的瑞安、龍灣、樂清、蒼南四個青蟹養殖主產區在 2010—2012年期間,疑似擬穴青蟹血卵渦鞭蟲病進行實地咨詢、養殖日記收集和問卷調查,主要內容有池塘養殖面積、發病面積、發病癥狀、發病時間、病蟹規格和經濟損失等。共計調查養殖場 36個,池塘 78口,面積 192.1公頃;發放問卷(擬穴青蟹養殖病害發生情況調查表)36份,收回 36份,收集養殖日記66本,受訪人數82人次。對各類采集數據進行統計分析。
1.6 數據統計
運用SPSS13.0軟件對相關數據進行方差分析和相關性分析。
2 結果與分析
2.1 擬穴青蟹血卵渦鞭蟲病的癥狀及組織病理觀察
患病青蟹往往活力差,蟹體瘦弱,體色暗淡,體表發紅,步足關節膜發白、模糊,關節失去彈性,應激反應強,易斷肢,斷肢處有白色液體流出。解剖病蟹發現其體腔充滿乳白色液體,血淋巴由原先清藍色轉變為混濁,乳白色、黃色或橙色,不易凝固,肝胰腺彌散,肌肉液化,鰓往往呈黑褐色(圖1)。

圖1 擬穴青蟹血卵渦鞭蟲病癥狀Fig.1 The symptoms of S.paramamosain infected with Hematodinium sp.
光學顯微鏡下觀察比較正常青蟹組織及患血卵渦鞭蟲病青蟹組織發現,患病青蟹肝臟海綿組織缺失或壓迫性壞死,小動脈擴張,肝小管上皮邊緣彎曲變形、界限模糊并消失,小管內腔水腫增大,細胞核固縮或溶解,管腔間隙充滿大量血卵渦鞭蟲(圖2a,圖2b);步足肌肌纖維排列疏松、間隔增大,往往纖維斷裂、溶解,橫紋消失,呈均質樣變性或壞死,可見血卵渦鞭蟲(圖2c,圖2d);鰓上皮組織變性、壞死,鰓腔擴大,充滿血卵渦鞭蟲(圖2e,圖2f)。
2.2 血卵渦鞭蟲的形態及其檢測
病蟹血淋巴經美蘭染色后,光鏡觀察顯示正常血細胞數目稀少,呈現大量血卵渦鞭蟲。蟲體多為卵圓形,細胞核單核或多核,單核時呈馬蹄形,大小在5—7μm,有些蟲體具有長度不等的鞭毛(圖3)。
從患血卵渦鞭蟲病樣本的血淋巴、肝胰腺、肌肉中提取總DNA后經血卵渦鞭蟲PCR檢測,1.5%瓊脂糖凝膠電泳結果顯示三個組織均為陽性(圖4),即患病蟹的血淋巴、肝胰腺、肌肉都有血卵渦鞭蟲的寄生。樣品中未能檢出白斑綜合癥病毒,約有 70%樣品可分離到細菌,但多少不一且不成優勢,鑒定顯示比較混雜。

圖2 擬穴青蟹血卵渦鞭蟲病的組織病理(400×)Fig.2 Histopathological changes in the organs of S.paramamosain infected with Hematodinium sp.H&E(400×)
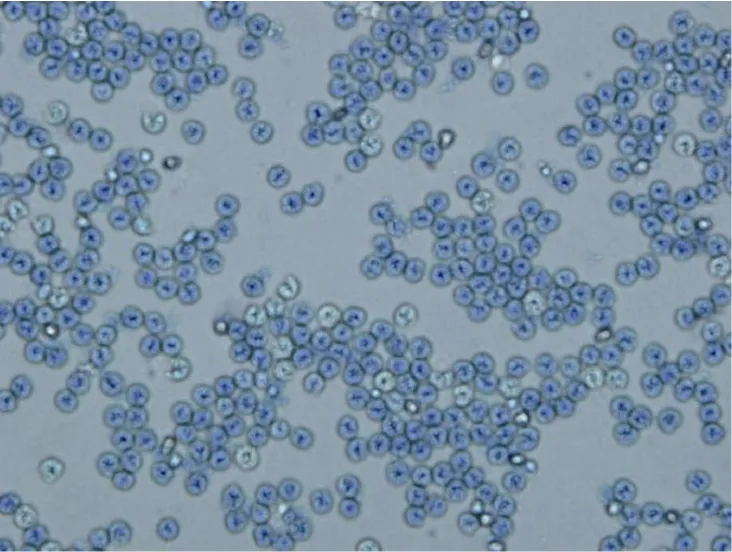
圖3 光學顯微鏡下擬穴青蟹血淋巴中的血卵渦鞭蟲Fig.3 Hematodinium sp.from the hemolymph of S.paramamosain
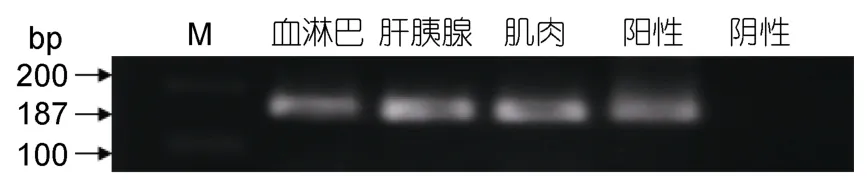
圖4 患病青蟹血淋巴、肝胰腺、肌肉組織PCR檢測Fig.4 The PCR detection of the Hematodinium sp.in hemolymph,hepatopancreas and muscle of the disease crab
2.3 擬穴青蟹血卵渦鞭蟲病的流行病學特征
2.3.1 時空分布 對溫州瑞安閣巷5個監測池塘進行跟蹤檢測,以血卵渦鞭蟲病發生的發病初期、死亡高峰期、發病末期三個時段,統計分析每月各發病時段的概率(圖5)。結果顯示,擬穴青蟹血卵渦鞭蟲病的發病初期主要集中在7月份,40%的概率;死亡高峰期則在7月底至9月中旬之間,概率均為33.33%;而發病末期則在9月下旬后,概率為46.66%。這與現場走訪調查時青蟹養殖戶所提供的資料基本吻合。
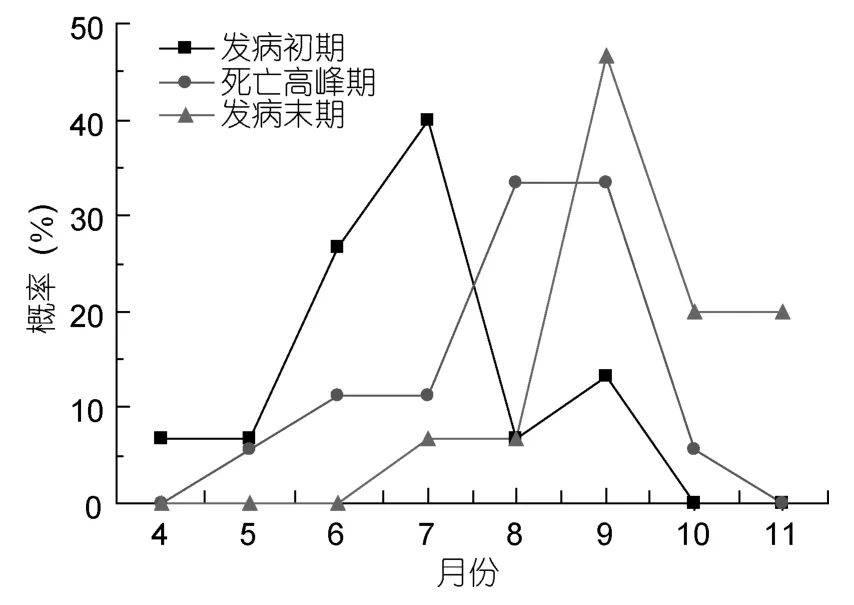
圖5 擬穴青蟹每月各發病時段的概率趨勢圖Fig.5 The probability trends of S.paramamosain infected with Hematodinium sp.in each month
依據 2010—2012年間的調查統計數據,溫州地區養殖擬穴青蟹各月的發病情況變化較大,發病率最高可達 100%。為使發病率數據接近正態分布,因此對發病率作反正弦轉換(根據統計《擬穴青蟹養殖病害發生情況調查表》中的數據,發病率 = 擬穴青蟹養殖監測地區的發病面積 / 養殖監測總面積)。
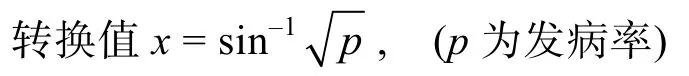
根據轉換值再作方差分析,了解擬穴青蟹發病與年月的關系(表1)。
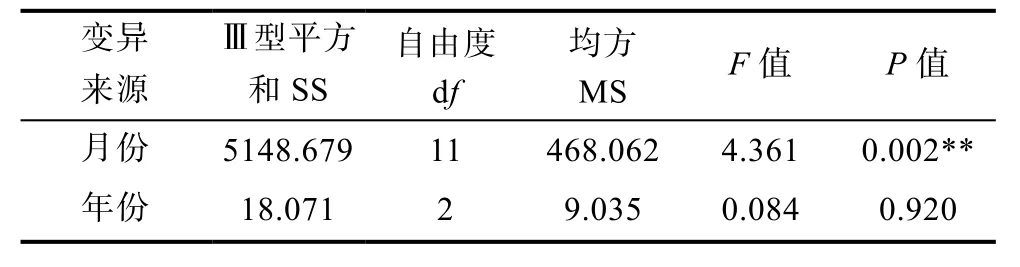
表1 擬穴青蟹血卵渦鞭蟲病發病率的方差分析Tab.1 Variance analysis of S.paramamosain infected withHematodinium sp.in different time
由表1可知,不同的月份(P<0.01)對溫州地區養殖擬穴青蟹的發病率有極顯著影響,而不同的年份(P>0.05)對擬穴青蟹的發病率無顯著影響。進一步的多重比較表明,發病率最高的是9月份,其次是6—8月份,這與上述發病時段的概率趨勢基本一致。
2.3.2 發病與齡期和規格的關系 擬穴青蟹發病與齡期的關系見表2。由表2可知,擬穴青蟹在幼年期和成年期發病的概率相近,分別為0.476和0.524。表明擬穴青蟹血卵渦鞭蟲病在整個生長周期內均會發生。統計擬穴青蟹在放苗半個月、脫殼期和繁殖時期中的發病概率,結果均較相近,脫殼期發病率略高于其它時期(圖6)。擬穴青蟹發病與規格的關系見圖7,規格在小于50g和250g以上的青蟹,血卵渦鞭蟲病發病率較高。
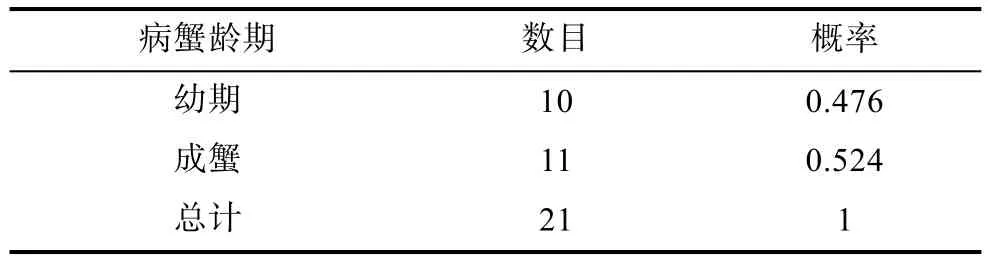
表2 擬穴青蟹血卵渦鞭蟲病發病齡期Tab.2 The probability of S.paramamosain in different life stages due to Hematodinium sp.infection
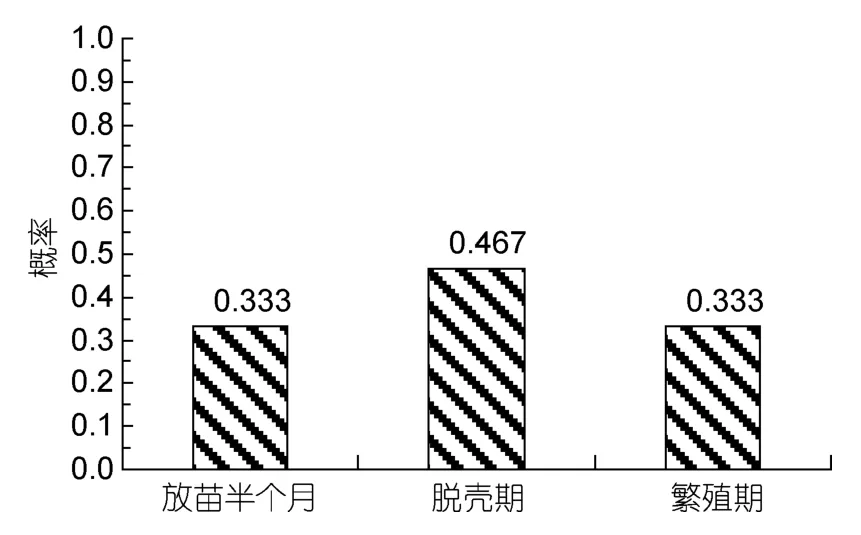
圖6 特殊時期發病概率Fig.6 Probability of outbreak in the special life stages
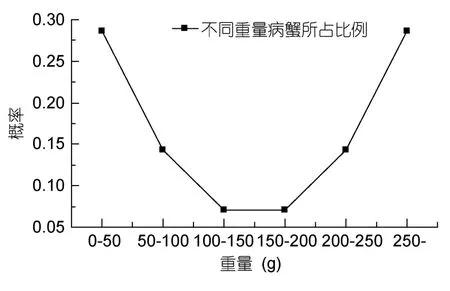
圖7 擬穴青蟹規格與血卵渦鞭蟲病發病率的關系Fig.7 Correlation between size of S.paramamosain and morbidity of Hematodinium sp.
2.4 擬穴青蟹血卵渦鞭蟲病發生與環境因子間的關系
2.4.1 發病與氣象因子 運用SPSS軟件對氣象數據與發病率作相關性分析,結果見表3所示。月平均氣溫及月降水量對擬穴青蟹發病率的影響均有高度顯著的線性關系,月平均氣壓與月平均風速則無顯著影響。考慮到月平均氣溫和降水量對擬穴青蟹發病率的非線性效應,把月平均氣溫、月降水量分成5個等級(表4),進一步對這些氣象因子對發病率的影響進行方差分析(表5),結果顯示月平均氣溫及月降水量對發病率的影響顯著。
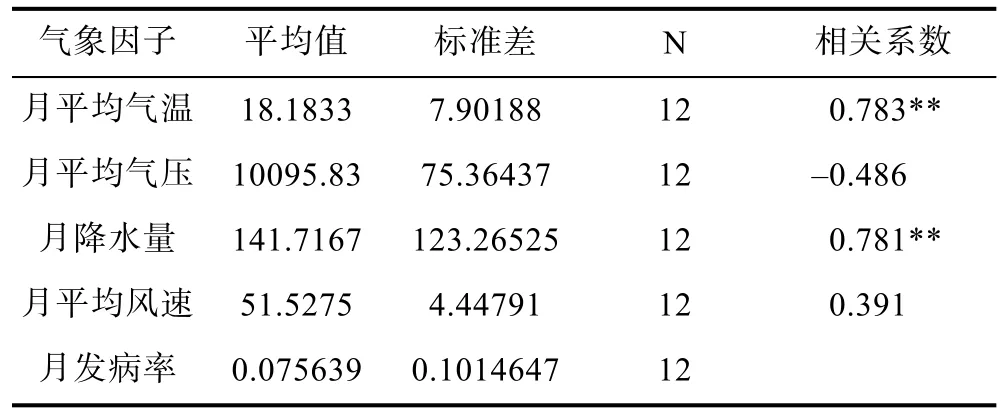
表3 擬穴青蟹發病率與氣象因子的相關系數Tab.3 Correlation between morbidity of S.paramamosain and meteorological factors
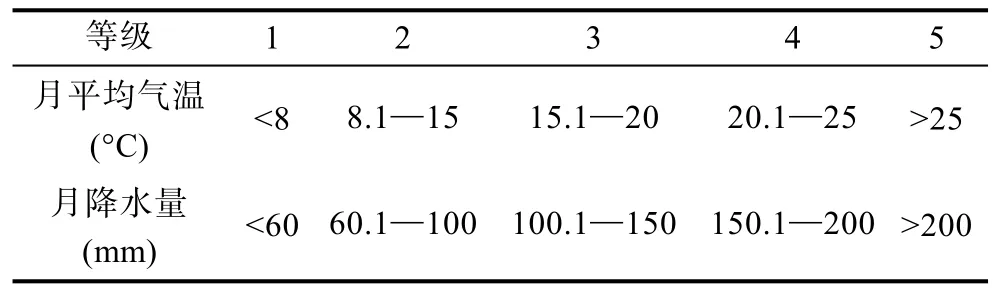
表4 各氣象因子的等級Tab.4 The grades of meteorological factors
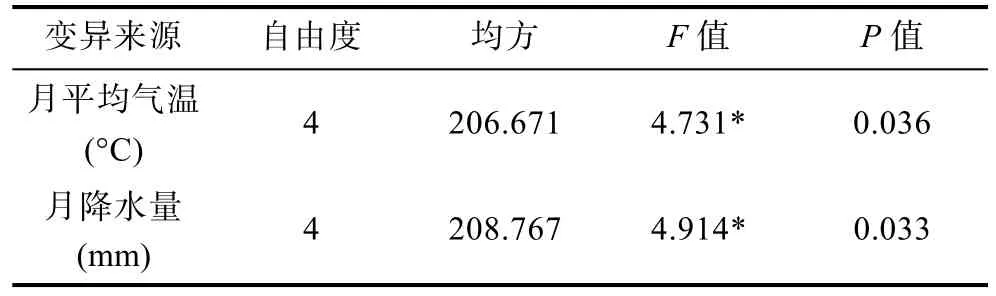
表5 氣象因子對發病率影響的方差分析Tab.5 Variance analysis of the effects of meteorological factors on the crab disease due to Hematodinium sp.infection
2.4.2 發病與養殖水體環境因子 對溫州瑞安閣巷養殖區監測點 5個池塘水體環境因子分析結果顯示,該地區不同時期的pH、DO、鹽度的變化都有極顯著差異(P<0.01),而不同池塘之間的 pH、DO、鹽度則都無顯著差異(P>0.05);不同時期含量變化無顯著差異(P>0.05),不同池塘的和含量變化也無顯著差異(P>0.05)(表6)。
擬穴青蟹血卵渦鞭蟲病發生與瑞安閣巷養殖水體理化因子的檢測結果顯示,水溫、鹽度的變化趨勢與發病率的變化趨勢相近,水溫(r= 0.756)、鹽度(r=0.631)的變化與擬穴青蟹血卵渦鞭蟲病的發生具有相關性(圖8,圖9)。而 DO、pH、、、透明度等各項指標與發病率的變化趨勢沒有明顯相關性。
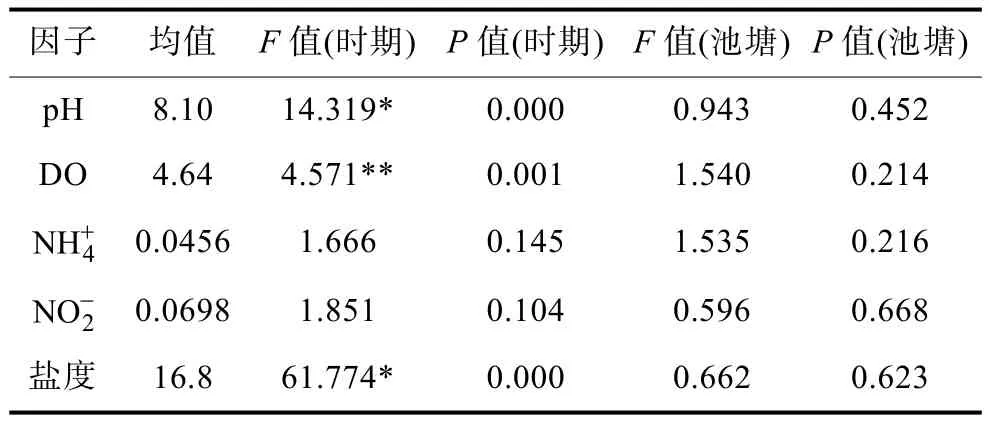
表6 環境因子方差分析Tab.6 Analysis of variance for the environmental factors
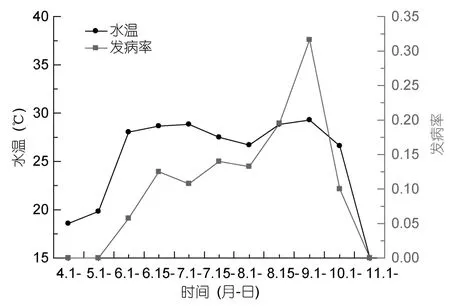
圖8 水溫與發病率的關系Fig.8 Correlation between the water temperature and morbidity
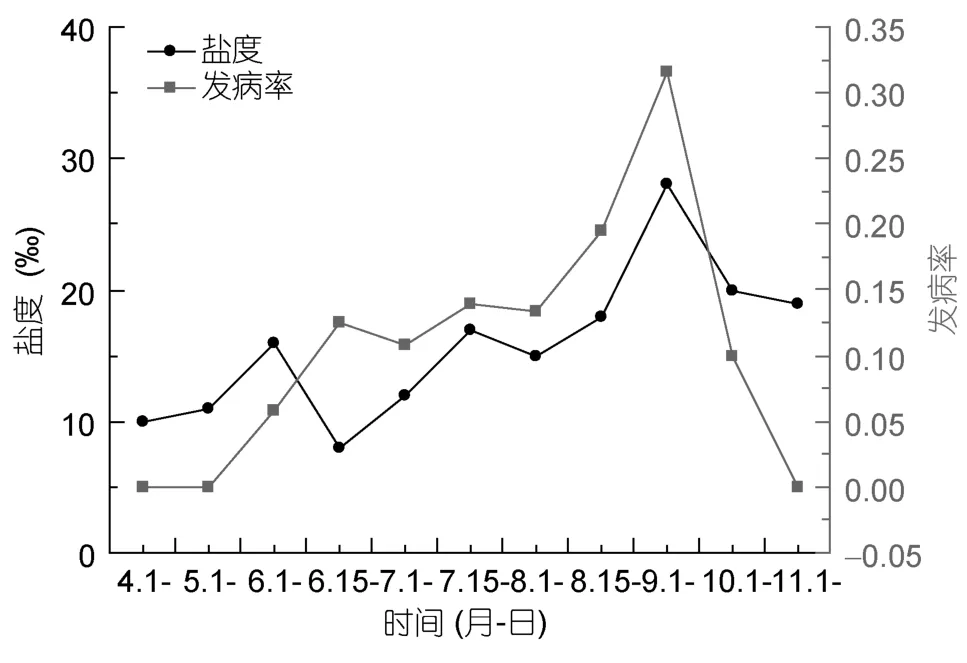
圖9 鹽度與發病率的關系Fig.9 Correlation between the salinity and morbidity
3 討論
擬穴青蟹血卵渦鞭蟲病的病癥特點是活力差,體色暗淡,步足關節失去彈性,易斷肢,血淋巴由正常的清澈顯微藍轉變為淡黃色或乳濁色,呈不能凝固的變性液體,肝胰腺模糊呈彌散狀,有些病蟹鰓呈土黃色或深褐色,與已報道的青蟹黃水病較相似(丁小豐等,2011)。但不同的是擬穴青蟹血卵渦鞭蟲病的肝胰腺、肌肉、鰓等組織病理顯示有大量血卵渦鞭蟲侵染,采用特異性引物的 PCR方法能檢出血卵渦鞭蟲,與許文軍等(2007b)、施慧等(2008)的研究結果相同。然而有報道認為青蟹黃水病是由環境影響造成(韓新全,2005),作者結合流行病學研究結果,認為擬穴青蟹養殖中環境因子變化是引起病害的誘發因素,血卵渦鞭蟲可能是主要的繼發性感染病原體,與Taylor等(1995)的報道相似。
溫州地區擬穴青蟹血卵渦鞭蟲病發病期為每年的5—11月,高峰期為9月份,而6—7月也有一定程度的發病率。統計數據表明,年份間與發病率無相關性,但不同月份對病害的發生有極顯著影響。每年 9月份及 6—7月份正值臺風多發季節和梅雨季節,該段時期水溫較高、晝夜溫差大,受梅雨與臺風影響出現降雨多、降水量大,極易造成養殖水體環境突變,引起擬穴青蟹較強烈的應激反應,容易遭受病原體的侵染而發生病害。氣象因子與發病率的相關性分析,也表明月平均氣溫及月降水量對發病率有影響顯著,水體理化因子檢測分析顯示水溫、鹽度的變化與擬穴青蟹血卵渦鞭蟲病的發生具有顯著相關性,與 Eaton等(1991)、Meyers等(1990)發現白氏雪蟹血卵渦鞭蟲病的流行高峰期在夏、秋季水溫較高時期的報道相似。Messick等(2000)報道低水溫和低鹽度能抑制藍蟹血淋巴中血卵渦鞭蟲的增殖,在水溫低于 15°C時蘭蟹感染率明顯降低,在鹽度低于 11的大西洋海灣未發現感染蟹。Kirk等(2013)也發現鹽度的變化與藍蟹感染血卵渦鞭蟲病密切相關。溫州地區擬穴青蟹血卵渦鞭蟲病發生時期,水溫均高于 20°C,鹽度在 17—29之間,即處于血卵渦鞭蟲適宜感染和增殖的條件。如遇氣候影響,養殖池塘晝夜水溫或水體鹽度驟然變化,擬穴青蟹受應激反應免疫防御能力下降,可引起血卵渦鞭蟲病的發生和暴發流行。因此,養殖漁民應加強防病意識,注重調控水質,預防病害發生。
本研究還進行了擬穴青蟹血卵渦鞭蟲病與各個生長期之間的關系分析。在放苗期、脫殼期、繁殖時期各階段發病情況有所差異但不顯著,其中脫殼期感染發病率較高,Shields等(2000)對藍蟹血卵渦鞭蟲病研究也發現藍蟹在脫殼期感染率更高,Stentiford等(2001)對挪威龍蝦血卵渦鞭蟲病的研究也得到類似結論。這可能與甲殼類在脫殼期對外界環境影響敏感易產生應激反應而免疫功能低下有關。Messick等(2000)報道藍蟹血卵渦鞭蟲病的發病率與蟹體規格關系密切,甲殼寬小于30mm的幼蟹平均發病率高于大規格蟹,而疾病流行與性別關系不大,但本實驗結果反映體重小于50g的幼蟹和大于250g的成蟹發病率均較高,性別差異不明顯,可能與不同蟹類品種和地域差異有關。
丁小豐,王國良,2011.鋸緣青蟹Scylla serrata黃水病血液病理學分析.海洋科學,35(3):64—66
中華人民共和國環境保護局,1997.GB 3097-1997海水水質標準.北京:中國標準出版社,15—21
許文軍,徐漢祥,Shield J等,2007a.海產甲殼類血卵渦鞭蟲病研究進展.中國水產科學,14(4):695—701
許文軍,繩秀珍,徐漢祥等,2007b.血卵渦鞭蟲在養殖鋸緣青蟹中的寄生.中國海洋大學學報,37(6):916—920
許文軍,施 慧,徐漢祥等,2007c.養殖梭子蟹血卵渦鞭蟲感染的初步研究.水生生物學報,31(5):27—31
許文軍,謝建軍,施 慧等,2010.池塘養殖脊尾白蝦(Exopalaemon carinicauda)感染血卵渦鞭蟲的研究.海洋與湖沼,41(3):396—402
施 慧,許文軍,李鵬飛等,2008.應用PCR方法檢測患“黃水病”鋸緣青蟹中的血卵渦鞭蟲.海洋漁業,30:74—79
韓新全,2005.鋸緣青蟹黃水病及并發病的綜合控制措施.科學養魚,(7):56—56
Appleton P L,Vickerman K,1998.In vitro cultivation and developmental cycle in culture of a parasitic dinoflagellate(Hematodiniumsp.) associated with mortality of the Norway lobster(Nephropsnorvegicus) in British waters.Parasitology,116:115—130
Chatton E,Poisson R,1931.Sur I’existence,dans le sang des crabs,de peridiniens parasites:Hematodinium perezin.g.,n.sp.(Syndinidae).CR Sceances Soc Biol Paris,105:553—557
Eaton W D,Love D C,Botelho Cet al,1991.Preliminary results on the seasonality and life cycle of the parasitic dinoflagellate causing Bitter Crab Disease in Alaskan tanner crabs(Chionoecetes bairdi).Invertebr Pathol,57:426—434
Field R H,Chapman C J,Taylor A Cet al,1992.Infection of the Norway lobsterNephrops norvegicusby aHematodiniumlike species of dinoflagellate on the west coast of Scotland.Diseases of Aquatic Organisms,13:1—15
Field R H,Hills J M,Atkinson R J Aet al,1998.Distribution and seasonal prevalence ofHematodiniumsp.infection of the Norway lobster(Nephrops norvegicus) around the west coast of Scotland.ICES J Mar Sci,55:846—858
Hamish J Small,2012.Advances in our understanding of the global diversity and distribution ofHematodiniumspp.——Significant pathogens of commercially exploited crustaceans.Journal of Invertebrate Pathology,110:234—246
Johnson P T,1986.Parasites of benthic amphipods:dinoflagellates(Duboscquodinida:Syndinidae).Fish Bull U S,84:605—614
Kirk J,Parmenter-Patrick A,Vigueira Cet al,2013.Seasonal prevalence ofHematodiniumsp.infections of blue crabs in three south Carolina(USA) rivers.Estuaries and Coasts,36:174—191
Li C,Miller T L,Small H Jet al,2011a.In vitro culture and developmental cycle of the parasitic dinoflagellateHematodiniumsp.from the blue crabCallinectes sapidus.Parasitology,138:1924—1934
Li C,Wheeler K N,Shields J D,2011b.Cannibalism is not an effective route of transmission forHematodiniumsp.in the blue crab,Callinectes sapidus.Disease of Aquatic Organism,96:249—258
MacLean S A,Ruddell C L,1978.Three new crustacean hosts for the parasitic dinoflagellateHematodiniumperezi(Dinoflagellata:Syndinidae).J Parasitol,64:158—160
Messick G A,Shields J D,2000.Epizootiology of the parasitic dinoflagellateHematodiniumsp.in the American blue crabCallinectes sapidus.Dis Aquat Org,43:139—152
Meyers T R,Koeneman T M,Bothelho Cet al,1987.Bitter Crab Disease:a fatal dinoflagellate infection and marketing problem for Alaskan Tanner crabsChionoecetes bairdi.Dis Aquat Org,3:195—216
Meyers T R,Botelho C,Koeneman T Met al,1990.Distribution of bitter crab dinoflagellate syndrome in southeast Alaskan tanner crabs,Chionoecetes bairdi.Dis Aquat Org,9:37—43 Meyers T R,Morado J F,Sparks A Ket al,1996.Distribution of bitter crab syndrome in tanner crabs(Chionoecetes bairdi,C.opilio) from the Gulf of Alaska and the Bering Sea.Diseases of Aquatic Organisms,26:221—227
Newman M W,Johnson C A,1975.A disease of blue crabs(Callinectes sapidus) caused by a parasitic dinoflagellate,Hematodiniumsp.Parasitology,63:554—557
Shields J D,1992.Parasites and symbionts of the crabPortunus pelagicusfrom Moreton Bay,eastern Australia.J Crustac Biol,12:94—100
Shields J D,1994.The parasitic dinoflagellates of marine crustaceans.Annu Rev Fish Dis,4:241—271
Shields J D,Squyars C M,2000.Mortality and hematology of blue crabs,Callinectes sapidus,experimentally infected with the parasitic dinoflagellateHematodinium perezi.Fish Bull,98:139—152
Shields J D,Taylor D M,Sutton S Get al,2005.Epidemiology of bitter crab disease(Hematodiniumsp.) in snow crabsChionoecetes opiliofrom Newfoundland,Canada.Dis Aquat Org,64(3):253—264
Stentiford G D,Neil D M,Atkinson R J A,2001.The relationship ofHematodiniuminfection prevalence in a ScottishNephrops norvegicuspopulation to seasonality,moulting and sex.ICES J Mar Sci,58:814—823
Taylor D M,Khan R A,1995.Observations on the occurrence ofHematodiniumsp.(Dinoflagellata:Syndinidae):the causative agent of Bitter Crab Disease in the Newfoundland snow crab(Chionoecetes opilio).J Invertebr Pathol,65:283—288
Wilhelm G,Mialhe E,1996.Dinoflagellate infection associated with the decline ofNecora pubercrab populations in France.Dis Aquat Org,26:213—219

