寇氏隱甲藻突變株的糖、氮代謝對產(chǎn)油的影響
趙書林 何東平 陳 濤 田 華,3 佘 雋,3 王文翔
(武漢輕工大學(xué)食品科學(xué)學(xué)院1,武漢 430023)
(中國科學(xué)院武漢病毒研究所2,武漢 430060)
(武漢博特爾油脂科技有限公司3,武漢 430040)
寇氏隱甲藻(Crypthecodinium cohnii)是一種海生、無色、異養(yǎng)雙鞭毛甲藻,多生長在腐敗的大型褐藻上,也可在瓊脂板上生長,屬于從原核生物向真核生物的過度類型。目前國內(nèi)外文獻(xiàn)報道寇氏隱甲藻藻體中,產(chǎn)油率高達(dá)10%~15%,DHA質(zhì)量分?jǐn)?shù)高達(dá)35%~40%。2010國家衛(wèi)生部正式批準(zhǔn)由寇氏隱甲藻等藻種經(jīng)生物發(fā)酵、提取、精煉等工藝制取的DHA藻油為新資源食品[1]。利用寇氏隱甲藻高密度發(fā)酵生產(chǎn)富含DHA的油脂,具有很大的經(jīng)濟(jì)效益和社會效應(yīng)[2]。寇氏隱甲藻在生長對數(shù)期之前主要利用碳源和氮源進(jìn)行自身的生長繁殖和油脂積累;生長對數(shù)期之后若沒有及時的碳源補(bǔ)給,寇氏隱甲藻便會分解自身的油脂來提供生存所必需的能量,此時應(yīng)該及時補(bǔ)糖,保證寇氏隱甲藻有充足的碳源來進(jìn)行油脂的積累。De Swaaf等[3]報道當(dāng)發(fā)酵液中葡萄糖質(zhì)量濃度高于25 g/L時,對寇氏隱甲藻的生長速率有抑制作用;在葡糖糖質(zhì)量濃度高達(dá)84.3 g/L時寇氏隱甲藻也能生長;當(dāng)?shù)促|(zhì)量濃度為2 g/L時,寇氏隱甲藻產(chǎn)可以合成更多的 DHA;Wang等[4]、Mendes等[5]研究也指出當(dāng)碳/氮比在15∶1左右時補(bǔ)糖最佳。因此研究發(fā)酵液中的糖、氮代謝過程,可以提高產(chǎn)油率和DHA含量。
1 材料與方法
1.1 藻種
寇氏隱甲藻(Crypthecodinium cohnii突變株2.4K-2A2-5),本實驗室保存[6]。
1.2 培養(yǎng)基
固體培養(yǎng)基:葡萄糖、谷氨酸鈉、碳酸氫鈉、磷酸二氫鉀、碳酸鈣、氯化鈉、硫酸鎂、金屬離子混合液、維生素混合液、瓊脂。
液體培養(yǎng)基:葡萄糖、谷氨酸鈉、碳酸氫鈉、磷酸二氫鉀、碳酸鈣、氯化鈉、硫酸鎂、氯化鉀、金屬離子混合液、維生素混合液。
1.3 試劑
正己烷、鹽酸、硫酸、硼酸、氫氧化鈉、硫酸銅、硫酸鉀、乙酸鋅、酒石酸鉀鈉、亞鐵氰化鉀、甲醇、95%乙醇、亞甲基藍(lán)、甲基紅、纖維素酶(酶活:10~140 U/g),、堿性蛋白酶(酶活:20萬 U/g),試驗所用的試劑均為分析純。
1.4 儀器與設(shè)備
Agilent7890A氣相色譜儀:安捷倫科技(中國)有限公司;SPX-150C恒溫恒濕箱:上海博訊實業(yè)有限公司醫(yī)療設(shè)備廠;SW-CJ-1F單人雙面凈化工作臺:蘇州凈化設(shè)備有限公司;LDZX-75KB立式蒸汽滅菌器:武漢利天科技儀器有限公司;RE-52C旋轉(zhuǎn)蒸發(fā)器:上海亞榮生化儀器廠。
1.5 發(fā)酵條件的討論
對照組和5個補(bǔ)糖的試驗組初始葡萄糖質(zhì)量濃度均為70 g/L,分別記為 A、B、C、D、E、F。A為對照組,B組在24 h時補(bǔ)糖10 g,C組在48 h時補(bǔ)糖10 g,D組在72 h時補(bǔ)糖10 g,E組在96 h時補(bǔ)糖10 g,F(xiàn)組在120 h時補(bǔ)糖10 g。每組試驗隔24 h觀察碳和氮的利用情況,最后收獲藻體提取油脂,測定每組的生物量、產(chǎn)油率、DHA%和DHA產(chǎn)量。
1.6 分析方法
1.6.1 還原糖質(zhì)量濃度的測定[7]
1.6.1.1 樣品預(yù)處理吸取20 mL樣品和20 mL水,置于150 mL錐形瓶中充分混勻,然后取10 mL混合液,繼續(xù)添加3 mL濃度6 mol/L的鹽酸,加入玻璃珠2粒,加熱至沸15~20 min,待充分水解后冷卻至室溫調(diào)pH至7,定容至100 mL的容量瓶,然后過濾到150 mL錐形瓶中,取續(xù)濾液備用。
1.6.1.2 標(biāo)定堿性酒石酸銅溶液
吸取5 mL堿性酒石酸銅甲液與5 mL堿性酒石酸銅乙液,置于150 mL錐形瓶中,加10 mL水,加入玻璃珠2粒,從滴定管滴加約9 mL葡萄糖標(biāo)準(zhǔn)溶液,控制在2 min內(nèi)加熱至沸,趁熱以1滴/2 s的速度繼續(xù)滴加葡萄糖標(biāo)準(zhǔn)溶液,至溶液藍(lán)色剛好褪去為終點,記錄消耗葡萄糖標(biāo)準(zhǔn)溶液的總體積,同時平行操作3份,取平均值,計算每10 mL堿性酒石酸銅溶液相當(dāng)于葡萄糖的質(zhì)量。
1.6.1.3 試樣溶液預(yù)測
吸取5 mL堿性酒石酸銅甲液與5 mL堿性酒石酸銅乙液,置于150 mL錐形瓶中,加10 mL水,加入玻璃珠兩粒,控制在2 min內(nèi)加熱至沸,保持沸騰以先快后慢的速度,從滴定管中滴加試樣溶液,并保持沸騰的狀態(tài),待溶液變淺時,以1滴/2 s的速度滴定,直至溶液藍(lán)色剛好褪去為終點,記錄樣液消耗體積(如果樣品殘?zhí)菨舛绕停上燃尤胍欢康臉?biāo)準(zhǔn)葡萄糖溶液,再滴加試樣溶液滴定至終點)。
1.6.1.4 試樣溶液測定
吸取5 mL堿性酒石酸銅甲液與5 mL堿性酒石酸銅乙液,置于150 mL錐形瓶中,加10 mL水,加入玻璃珠2粒,從滴定管滴加比預(yù)測體積少1 mL的試樣溶液至錐形瓶中,使在2 min內(nèi)加熱至沸,保持沸騰繼續(xù)以1滴/2s的速度滴定,直至溶液藍(lán)色剛好褪去為終點,記錄樣液消耗體積。同法平行操作3份,得出平均消耗體積(如果樣品殘?zhí)菨舛绕停上燃尤胍欢康臉?biāo)準(zhǔn)葡萄糖溶液,再滴加試樣溶液滴定至終點)。
1.6.1.5 計算還原糖含量
試樣中還原糖的質(zhì)量濃度計算:

式中:X為試樣中還原糖的含量/g/L,V1為堿性酒石酸銅溶液消耗的標(biāo)準(zhǔn)葡萄糖的體積/mL;V2為消耗葡萄糖的體積/mL;V為消耗試樣的體積/mL,20為化簡后的系數(shù)/g/L。
1.6.2 氨基酸質(zhì)量濃度的測定[8]
取用4層紗布過濾后的試樣2 mL,加10 mL水,加1滴甲基紅,以0.3 mol/L的硫酸溶液調(diào)制紅色,再以0.1 mol/l的氫氧化鈉溶液調(diào)制橙黃色,再加4 mL的18%中性甲醛,靜置10 min,滴加8滴酚酞試劑,然后用0.1 mol/L的氫氧化鈉溶液滴定,直至溶液顏色剛好為微紅為終點,記錄樣液消耗體積。同法平行操作3份,得出平均消耗體積。
試樣中氨基酸的質(zhì)量濃度計算:
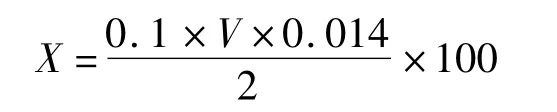
式中:X為試樣中氨基酸的含量/g/L,V是平均消耗的氫氧化鈉體積/mL。
1.7 色譜條件
色譜柱:Agilent SP-2560(100 m×25μm,0.2 μm);升溫程序:100℃保持4 min,以3℃/min升溫至230℃,保持20min,載氣(N2)流速25 mL/min,壓力 2.4 kPa,進(jìn)樣量1μL;分流比 15∶1。
2 結(jié)果與分析
2.1 寇氏隱甲藻突變株對碳、氮利用的變化
寇氏隱甲藻突變株對碳、氮利用的變化如表1。本試驗分別在 0、24、48、72、96、120、144、168 h等時刻測定寇氏隱甲藻突變株對發(fā)酵液中碳、氮的利用情況;A為對照組,B、C、D、E、F為5個不同的補(bǔ)糖試驗組。
首先測定了每組試驗初始葡萄糖和氨基酸質(zhì)量濃度均為67.74 g/L和1.89 g/L,說明用斐林試劑法和甲醛法可以準(zhǔn)確測定寇氏隱甲藻突變株對發(fā)酵液中碳、氮的利用情況。
其次,當(dāng)發(fā)酵至24 h時B組開始補(bǔ)糖10 g,此時測定B組與其他試驗組相比葡萄糖質(zhì)量濃度略有上升,而氨基酸質(zhì)量濃度基本一致;當(dāng)發(fā)酵至48 h時C組開始補(bǔ)糖10 g,此時測定C組葡萄糖質(zhì)量濃度高于A、D、E、F組,但低于B組,每組氨基酸質(zhì)量濃度基本一致;當(dāng)發(fā)酵至72 h時D組開始補(bǔ)糖10 g,此時測定D組葡萄糖質(zhì)量濃度最高,且在48~72 h之間寇氏隱甲藻突變株對糖的利用率最大,每組氨基酸濃度基本一致;當(dāng)發(fā)酵至96 h時E組開始補(bǔ)糖10 g,此時測定E組葡萄糖質(zhì)量濃度最高,A、B、C、D、F組葡萄糖和氨基酸質(zhì)量濃度基本一致;當(dāng)發(fā)酵至120 h時F組開始補(bǔ)糖10 g,此時測定F組葡萄糖質(zhì)量濃度最高,A、B、C、D、E組葡萄糖和氨基酸質(zhì)量濃度基本一致;當(dāng)發(fā)酵144 h以后測定 A、B、C、D、E、F組葡萄糖和氨基酸質(zhì)量濃度基本不變。
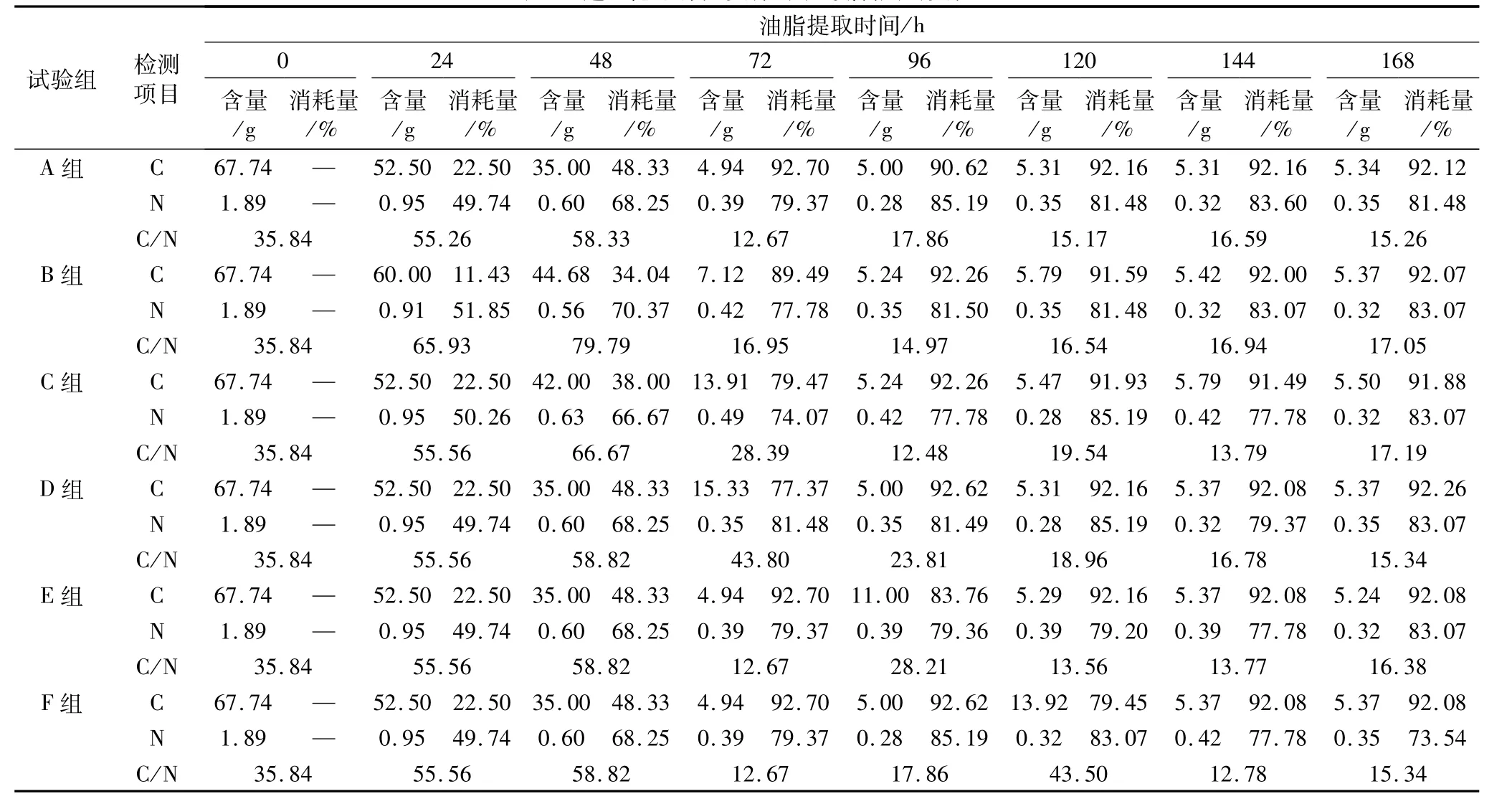
表1 寇氏隱甲藻突變株對碳、氮利用的變化
最后,嘗試在144 h收獲藻體,因為144 h后發(fā)酵液中的碳、氮消耗基本趨于穩(wěn)定,不再被寇氏隱甲藻突變株利用。
2.2 不同時期的補(bǔ)糖對寇氏隱甲藻突變株糖、氮代謝的影響
將對照組和試驗組發(fā)酵培養(yǎng)7 d,每隔24 h觀察碳、氮的利用情況,繪制趨勢圖,如圖1~圖6。
從圖1首先看出對照組A前72 h糖耗為93.0%左右,氮耗為80.0%左右;說明前72 h是寇氏隱甲藻利用營養(yǎng)物質(zhì)的主要時期,72 h后碳源和氮源消耗趨于穩(wěn)定;其次前72 h糖耗的速率先慢后快,而氮耗的速率則是先快后慢[9-10]。當(dāng)168 h收獲時發(fā)酵液中剩余殘?zhí)琴|(zhì)量濃度僅5.34 g/L,氨基酸質(zhì)量濃度為 0.35 g/L,碳氮比約為 15∶1。
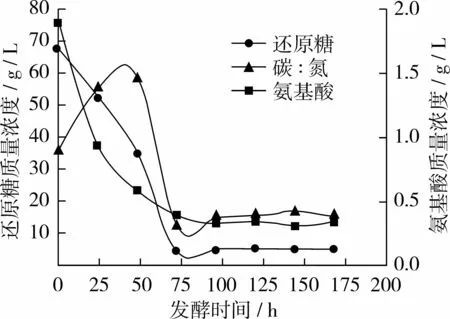
圖1 對照組A碳、氮利用變化曲線
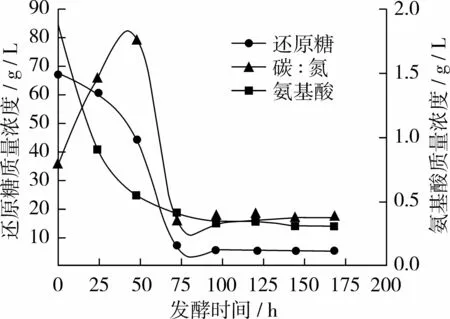
圖2 試驗組B碳、氮利用變化曲線
從圖2看出試驗組B與對照組相比氨基酸質(zhì)量濃度曲線基本不變,還原糖質(zhì)量濃度曲線在24 h時略有上升;96 h后趨于穩(wěn)定,此時糖耗為92.3%左右,氮耗為81.5%左右;當(dāng)168 h放瓶收獲時發(fā)酵液中剩余殘?zhí)琴|(zhì)量濃度僅5.37 g/L,氨基酸質(zhì)量濃度為 0.32 g/L,碳/氮比約為 18∶1。
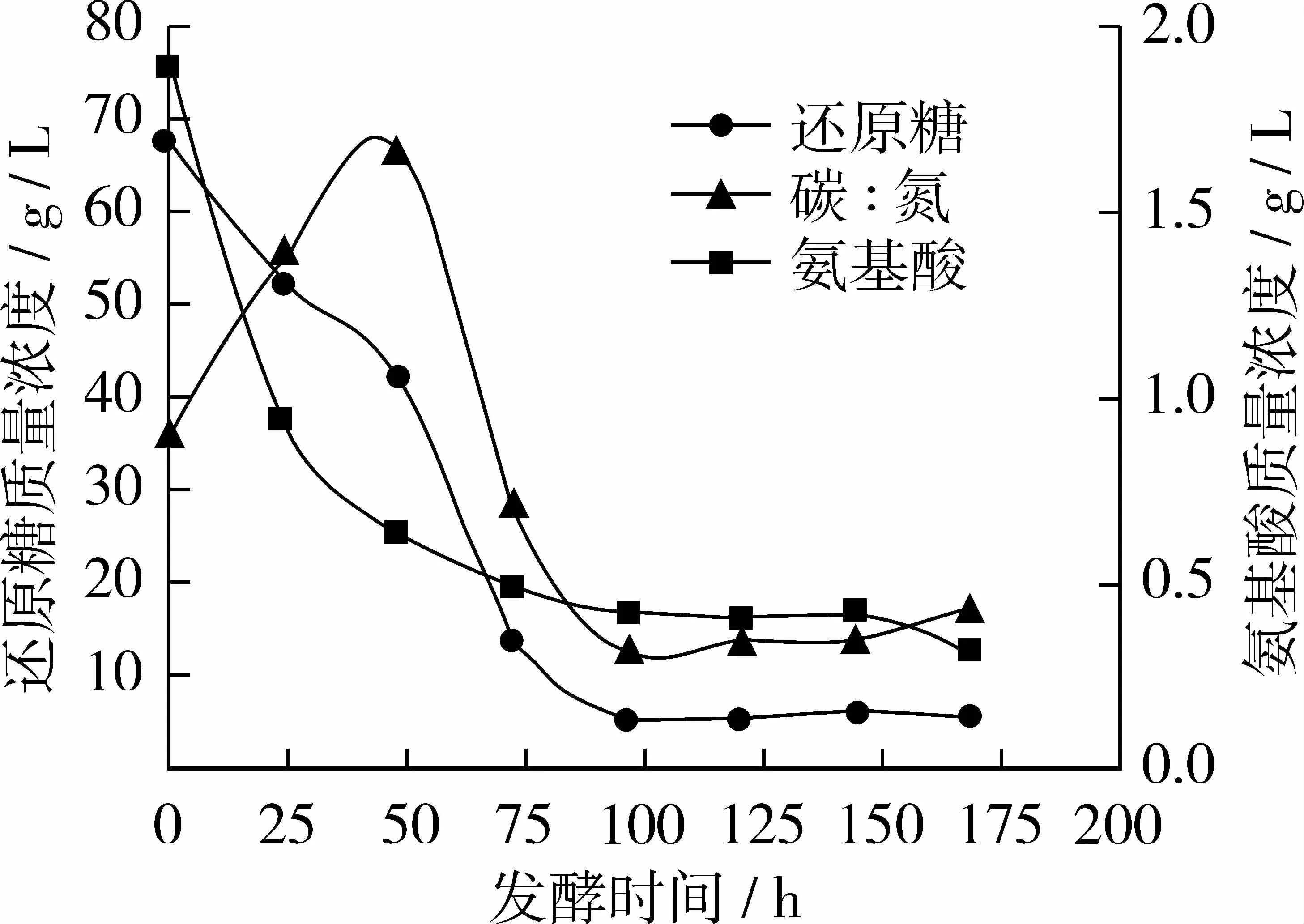
圖3 試驗組C碳、氮利用變化曲線
從圖3看出試驗組C與對照組相比氨基酸質(zhì)量濃度曲線基本不變,還原糖質(zhì)量濃度曲線在48 h時略有上升;96 h后趨于穩(wěn)定,此時糖耗為92.3%左右,氮耗為77.8%左右;當(dāng)168 h放瓶收獲時發(fā)酵液中剩余殘?zhí)琴|(zhì)量濃度僅5.50 g/L,氨基酸質(zhì)量濃度為 0.32 g/L,碳氮比約為 17∶1。
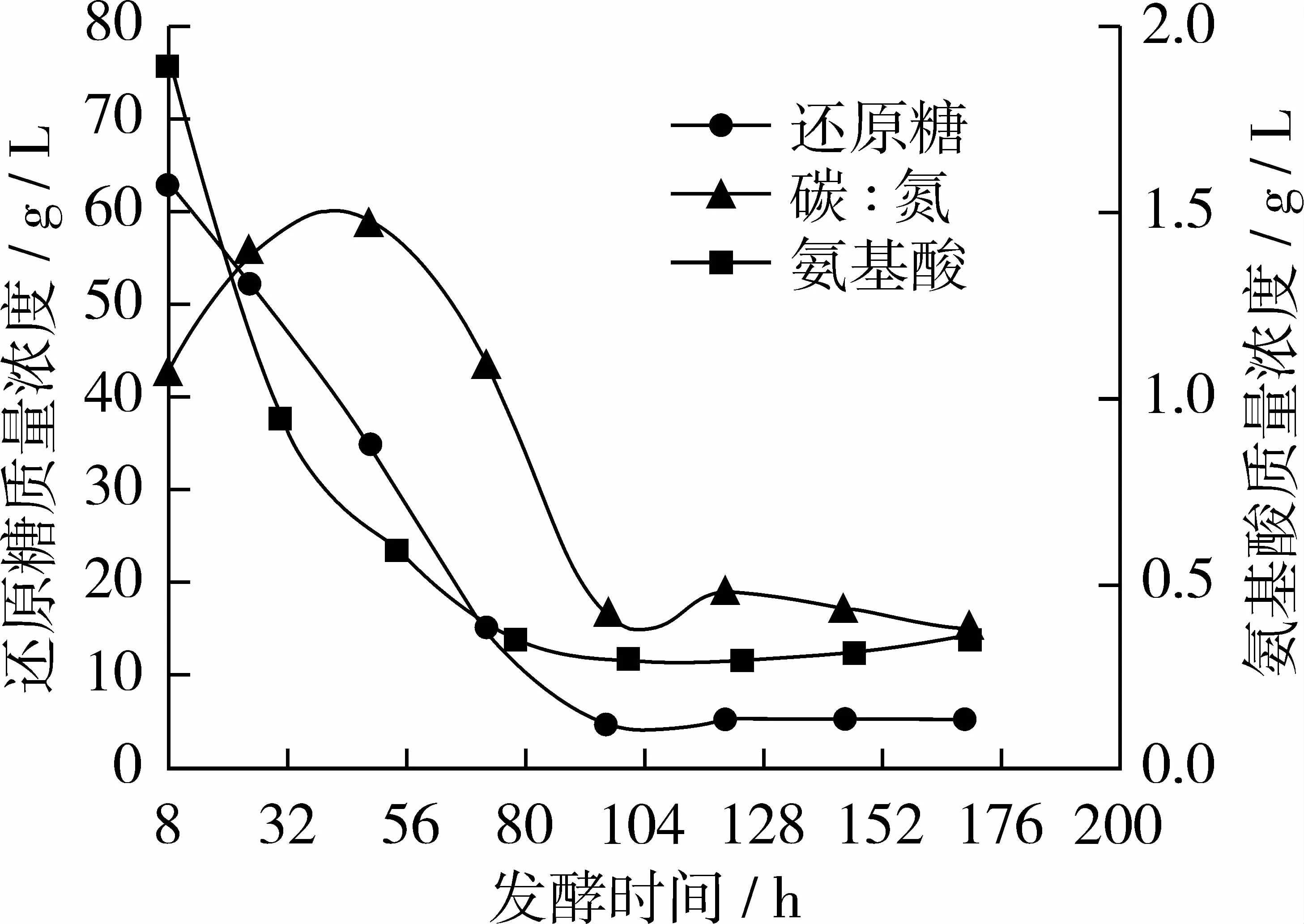
圖4 試驗組D碳、氮利用變化曲線
從圖4看出試驗組D與對照組相比氨基酸質(zhì)量濃度曲線基本不變,還原糖質(zhì)量濃度曲線在72 h時略有上升;96 h后趨于穩(wěn)定,此時糖耗為92.6%左右,氮耗為81.49%左右;當(dāng)168 h放瓶收獲時發(fā)酵液中剩余殘?zhí)琴|(zhì)量濃度僅5.37 g/L,氨基酸質(zhì)量濃度為 0.35 g/L,碳/氮比約為 15∶1。
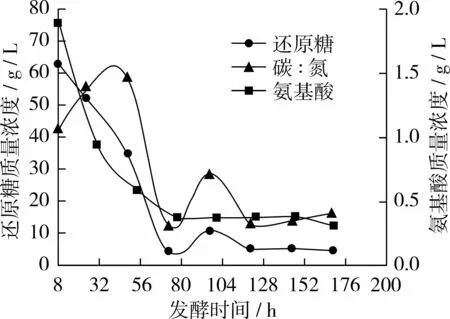
圖5 試驗組E碳、氮利用變化曲線
從圖5看出,試驗組E與對照組相比氨基酸質(zhì)量濃度曲線基本不變,還原糖質(zhì)量濃度曲線在96 h時略有上升;前72 h糖耗為92.7%左右,氮耗為79.4%左右;當(dāng)96 h補(bǔ)10 g時時,發(fā)酵液中殘?zhí)菨舛葹?6.2%左右,氨基酸濃度為20.0%左右;當(dāng)168 h放瓶收獲時發(fā)酵液中剩余殘?zhí)琴|(zhì)量濃度僅5.24 g/L,氨基酸質(zhì)量濃度為 0.32 g/L,碳/氮比約為 16∶1。
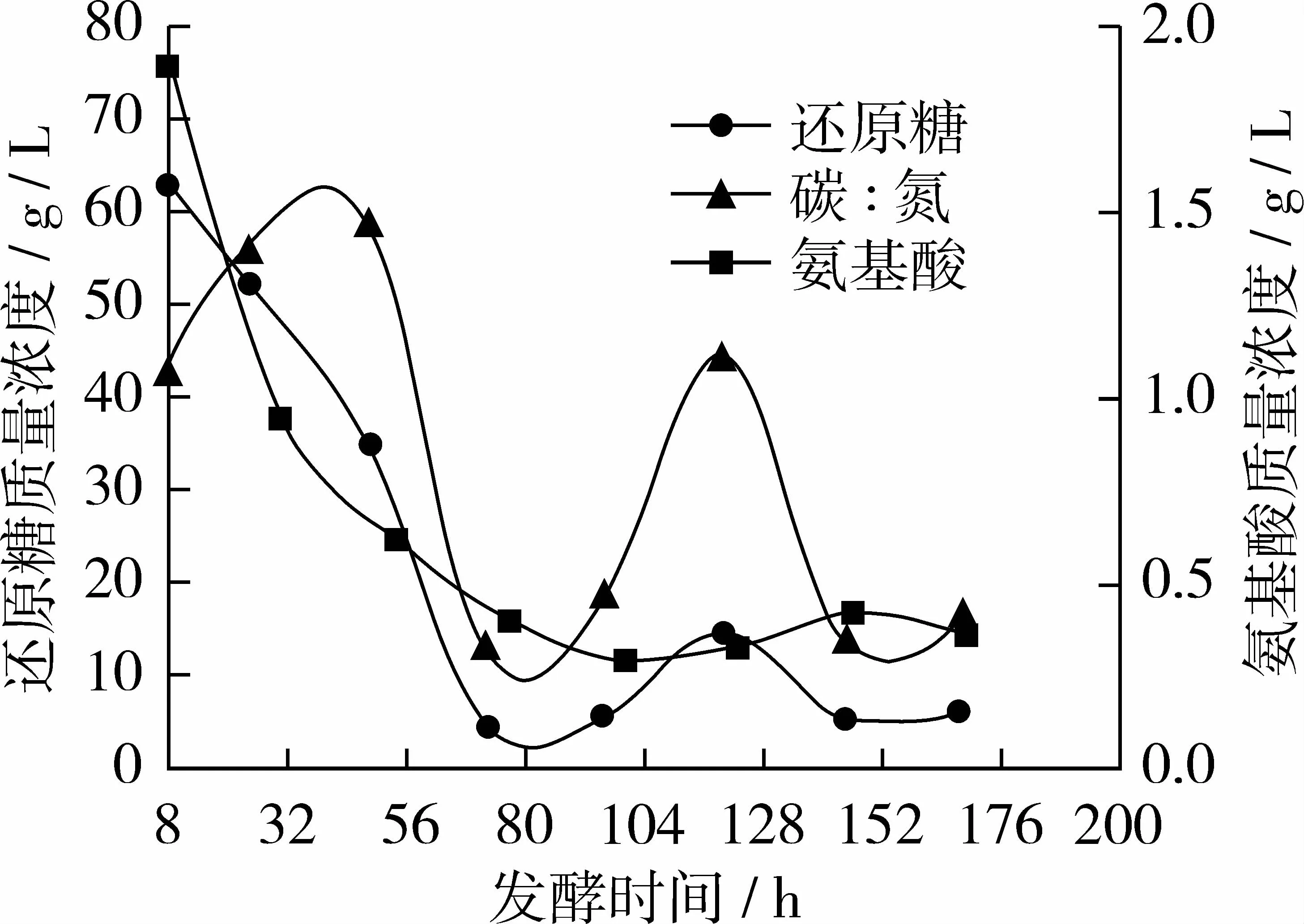
圖6 試驗組F碳、氮利用變化曲線
從圖6看出試驗組F與對照組相比氨基酸質(zhì)量濃度曲線基本不變,還原糖質(zhì)量濃度曲線在120 h時略有上升;前72 h糖耗為92.7%左右,氮耗為79.4%左右;當(dāng)120 h補(bǔ)糖10 g時,發(fā)酵液中殘?zhí)菨舛葹?0.6%左右,氨基酸濃度為17.0%左右;當(dāng)168 h放瓶收獲時發(fā)酵液中剩余殘?zhí)琴|(zhì)量濃度僅5.37 g/L,氨基酸質(zhì)量濃度為0.35 g/L,碳/氮比約為15∶1。
2.3 補(bǔ)糖對寇氏隱甲藻干重、產(chǎn)油率及DHA的影響
試驗組 B、C、D、E、F中干重、產(chǎn)油率、DHA產(chǎn)量及含量明顯高于對照組,特別是F組的產(chǎn)油率及DHA產(chǎn)量分別比對照組高出了42.58%和49.30%。
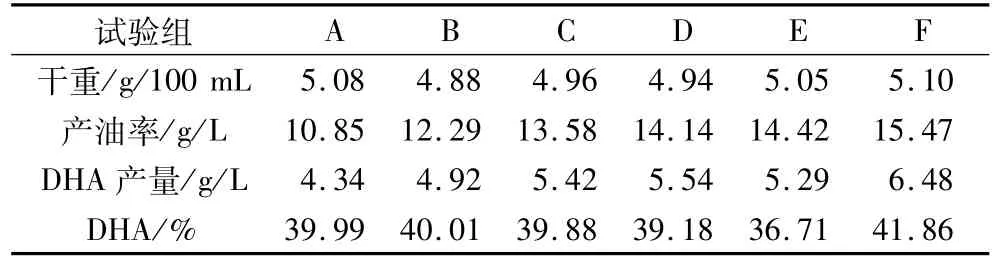
表2 對照組和試驗組的干重、產(chǎn)油率、DHA產(chǎn)量及含量
3 討論與結(jié)論
從補(bǔ)糖來看,5個不同的補(bǔ)糖試驗組油脂的干重、產(chǎn)油率、DHA產(chǎn)量及含量明顯高于對照組,當(dāng)寇氏隱甲藻細(xì)胞受到氮源的限制,油脂濃度成指數(shù)增長。說明油脂的積累是在細(xì)胞生長受限的條件下進(jìn)行的,細(xì)胞不會消耗自身合成的油脂;在線性生長時,營養(yǎng)限制使得細(xì)胞生長受限因此產(chǎn)生更多的油脂,并且充足的營養(yǎng)供給可能導(dǎo)致更多的飽和脂肪酸合成,相反氮源的限制可能使得更多的不飽和脂肪酸形成[11]。本試驗結(jié)果也表明當(dāng)?shù)春谋M時補(bǔ)糖不僅可以促進(jìn)油脂的產(chǎn)生,而且對DHA的形成也是有利的。
前72 h是寇氏隱甲藻生長的重要時期,隨著發(fā)酵的不斷進(jìn)行,碳氮比會一直下降。當(dāng)對照組發(fā)酵至120 h時,發(fā)酵液中的碳氮比約為15∶1,此時補(bǔ)糖的F組干重、產(chǎn)油率、DHA產(chǎn)量及含量達(dá)到本試驗最高。
[1]翟中和,蔡樹濤.一種原始真核細(xì)胞—寇氏隱甲藻的染色體骨架[J].電子顯微學(xué)報,1991,10(4):315-316
[2]潘冰蜂,李祖義.利用海洋微藻生產(chǎn)富含DHA的單細(xì)胞油脂[J].中國生物工程雜志,2000,20(6):43-45
[3]M.de Swaaf,J.Pronk,L.Sijtsma.Fed-batch cultivation of the docosahexaenoic-acid-producing marine alga Crypthecodinium cohnii on ethanol[J].Applied microbiology and biotechnology,2003,61(1):40-43
[4]WANG Jufang,Wu Haizhen,Liang Shizhong,et al.Effect of nitrogen sources on the growth and docosahexaenoic acid accumulation in Crypthecodinium cohnii[J].Marina Science Bulletin,2002,4(1):87-92
[5]Ana Mendes,Alberto Reis,Rita Vasconcelos,et al.Crypthecodinium cohniiwith emphasis on DHA production:a review[J].Journal of applied phycology,2009,21(2):199-214.
[6]楊革,徐承水.隱甲藻深層培養(yǎng)產(chǎn)生二十碳五烯酸的研究[J].生物工程學(xué)報,2001,17(2):221-223
[7]鄭捷,胡愛軍.超聲對提取海藻二十二碳六烯酸和二十碳五烯酸的影響[J].聲學(xué)技術(shù),2007,26(1):75-79
[8]王永華,梁世中,楊博,等.隱甲藻發(fā)酵產(chǎn)DHA最佳無機(jī)鹽濃度的確定[J].中國油脂,2002,27(2):26-28
[9]楊革,孔慶娥.鑭與釹對隱甲藻的生長、DHA合成及固氮活性的影響[J].中國稀土學(xué)報,2002,20(Z2):168-170
[10]Yue Jiang,F(xiàn)eng Chen.Effects ofmedium glucose concentration and pH on docosahexaenoic acid content of heterotrophic Crypthecodinium cohnii[J].Process Biochemistry,2000,35(10):1205-1209
[11]姜劍鋒,趙麗芹,陳濤,等.寇氏隱甲藻不同破壁方法的研究[J].中國糧油學(xué)報,2011,26(8):92-94.

