包埋脫水法超低溫保存萱藻(Scytosiphon lomentaria)絲狀體的研究*
莊 琰 宮相忠 高 偉 張文健
(中國海洋大學(xué)海洋生命學(xué)院 青島 266003)
包埋脫水法是一種將生物材料用褐藻酸鈉包埋,然后經(jīng)脫水后投入液氮保存的一種較為廣泛使用的種質(zhì)保存方法, 最早被法國學(xué)者應(yīng)用于保存馬鈴薯莖尖的研究中(Fabreet al, 1990)。與傳統(tǒng)的兩步法相比, 包埋脫水法不僅能獲得較高的存活率, 而且具有省時省力、無需復(fù)雜的設(shè)備和儀器、無需使用抗凍保護劑從而避免了其對生物材料的毒性等優(yōu)點, 這無疑是超低溫保存技術(shù)的一項重大進步(Fabreet al, 1990;王君暉等, 1999)。近年來, 包埋脫水法被廣泛應(yīng)用于植物細胞、組織和器官的保存, 在藻類方面, 包埋脫水法在諸如壇紫菜自由絲狀體(王起華等, 2000)、裙帶菜配子體(王起華等, 2005)以及多種微藻(Hirataet al, 1996;李賀等, 2005)等的保存上取得了初步的成功。
萱藻(Scytosiphon lomentaria)隸屬于褐藻門(Phaeophyta), 是一種廣泛分布于我國北起遼東半島南至廣東省海陵島之間沿海海域的大型海藻。萱藻不僅口味鮮美、營養(yǎng)價值高, 而且具有抗氧化性(Kudaet al,2005)、抗腫瘤(Nodaet al, 1990; 徐年軍等, 2001)和抗病毒(Hudsonet al, 1999)的特點, 是一種經(jīng)濟價值極高的新型海藻。萱藻具有異形世代交替的生活史, 由大型的葉狀配子體世代和微小的孢子體世代構(gòu)成。孢子體世代主要有墊狀體、類墊狀體和絲狀體三種形式(邢永澤等, 2010)。萱藻絲狀體是實驗室擴增的主要對象, 而且絲狀體能夠形成單室孢子囊并釋放游孢子, 進而發(fā)育成葉狀體, 因此是種質(zhì)保存的最佳材料。關(guān)于萱藻種質(zhì)保存的研究目前國內(nèi)外尚未見報道,本研究用包埋脫水法對萱藻絲狀體進行保存, 探討了預(yù)培養(yǎng)蔗糖濃度和時間、膠球含水量、化凍溫度、膠球恢復(fù)時間對凍存后萱藻絲狀體存活率和生長發(fā)育能力的影響。
1 材料與方法
1.1 實驗材料
萱藻成熟葉狀體于2012年4月采自長島自然海區(qū)。將葉狀體用消毒棉棒反復(fù)擦洗干凈后陰干刺激并放散雌、雄配子, 雌、雄配子結(jié)合后培養(yǎng)約一周形成黃褐色絲狀體, 收集絲狀體在光照培養(yǎng)箱中擴增培養(yǎng)。培養(yǎng)條件為(22.0±0.5)°C, 光強86.4—97.2μmol/(m2·s), L︰D=14︰10, 培養(yǎng)液為F1培養(yǎng)液(高偉等, 2012)。當絲狀體培養(yǎng)至褐色時即可作為保存材料。
1.2 實驗方法
1.2.1 包埋 將上述絲狀體材料用攪拌器打碎至約500—600μm長的小段, 用消毒篩絹過濾掉培養(yǎng)液,再用滅菌海水沖洗兩遍后將絲狀體小段與3%的褐藻酸鈉溶液混勻。然后用10mL注射器將藻液滴入含有0.1mol/LCaCl2的3%的NaCl溶液中, 輕輕搖動混合液, 約20min后膠球硬化完成包埋過程。通過控制針頭到液面的高度以及藻液滴入的速度, 可將膠球的直徑控制在3mm左右。
1.2.2 膠球的蔗糖預(yù)培養(yǎng) 將完成固定化的膠球置于不同濃度的蔗糖溶液中, 在室溫(22.0±0.5)°C及黑暗條件下預(yù)培養(yǎng)不同的時間。蔗糖濃度梯度為0、0.2、0.3、0.4、0.5、0.6、0.7、0.8mol/L; 預(yù)培養(yǎng)時間梯度設(shè)置為0、2、4、6、8、10、12、24h。
1.2.3 膠球脫水與含水量的測定 膠球在蔗糖溶液中預(yù)培養(yǎng)完成后, 用吸水紙吸干膠球表面殘留的液體。以每60個膠球為一組稱量鮮重并置于直徑為9cm的培養(yǎng)皿中, 將裝有膠球的培養(yǎng)皿放在底部鋪有干燥硅膠且直徑為15cm的大培養(yǎng)皿中, 蓋上大培養(yǎng)皿蓋并用保鮮膜封口, 隨即放入21°C的培養(yǎng)箱中在黑暗條件下干燥脫水。膠球脫水8h過程中, 每隔0.5h取出一個培養(yǎng)皿稱取膠球脫水后的重量, 通過烘干(105°C, 4h)可測出膠球的干重。膠球脫水后的含水量計算公式如下:

1.2.4 膠球的冰凍保存及化凍 將脫水后的膠球每15個為一組放入2mL的凍存管中, 密封后立即投入液氮中保存。24h后, 取出凍存管, 迅速放入不同溫度的恒溫水浴鍋中不停攪動, 約20s后膠球表面白色消失, 化凍完成。化凍溫度梯度設(shè)置為20、30、40、50、60°C。
1.2.5 膠球的恢復(fù)、脫固定化與萱藻絲狀體的恢復(fù)培養(yǎng) 將化凍后的膠球放入裝有消毒海水的10mL離心管中在21°C黑暗條件下恢復(fù)不同的時間, 然后用含0.05mol/L檸檬酸鈉的3%的NaCl溶液對膠球脫固定, 膠球溶解后重新得到含有絲狀體小段的混合液。通過對混合液離心(2500r/min, 3min)得到萱藻絲狀體, 然后用添加了F1培養(yǎng)液的消毒海水重新懸浮絲狀體, 再將藻液置于擴增條件下恢復(fù)培養(yǎng)。膠球在黑暗條件下恢復(fù)時間梯度設(shè)為0、6、12、18、24、48h。
1.2.6 存活率的測定 取恢復(fù)培養(yǎng)2d的絲狀體懸液2mL于離心管中, 加入等體積的0.1%的中性紅染液進行染色, 30min后離心去除染液, 并用消毒海水重新懸浮絲狀體。在顯微鏡下進行觀測, 凡是被染成紅色的絲狀體細胞即為活細胞。脫水后存活率和凍存后存活率計算公式如下:

上述每組實驗至少重復(fù)2次, 每次實驗同一處理均設(shè)置三個平行樣, 每個樣品至少計數(shù)2000個細胞,文中數(shù)據(jù)為6個平行樣品的平均值。
1.2.7 生長發(fā)育能力的鑒定 將完成脫固定化的萱藻絲狀體移至擴增條件下培養(yǎng), 定期觀察絲狀體的生長發(fā)育情況。待絲狀體長到一定量后置于(17.0±0.5)°C, L︰D=10︰14, 光強(28.0±2.7)μmol/(m2·s)條件下誘導(dǎo)孢子囊, 陰干刺激孢子囊使其放散孢子, 觀察孢子的發(fā)育情況。
2 結(jié)果
2.1 脫水時間與膠球含水量的關(guān)系
由圖1可知, 在膠球脫水8h內(nèi), 脫水速率逐漸降低, 脫水過程大致可分成三個階段。0—2h, 脫水速率較高, 膠球含水量從80.42%下降到44.87%, 平均脫水速率約為17.78%/h; 2—5h, 膠球含水量從44.87%降至18.22%, 平均脫水速率減小至8.88%/h; 5—8h,平均脫水速率進一步降低, 約為4.26%/h, 8h時含水量為5.45%。從整個脫水過程來看, 膠球的平均脫水速率約為9.37%/h。
2.2 膠球含水量對萱藻絲狀體存活率的影響
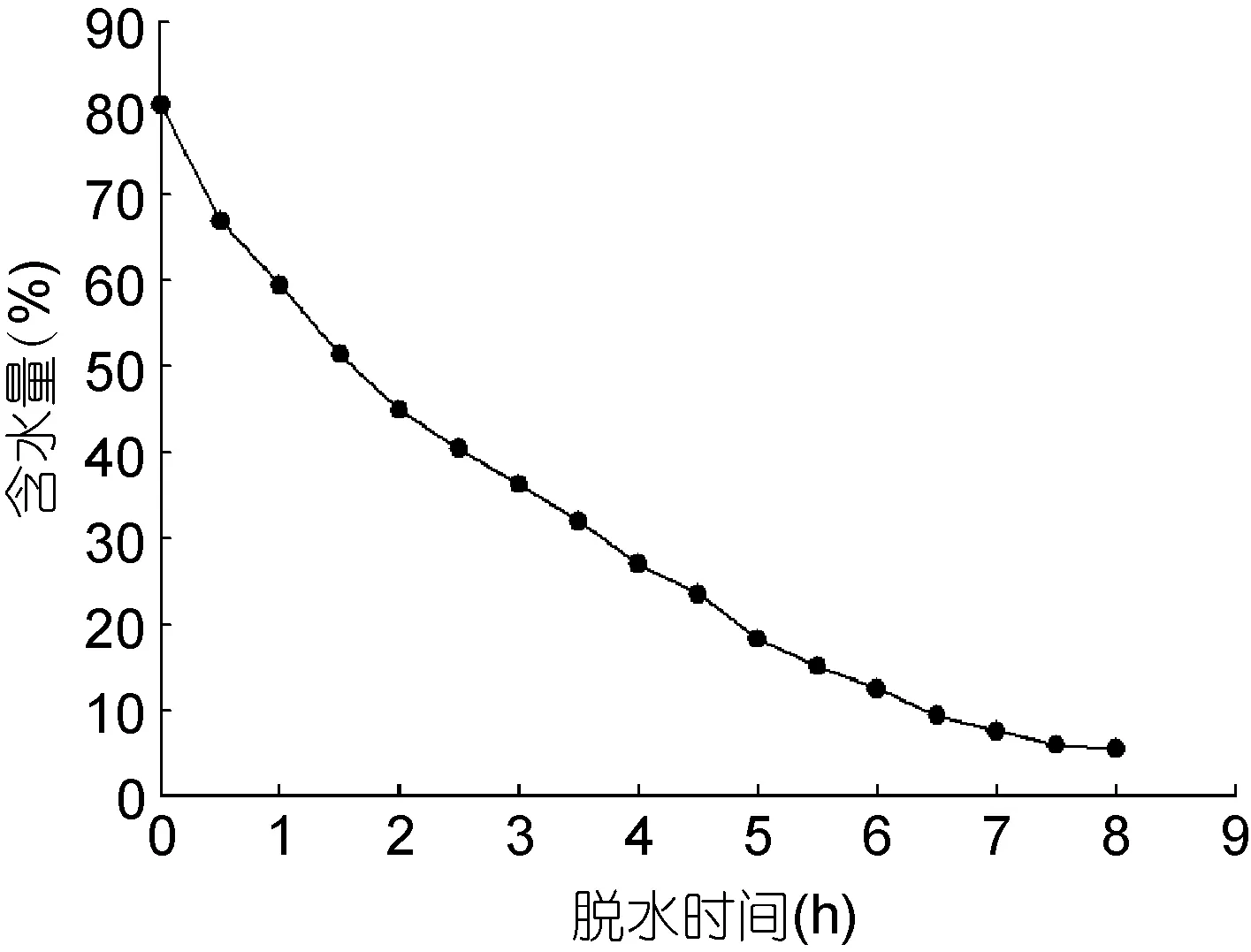
圖1 脫水時間與膠球含水量的關(guān)系Fig.1 The relationship between dehydration time and water content of the beads
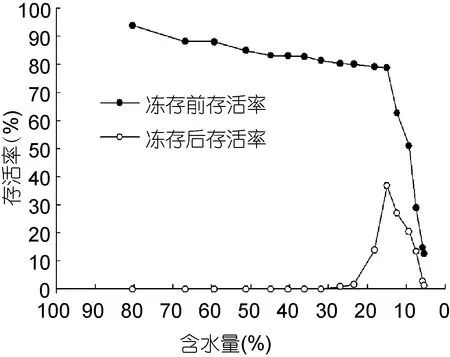
圖2 含水量對凍存前后萱藻絲狀體存活率的影響Fig.2 The effect of water content on survival rate of the filaments of S. lomentaria before and after cryopreservation
膠球含水量對凍存前、后萱藻絲狀體的存活率的影響顯著。實驗結(jié)果顯示(圖2), 隨著膠球含水量的降低, 凍存前絲狀體的存活率呈下降趨勢, 當含水量降至9.34%時, 絲狀體存活率仍在50%以上, 說明經(jīng)蔗糖預(yù)培養(yǎng)后萱藻的抗脫水能力較強; 隨含水量的進一步降低, 凍存前絲狀體的存活率大幅度下降, 當含水量為5.45%時, 凍存前絲狀體的存活率只有12.51%。相比之下, 膠球含水量對凍存后絲狀體存活率的影響呈現(xiàn)不同的趨勢: 若膠球含水量高于26.96%, 凍存后絲狀體的存活率都為0; 隨著含水量的降低, 凍存后絲狀體的存活率逐漸升高, 當膠球含水量為15.01%時, 存活率達到最高, 約為36.83%;之后含水量進一步降低, 凍存后絲狀體的存活率也隨之降低。因此, 萱藻絲狀體膠球含水量為15%時最有利于其冰凍保存。
2.3 蔗糖預(yù)培養(yǎng)濃度對萱藻絲狀體存活率的影響
蔗糖是一種“復(fù)合型”凍存保護劑, 可提高細胞脫水過程中的存活率并增強其抗凍能力。由實驗結(jié)果可知(圖3), 蔗糖預(yù)培養(yǎng)對凍存前、后萱藻絲狀體的存活率影響顯著。若不用蔗糖進行預(yù)培養(yǎng), 凍存前、后絲狀體的存活率均為0。蔗糖濃度在0.2—0.4mol/L范圍內(nèi), 隨著蔗糖濃度的升高, 凍存前、后絲狀體的存活率均逐漸升高, 并在蔗糖濃度為0.4mol/L時達到最大值, 分別為74.84%和35.18%。隨蔗糖濃度的繼續(xù)升高, 凍存后的存活率逐漸下降, 0.8mol/L時僅為13.15%; 而凍存前的存活率也緩慢下降, 但都保持在60%以上。因此, 蔗糖預(yù)培養(yǎng)的最佳濃度是0.4mol/L。
2.4 蔗糖預(yù)培養(yǎng)時間對萱藻絲狀體存活率的影響
圖4為蔗糖預(yù)培養(yǎng)時間對凍存前、后萱藻絲狀體存活率的影響。結(jié)果表明: 除0h時, 凍存前、后絲狀體的存活率均為0以外, 從2—24h, 凍存前絲狀體的存活率基本一致, 都在70%左右, 說明萱藻絲狀體對高濃度蔗糖有較大的適應(yīng)性; 而凍存后絲狀體的存活率呈現(xiàn)先增大后減小的趨勢, 并在6h時達到最大值50.08%。可見, 蔗糖預(yù)培養(yǎng)6h可大幅度提高凍存后萱藻絲狀體的存活率。

圖3 蔗糖濃度對凍存前后萱藻絲狀體存活率的影響Fig.3 The effect of sucrose concentration on survival rate of the filaments of S. lomentaria before and after cryopreservation

圖4 蔗糖預(yù)培養(yǎng)時間對凍存前后萱藻絲狀體存活率的影響Fig.4 The effect of preculture time on survival rate of the filaments of S. lomentaria before and after cryopreservation
2.5 化凍溫度對萱藻絲狀體存活率的影響
實驗結(jié)果顯示(圖5), 化凍溫度對存活率有極大的影響。若在20°C條件下對膠球化凍, 存活率僅為8.78%; 當化凍溫度為40°C時, 存活率最高, 可達50.64%; 而當化凍溫度為60°C時, 存活率降至20.53%。由此說明, 化凍溫度過高或者過低都會對膠球化凍過程產(chǎn)生不利的影響, 40°C可達到最佳化凍效果。
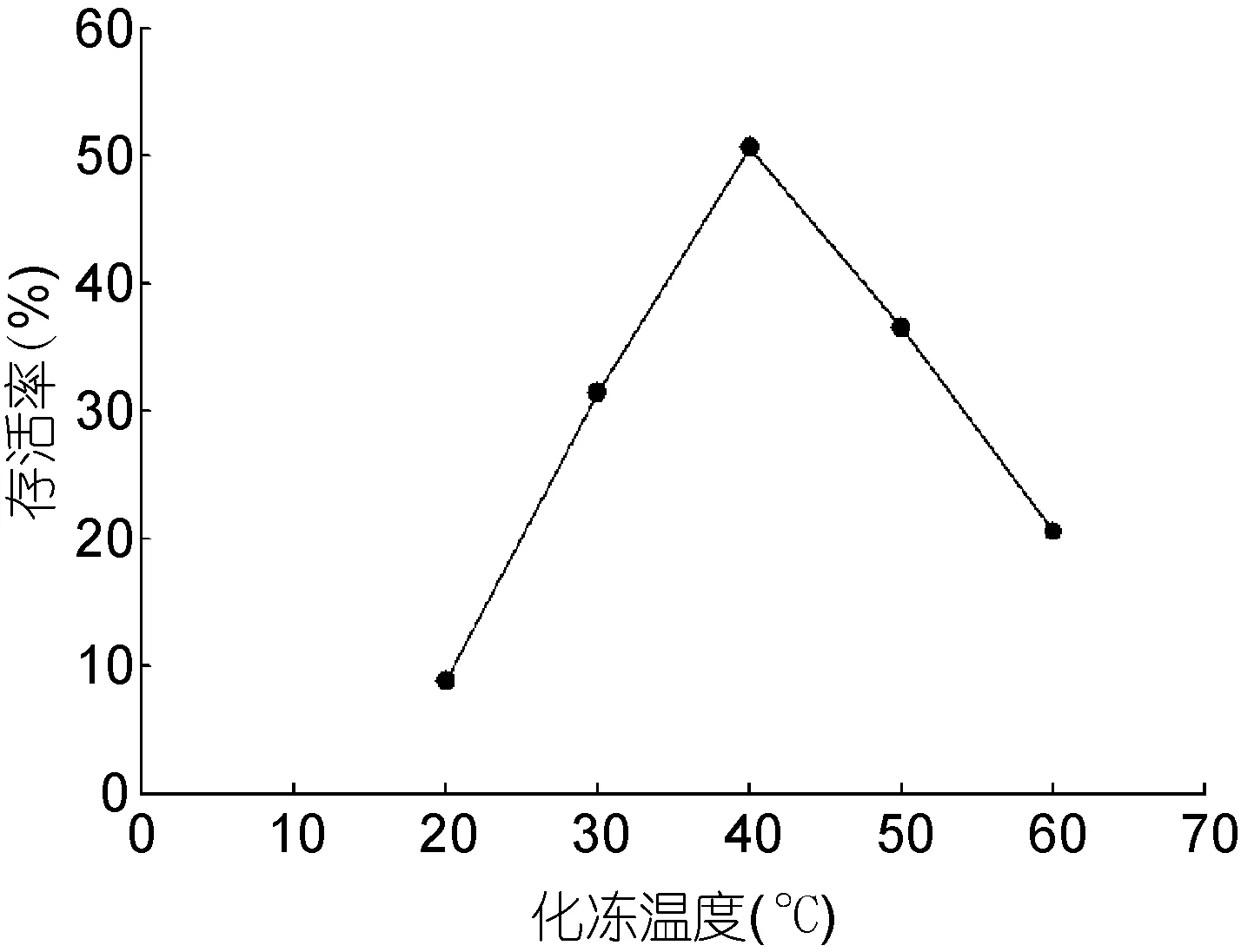
圖5 化凍溫度對萱藻絲狀體存活率的影響Fig.5 The effect of thawing temperature on survival rate of the filaments of S. lomentaria
2.6 膠球恢復(fù)時間對萱藻絲狀體存活率的影響
膠球化凍后置于消毒海水中在黑暗條件下進行恢復(fù), 使脫水的膠球進行“復(fù)水”。實驗結(jié)果表明(圖6): 如不對膠球進行恢復(fù), 萱藻絲狀體的存活率只有18.92%; 膠球恢復(fù)時間長于或短于18h都會降低存活率, 當膠球恢復(fù)18h時, 萱藻絲狀體存活率最高可達54.79%。因此, 膠球在黑暗條件下恢復(fù)18h效果最好。
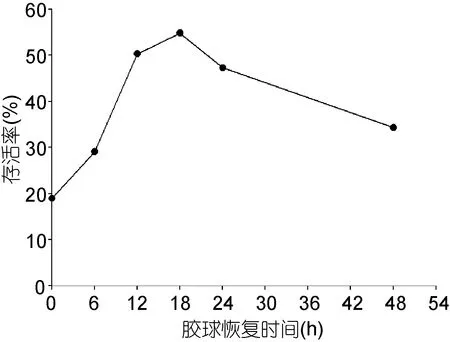
圖6 膠球恢復(fù)時間對萱藻絲狀體存活率的影響Fig.6 The effect of recovery time of the beads on survival rate of the filaments of S. lomentaria
2.7 凍存后萱藻絲狀體生長發(fā)育能力的觀測
將脫固定后的萱藻絲狀體移入擴增條件下恢復(fù)培養(yǎng), 恢復(fù)一個月的萱藻絲狀體長勢良好, 且與未凍存的萱藻絲狀體并無差別(見圖7a, b)。另一方面, 凍存后的萱藻絲狀體具有生長發(fā)育能力, 能夠形成正常的孢子囊并釋放孢子, 而且釋放的孢子能發(fā)育成正常的幼葉狀體(見圖7c—f)。由此, 我們認為包埋脫水法適用于萱藻絲狀體的種質(zhì)保存。
3 討論
在高等植物的種質(zhì)保存中, 包括兩步法、包埋脫水法、玻璃化法以及包埋-玻璃化法等在內(nèi)的多種超低溫保存法均已成功得到運用, 而對于藻類種質(zhì)保存來說, 更多采用的是兩步法和包埋脫水法。就目前各種包埋脫水法的研究來看, 膠球的蔗糖預(yù)培養(yǎng)和含水量是影響生物材料凍存后存活率的兩個重要因素, 而不同的生物材料對預(yù)培養(yǎng)和含水量的要求也不盡相同。
用包埋脫水法保存種質(zhì), 細胞須脫水至細胞溶質(zhì)充分濃縮到熱力學(xué)的凝固點以下, 避免冰晶的形成(Stillinger, 1995)。細胞若未充分脫水, 則會在凍存和復(fù)蘇的過程中遭遇冰晶的傷害而降低凍存后的存活率(Dayet al, 2000)。保存材料的種類不同, 其最適含水量亦有較大的差異。對高等植物材料來說, 其最適含水量范圍變化較大, 如體胚為13%—20%, 而莖尖和分生組織多為20%—40%(王君暉等, 1999)。已報道的幾種大型海藻的最適含水量一般在也在20%—40%左右, 如海帶配子體的最適含水量為40%(Zhanget al, 2008), 裙帶菜配子體的最佳含水量是25%(王起華等, 2005), 而壇紫菜自由絲狀體在含水量在16%—40%范圍內(nèi), 都可保持較高的存活率(王起華等,2000)。本研究發(fā)現(xiàn), 萱藻絲狀體有較寬的脫水范圍,當含水量為9%時, 其凍存前的存活率仍在50%左右。但凍存后萱藻絲狀體的存活率范圍較窄, 只有當含水量低于27%才可存活, 并且在含水量為15%時可達到最佳效果。

圖7 凍存前后萱藻絲狀體生長發(fā)育的比較Fig.7 Comparison between cryopreserved and non-cryopreserved filaments of S. lomentaria in the growing development
蔗糖是一種“復(fù)合型”凍存保護劑, 它既可以作為細胞內(nèi)也可作為細胞外保護劑。通過對膠球進行蔗糖預(yù)培養(yǎng), 一方面可以使細胞適度脫水, 另一方面又可提高細胞外液的濃度, 減少細胞內(nèi)冰晶的生長(劉濤等, 2006)。高等植物材料預(yù)培養(yǎng)時一般選用的蔗糖濃度為0.3—0.75mol/L, 有些研究所用的蔗糖濃度甚至高達1.0mol/L, 但0.75mol/L更為常用(王君暉等,1999)。蔗糖培養(yǎng)時間一般為1d, 有些可達3—10d(Mariet al, 1995)。關(guān)于對藻類進行蔗糖預(yù)培養(yǎng)的報道并不多見, 有研究證明掌狀海帶配子體的最佳蔗糖預(yù)培養(yǎng)濃度和時間分別為0.3—0.4mol/L和6h(Vigneronet al, 1997)。本研究證明, 蔗糖可大幅度提高萱藻絲狀體的抗脫水能力和抗凍能力, 對凍存前、后萱藻絲狀體膠球的存活率有極大影響。若不用蔗糖進行預(yù)培養(yǎng), 萱藻絲狀體會因過度脫水和凍存過程中冰晶的形成而死亡。萱藻絲狀體的最佳蔗糖預(yù)培養(yǎng)濃度和時間為0.4mol/L和6h左右, 而這與掌狀海帶配子體具有相似性。
化凍操作對材料的存活率有很大影響(Dumetet al, 2002), 一般采用快速化凍法, 即將凍存的材料迅速移入25—40°C的恒溫水浴鍋中快速攪動, 直至最后一粒冰晶消失。快速化凍法可有效阻止化凍過程中細胞內(nèi)冰晶的形成(Tayloret al, 1999 )。本研究探討了20—60°C的化凍溫度對萱藻絲狀體存活率的影響,證明了40°C是最佳的化凍溫度, 溫度太低會導(dǎo)致化凍過程中冰晶的重新生成而損害細胞, 而溫度過高又會對細胞自身產(chǎn)生不利的影響。因此, 選取合適的化凍溫度也是包埋脫水法的一個重要環(huán)節(jié)。
在包埋脫水法中, 對經(jīng)歷了脫水-冰凍-化凍過程的膠球, 在培養(yǎng)之初, 還要經(jīng)歷一個“復(fù)水”的過程,即恢復(fù)到正常含水量的過程(王起華等, 2006)。本研究采取的恢復(fù)方法是將化凍后的膠球放入海水中在黑暗條件下進行恢復(fù), 在恢復(fù)開始時, 細胞會經(jīng)歷一個快速的復(fù)水過程。研究表明: 將化凍的萱藻絲狀體膠球恢復(fù)18h, 能有效提高存活率; 恢復(fù)時間太短,會導(dǎo)致“復(fù)水”不夠充分; 恢復(fù)時間太長, 對細胞存活有抑制作用。關(guān)于恢復(fù)方法對藻類冰凍保存影響的研究鮮有報道(Tayloret al, 1999), 還有許多問題需要進一步的探究。
將脫固定后的萱藻絲狀體置于正常條件下進行培養(yǎng), 觀察其生長發(fā)育能力。研究發(fā)現(xiàn), 凍存后的萱藻在初始生長階段較多地以團狀細胞形式存在, 并且顏色呈較淺的黃褐色, 隨著培養(yǎng)時間的延長, 絲狀體慢慢從團狀細胞伸出。充氣培養(yǎng)一個月后, 可見呈褐色念珠狀的萱藻絲狀體。凍存后的萱藻絲狀體與凍存前的絲狀體在形態(tài)、結(jié)構(gòu)上完全一致, 且經(jīng)誘導(dǎo)后能夠產(chǎn)生孢子囊并釋放孢子, 孢子能發(fā)育成正常的幼葉狀體。以上說明, 包埋脫水法能夠成功運用于萱藻的種質(zhì)保存。
綜上所述, 本研究首次采用包埋脫水法成功凍存了萱藻絲狀體。研究結(jié)果表明: 膠球含水量和蔗糖預(yù)培養(yǎng)是影響凍存后萱藻絲狀體存活率的關(guān)鍵因素,為了提高凍存后的存活率, 適宜將膠球脫水至較低的含水量并采用較低的蔗糖濃度和較短的預(yù)培養(yǎng)時間。另外, 對膠球進行快速的化凍以及適當?shù)幕謴?fù)也可在一定程度上提高存活率。凍存后的萱藻絲狀體有較高的存活率, 而且經(jīng)恢復(fù)后仍具有生長發(fā)育能力。因此, 包埋脫水法是保存萱藻絲狀體一種較為理想的方法, 在以后的實驗室萱藻種質(zhì)保存以及萱藻種質(zhì)庫構(gòu)建過程中可以使用該方法。但是, 本研究中萱藻絲狀體的最高存活率與已報道的經(jīng)包埋脫水冰凍保存后的壇紫菜絲狀體(王起華等, 2000)等的最高存活率仍有一定的差距, 如何進一步提高萱藻絲狀體經(jīng)包埋脫水超低溫保存后的存活率仍需進一步探究。
王君暉, 邊紅武, 黃純農(nóng), 1999. 植物樣品包埋脫水法超低溫保存的研究進展. 植物學(xué)通報, 16(5): 582—586
王起華, 劉 明, 程愛華, 2000. 壇紫菜(Porphyra haitanensis)自由絲狀體的膠囊化冰凍保存. 遼寧師范大學(xué)學(xué)報, 23(4):387—390
王起華, 劉艷萍, 張恩棟等, 2005. 包埋脫水法冷凍保存裙帶菜配子體克隆的研究. 海洋學(xué)報, 27(2): 154—158
王起華, 李 瑩, 劉艷萍等, 2006. 用包埋脫水法冰凍保存小新月菱形藻. 海洋科學(xué), 30(4): 50—53
邢永澤, 宮相忠, 尹寶樹等, 2010. 萱藻不同發(fā)育階段形態(tài)學(xué)及生活史的研究.中國海洋大學(xué)學(xué)報, 40(8): 98—103
劉 濤, 張 靜, 孟祥紅等, 2006. 海帶雌雄配子體克隆細胞的超低溫保存實驗. 海洋學(xué)報, 28(2): 175—177
李 賀, 王起華, 李婷婷等, 2005. 包埋脫水法凍存3種餌料金藻的研究. 大連民族學(xué)院學(xué)報, 7(1): 62—66
徐年軍, 范 曉, 韓麗君等, 2001. 山東沿海海藻抗腫瘤活性的篩選. 海洋與湖沼, 32(4): 408—413
高 偉, 宮相忠, 張必達, 2012. 環(huán)境因子對萱藻(Scytosiphon lomentaria)絲狀體孢子放散的影響. 海洋與湖沼, 43(2):244—248
Day J G, Fleck R A, Benson E E, 2000. Cryopreservationrecalcitrance in microalgae: novel approaches to identify and avoid cryo-injury. Journal of Applied Phycology, 12(3—5):369—377
Dumet D, Grapin A, Bailly Cet al, 2002. Revisiting crucial steps of an encapsulation/desiccation based cryopreservation process: Importance of thawing method in the case ofPelargonium meristems. Plant Science, 163(6): 1121—1127
Fabre J, Dereuddre J, 1990. Encapsulation dehydration: a new approach to cryopreservation of Solanum shoot-tips.Cryo-Letters, 11(6): 413—426
Hirata K, Phunchindawan M, Takamoto Jet al, 1996. Cryopreservation of microalgae using encapsulation-dehydration. Cryo-Letters,17(5): 321—328
Hudson J B, Kim J H, Lee M Ket al, 1999. Antiviral compounds in extracts of Korean seaweeds: Evidence for multiple activities. Journal of Applied Phycology, 10(5): 427—434
Kuda T, sunekawa M T, Goto Het al, 2005. Antioxidant properties of four edible algae harvested in the Noto Peninsula, Japan.Journal of Food Composition and Analysis, 18(7): 625—633
Mari S, Engelmann F, Chabrillange Net al, 1995. Histocytological study of apices of coffee (Coffea reacemosaandC. sessiliflora) in vitro plantlets during their cryopreservation using the encapsulation-dehydration technique. Cryo-Letters,16: 289—298
Noda H, Amano H, Arashima Ket al, 1990. Antitumor activity of marine algae. Hydrobiologia, 204—205(1): 577—584
Stillinger F A, 1995. A topographic view of supercooled liquids and glass formation. Science, 267(5206): 1935—1939
Taylor R, Fletcher R L, 1999. A simple method for the freezepreservation of zoospores of the green macroalgaEnteromopha intestinalis. Journal of Applied Phycology, 11(3): 257—262
Vigneron T, Arbault S, Kass R, 1997. Cryopreservation of gametophytes ofLaminaria digitata(L) Lamouroux by encapsulation dehydration. Cryo-Letters, 18(2): 93—98
Zhang Q S, Cong Y Z, Qu S Cet al, 2008. Cryopreservation of gametophytes ofLaminaria japonica(Phaeophyta) using encapsulation-dehydration with two-step cooling method.Journal of Ocean University of China, 7(1): 65—71

