青島中港海水全浸初期不銹鋼表面生物膜的細(xì)菌多樣性分析*
陳永偉 欒 鑫 段繼周 池振明
(1. 中國海洋大學(xué)海洋生命學(xué)院 青島 266003; 2. 中國科學(xué)院海洋研究所 青島 266071)
316L不銹鋼具有較強(qiáng)的耐腐蝕性和良好的機(jī)械加工性, 常應(yīng)用于海洋設(shè)施中的關(guān)鍵部件。在天然海水環(huán)境中, 不銹鋼表面會形成一層由微生物及其代謝產(chǎn)物所組成的生物膜, 該生物膜可能包含多種腐蝕微生物, 如鐵氧化菌, 硫酸鹽還原菌和錳氧化菌等(Newmanet al, 1986; Xuet al, 2008), 從而會對不銹鋼產(chǎn)生微生物腐蝕, 導(dǎo)致巨大的經(jīng)濟(jì)損失(Beechet al,1999)。
已有許多研究發(fā)現(xiàn), 316L不銹鋼在淡水和天然海水中都有開路電位變正現(xiàn)象, 即開路電位正向移動現(xiàn)象(Motodaet al, 1990; Dickinsonet al, 1996), 但是在滅菌海水以及某些單一菌株或混合菌株菌液中卻出現(xiàn)開路電位負(fù)向移動的現(xiàn)象(Xuet al, 2007,2008)。目前比較普遍的觀點(diǎn)是, 上述開路電位變正現(xiàn)象是由微生物在不銹鋼表面的生長繁殖造成的, 但具體是哪種微生物, 其機(jī)理是什么尚不清楚。因此,研究天然海水中的316L不銹鋼表面的微生物菌落結(jié)構(gòu)具有重要意義, 可為進(jìn)一步研究微生物腐蝕機(jī)理和尋找腐蝕微生物提供參考依據(jù)。
有研究表明, 在一般情況下, 生物膜的形成與發(fā)展會在14—20天內(nèi)達(dá)到成熟階段(黃宗國, 2008)。Jones等(2007)對暴露于天然海水中的316L不銹鋼表面所形成生物膜的細(xì)菌群落結(jié)構(gòu)進(jìn)行了研究, 表明主要的細(xì)菌群體在2—20天內(nèi)的相對豐度基本沒有發(fā)生變化。有關(guān)學(xué)者對飲用水系統(tǒng)中不銹鋼表面生物膜進(jìn)行了研究, 結(jié)果表明, 不銹鋼表面細(xì)菌種類明顯多于PVC材料, 不銹鋼的腐蝕導(dǎo)致不銹鋼表面粗糙度增加, 有利于生物膜的再生。因此, 他們認(rèn)為導(dǎo)致這種現(xiàn)象發(fā)生的原因之一是不銹鋼腐蝕造成的(Linet al, 2013)。然而, 國內(nèi)缺乏對海水中316L不銹鋼表面生物膜的細(xì)菌多樣性方面的研究。為了了解青島近海316L不銹鋼表面微生物膜的細(xì)菌群落組成, 本實(shí)驗(yàn)選擇夏季在青島海域?qū)嵑H?16L不銹鋼來分析研究其表面生物膜中細(xì)菌的多樣性。
1 材料與方法
1.1 掛片與取樣
本實(shí)驗(yàn)所選用的316L不銹鋼材料購自山東信陽晟鑫科技有限公司。按照國標(biāo)《金屬材料在表面海水中常規(guī)暴露腐蝕試驗(yàn)方法》(GB5776-1986)進(jìn)行處理,然后用SiC水磨砂紙將試樣逐級打磨至2000#, 放入無水乙醇中超聲清洗10 min, 最后放入干燥器內(nèi), 備用。處理好的試樣在青島中港實(shí)驗(yàn)站(119°58’E,35°52’N)開展實(shí)海全浸掛片實(shí)驗(yàn)。取樣時將不銹鋼片放入滅過菌的50mL離心管中, 然后放入冰盒中帶回實(shí)驗(yàn)室, –20°C保存?zhèn)溆谩?/p>
1.2 生物膜表面觀察與分析
1.2.1 掃面電子顯微鏡觀察(SEM) 為了觀察不銹鋼表面附著微生物隨時間的變化規(guī)律, 分別在第1、3、5、7、10和15天取回不銹鋼片, 先用滅菌磷酸鹽緩沖液(PBS)輕輕沖洗不銹鋼表面, 然后試片用5%戊二醛(用滅菌PBS稀釋)固定2h。后用50%、75%、90%和100%的乙醇梯度脫水各 30min, 真空臨界點(diǎn)干燥, 噴金后進(jìn)行掃描電鏡觀察(KYKY-2800掃描電子顯微鏡, 北京中科科儀技術(shù)發(fā)展有限責(zé)任公司)。
為了觀察不銹鋼全浸15天以后的腐蝕形貌變化,分別用掃描電鏡觀察不銹鋼片第0天的初始形貌和15天后去除表面腐蝕產(chǎn)物后的表面形貌。
1.2.2 X射線能譜分析(EDS) 對SEM觀察后的第15天的不銹鋼片不做任何處理, 直接進(jìn)行EDS分析, 來研究不銹鋼表面組成元素的變化。
1.2.3 熒光顯微鏡觀察 用4’,6-聯(lián)脒-2-苯基吲哚二鹽酸鹽(DAPI)溶液對全浸15天的不銹鋼進(jìn)行染色以觀察其表面細(xì)菌附著情況。DAPI是一種可以穿透細(xì)胞膜的藍(lán)色熒光染料, 其穿過生物膜后與雙鏈DNA結(jié)合, 在紫外線(365nm)照射下會顯示藍(lán)色熒光。將15天取回的不銹鋼片先用滅菌PBS溶液沖洗掉其表面, 后用0.01mg/mL的DAPI染色30min, 然后熒光觀察其表面附著微生物的數(shù)量。
1.3 PCR-RFLP技術(shù)表面附著微生物多樣性分析
1.3.1 總DNA的提取以及16S rRNA基因的擴(kuò)增利用Power Soil DNA Isolation Kit (Mobio, USA)試劑盒來提取不銹鋼表面微生物的總DNA, 從–20°C冰箱中取出全浸15天的不銹鋼片,用數(shù)片滅菌紗布擦拭其表面后, 將擦拭后的紗布放入試劑盒中的Power Bread Tubes中, 然后按試劑盒說明進(jìn)行DNA提取。以總DNA為模板, 采用細(xì)菌16S rRNA基因保守引物Bac8F: 5′-AGAGTTTGATCCTGGCTCAG-3′和Bac1492R:5′-CGGCTACCTTGTTACGACTT-3′進(jìn)行PCR擴(kuò)增。50μL反應(yīng)體系為: DNA模板2μL, 正反引物(2mmol/L)各5μL, 10×Buffer 5μL, dNTP (2.5mmol/L) 4μL, dH2O補(bǔ)充至50μL。反應(yīng)條件為: 94°C預(yù)變性5 min; 94°C變性30s, 55°C退火30 s, 72°C延伸90 s, 進(jìn)行30個循環(huán); 最后72°C延伸10 min。
1.3.2 16S rRNA基因文庫構(gòu)建及測序 利用瓊脂糖凝膠回收試劑盒(華舜W5211, 上海)純化回收PCR產(chǎn)物, 將純化的16S rRNA基因連接到載體pMD19-T(Takara, 大連)上, 轉(zhuǎn)化到感受態(tài)細(xì)胞E. coliDH5α中,涂布在含有x-gal、IPTG和氨芐青霉素的LB培養(yǎng)基上, 于37°C培養(yǎng)約12h, 選擇具有氨芐抗性的白色轉(zhuǎn)化子96株進(jìn)行劃線培養(yǎng)。然后用水煮法快速提取細(xì)胞中的基因組DNA, 采用T載體通用引物RV-M:5′-GAGCGGATAACAATTTCACACAGG-3′和M13-D:5′-AGGGTTTTCCCAGTCACGACG-3′ (Danget al,2008)進(jìn)行PCR驗(yàn)證。再先后用MspI (NEB R0106, 北京)與HhaI (NEB R0139, 北京)限制性內(nèi)切酶進(jìn)行酶切。根據(jù)酶切所得的RFLP帶型對克隆子進(jìn)行初步劃分, 相同帶型歸為同一個RFLP帶型, 每個帶型挑選出一株代表性菌株送測序(上海鼎安生物技術(shù)有限公司)。
1.3.3 系統(tǒng)進(jìn)化分析 測得的序列用DOTUR軟件進(jìn)行處理, 相似性在97%以上的被歸為同一個操作分類單元(OTU)。將所得結(jié)果分別與NCBI GenBank數(shù)據(jù)庫進(jìn)行比對, 確定最相似的核酸序列,用Clustal X軟件比齊, 然后用MEGA4.0程序通過鄰接法(Neighbor-Joining)構(gòu)建系統(tǒng)進(jìn)化樹。
1.3.4 統(tǒng)計(jì)學(xué)分析 以覆蓋率C來評價(jià)所構(gòu)建的16S rRNA基因文庫對環(huán)境微生物多樣性的體現(xiàn), 公式為:C=[1–(n/N)]×100%, 其中n指文庫中只包含一個克隆的OTU 數(shù),N指文庫的克隆總數(shù)。并計(jì)算其香濃-威納(Shannon-Wiener)指數(shù)(H)、辛普森(Simpson)指數(shù)(D)和均勻度(J)等多樣性指數(shù)(欒鑫等, 2013)。
2 實(shí)驗(yàn)結(jié)果與分析
2.1 不銹鋼表面觀察分析結(jié)果
2.1.1 掃描電鏡觀察 經(jīng)過掃面電鏡的觀察, 得到全浸海水1、3、5、7、10、15天的SEM照片(圖1), 結(jié)果顯示: 不銹鋼片在海水中浸泡1天后就發(fā)現(xiàn)其表面出現(xiàn)細(xì)菌附著及圓形附著物形成; 在第3天表面的微生物明顯增多, 且有細(xì)菌胞外絮狀物形成; 在第5天附著的微生物和絮狀物繼續(xù)增多, 但第7天和第5天比較變化不太明顯; 到了第15天絮狀物厚度進(jìn)一步增加, 形成比較明顯的微生物群落。

圖1 實(shí)海全浸1、3、5、7、10、15天的不銹鋼掛片SEM觀察結(jié)果(放大2500倍)Fig.1 SEM image of the surface of 316L stainless steel immersed in the seawater for 1d, 3d, 5d, 7d, 10d, and 15d
2.1.2 熒光顯微鏡分析結(jié)果 為了觀察實(shí)海全浸15天的316L不銹鋼表面微生物附著情況, 對其進(jìn)行了熒光顯微鏡觀察, 結(jié)果如圖2所示。在不銹鋼表面發(fā)現(xiàn)有大量的藍(lán)點(diǎn)(圖2a), 部分位置藍(lán)點(diǎn)極度聚集形成一片藍(lán)色光區(qū)(圖2b)。微生物已在不銹鋼表面形成較均勻的微生物膜。

圖2 實(shí)海全浸15天的不銹鋼鋼片表面附著微生物的熒光照片F(xiàn)ig.2 Fluorescence image of 316L stainless steel immersed in the sea for 15 days
2.1.3 X射線能譜分析結(jié)果 為了進(jìn)一步分析不銹鋼表面形成的生物膜, 分別對全浸海水之前和全浸海水之后的316L不銹鋼片進(jìn)行了X射線能譜分析(EDS), 結(jié)果如圖3所示。將全浸海水前、后EDS結(jié)果進(jìn)行對比, 結(jié)果如表1所示。結(jié)果發(fā)現(xiàn), 構(gòu)成生物體的基本元素C、O元素含量明顯增高, 并且發(fā)現(xiàn)了不銹鋼中不存在的P元素。另外, 在生物膜中未發(fā)現(xiàn)不銹鋼中存在的Mn元素和Mo元素。
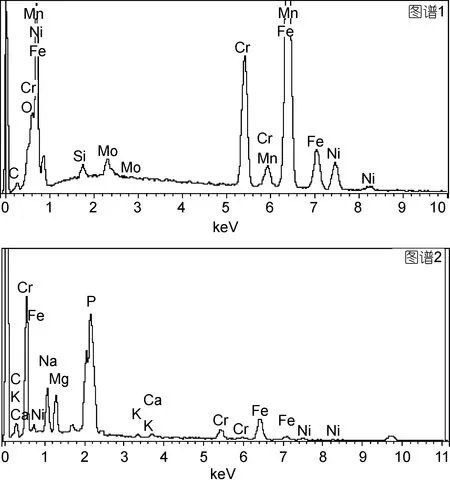
圖3 全浸海水前后的316L不銹鋼的局部能譜分析圖譜Fig.3 EDS graph of local area of 316L stainless steel before and after seawater immersion
2.2 細(xì)菌多樣性分析結(jié)果
從篩選的96個克隆子中獲得的RFLP帶型為47個, 經(jīng)測序所得序列經(jīng)3% cut off 后得到的OTU數(shù)為24, 其樣品覆蓋率C為88.2%, 香濃-威納指數(shù)H為3.81, 辛普森指數(shù)D為0.90, 均勻度J為0.83, 三個多樣性指數(shù)都比較高, 說明不銹鋼表面具有豐富的細(xì)菌多樣性。進(jìn)一步分析細(xì)菌16S rRNA基因文庫的Rarefaction稀釋度曲線(圖4)也表明當(dāng)克隆數(shù)在漸近于93時, 稀釋度曲線逐漸接近平臺期, 說明本研究建立的16S rRNA基因文庫基本能夠反映全浸不銹鋼中細(xì)菌的群落結(jié)構(gòu)。
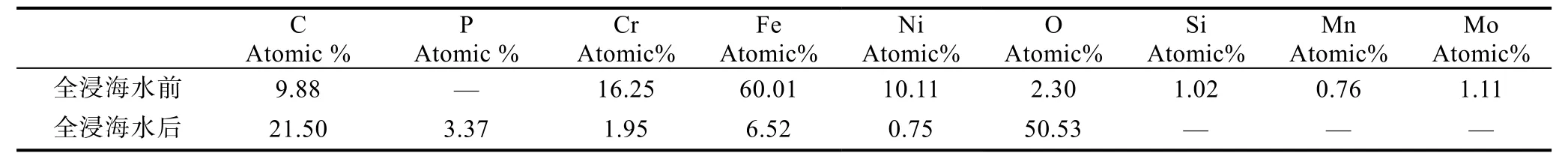
表1 316L不銹鋼基體與表面生物膜成分EDS分析結(jié)果Tab.1 Result of EDS analysis of 316L stainless steel with biofilm
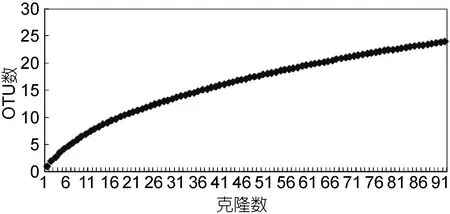
圖4 細(xì)菌16S rRNA克隆文庫稀釋度曲線分析Fig.4 Rarefaction curves of the bacteria 16S rRNA clones libraries
各門克隆數(shù)占總克隆數(shù)的比例, 如圖5所示。在不銹鋼表面占據(jù)絕對優(yōu)勢的是α-變形菌, 占到總克隆數(shù)的72.3%, 其中占據(jù)到絕對優(yōu)勢的單株菌是序列HSY.CS.25所代表的紅細(xì)菌科的一種暫時不可分離菌, 占到整個基因文庫的20.4%。同時在不銹鋼表面還有2.1%的γ-變形菌, 18.1%的ε-變形菌以及7.4%的擬桿菌。在整個文庫中所占比例超過10%的菌種還包括:Thalassobacter、Loktanellamaricol以及序列HSY.CS.1和38所代表的暫時不可分離菌, 其中前三者所占比例為10.8%, HSY.CS.38所占比例為14.0%。根據(jù)所得的24個OTU, 構(gòu)建不銹鋼表面附著微生物的系統(tǒng)發(fā)育進(jìn)化樹(圖6)。分析發(fā)現(xiàn)α-變形菌(Alphaproteobacteria)占到18個OTU數(shù), γ-變形菌(Gammaproteobacteria)占到了1個, 擬桿菌門(Bacteroidetes)占到了2個, ε-變形菌(Epsilonproteobacteria)占3個。

圖5 316L不銹鋼表面附著微生物中各分支菌占總菌數(shù)的比例Fig.5 Composition of clone library of the 316L stainless steel
經(jīng)過比對, α-變形菌中已知序列有7個, 分別為Thalassobius gelatinovorus,Pseudoruegeria aquimaris,Thalassobacter,Phaeobacter arcticus,Litoreibacterjanthinus,Loktanella maricola,Hoeflea alexandrii。其中前6者屬于紅桿菌目(Rhodobacterale)且均屬于紅桿菌科(Rhodobacteraceae)。僅有的一種γ-變形菌為Thiomicrospira crunogena。ε-變形菌中已知序列僅一種為Sulfurospirillum arcachonense。擬桿菌已知序列有兩種, 均屬于黃桿菌科(Flavobacteriaceae), 分別為Polaribacter、Dokdonia donghaensis。
3 討論
3.1 不銹鋼表面生物膜的形成
SEM分析結(jié)果表明, 隨著掛片時間的延長, 全浸于海水中的不銹鋼片表面細(xì)菌數(shù)量逐漸增加, 并且細(xì)菌胞外產(chǎn)物越來越厚, 與第1天相比, 全浸15天以后, 不銹鋼表面細(xì)菌大量聚集在一起, 并且有大量的細(xì)菌胞外物質(zhì)分布在細(xì)菌聚集區(qū)周圍。另外, 不銹鋼全浸15天以后, 經(jīng)DAPI染色, 在熒光顯微鏡下出現(xiàn)了大量藍(lán)點(diǎn)(圖2a), 說明不銹鋼表面有大量細(xì)菌附著, 片狀藍(lán)色區(qū)域(圖2b)的形成, 是由于大量細(xì)菌聚集在一處造成的。EDS分析結(jié)果發(fā)現(xiàn)構(gòu)成生物體的基本元素C元素和O元素含量明顯增加, 同時還有不銹鋼基體中不存在的P元素存在, 進(jìn)一步說明在不銹鋼表面存在大量微生物及其代謝產(chǎn)物。因此, 經(jīng)過15天實(shí)海全浸掛片, 316L不銹鋼表面已經(jīng)形成了較為豐富的由微生物及其代謝產(chǎn)物組成的生物膜。另外,根據(jù)不銹鋼SEM照片觀察, 作者發(fā)現(xiàn)在不銹鋼表面存在著不同形狀的細(xì)菌, 因此對316L不銹鋼表面生物膜進(jìn)行了進(jìn)一步的細(xì)菌多樣性分析。
3.2 細(xì)菌多樣性分析
根據(jù)結(jié)果, 作者發(fā)現(xiàn), 不銹鋼表面具有豐富的細(xì)菌多樣性, 其中α-變形菌門中的紅桿菌目為優(yōu)勢菌群。Thalassobius gelatinovorus是一種需氧的能動棒狀菌,具有氧化酶和過氧化酶活性(Muramatsuet al, 2007)。Phaeobacter arcticus是生長在2%—9%濃度NaCl條件下的一種需氧的能動桿狀菌, 具有過氧化氫酶和細(xì)胞色素酶活性(Zhanget al, 2008)。Loktanella maricola是一種附著在不銹鋼表面的需要低濃度NaCl才能生長的非能動桿狀菌(Yoonet al, 2007)。Litoreibacter janthinus和Pseudoruegeria aquimaris都是能在8% NaCl濃度下生長的異養(yǎng)非能動性桿狀需氧菌(Yoonet al, 2007; Lyudmilaet al, 2011)。
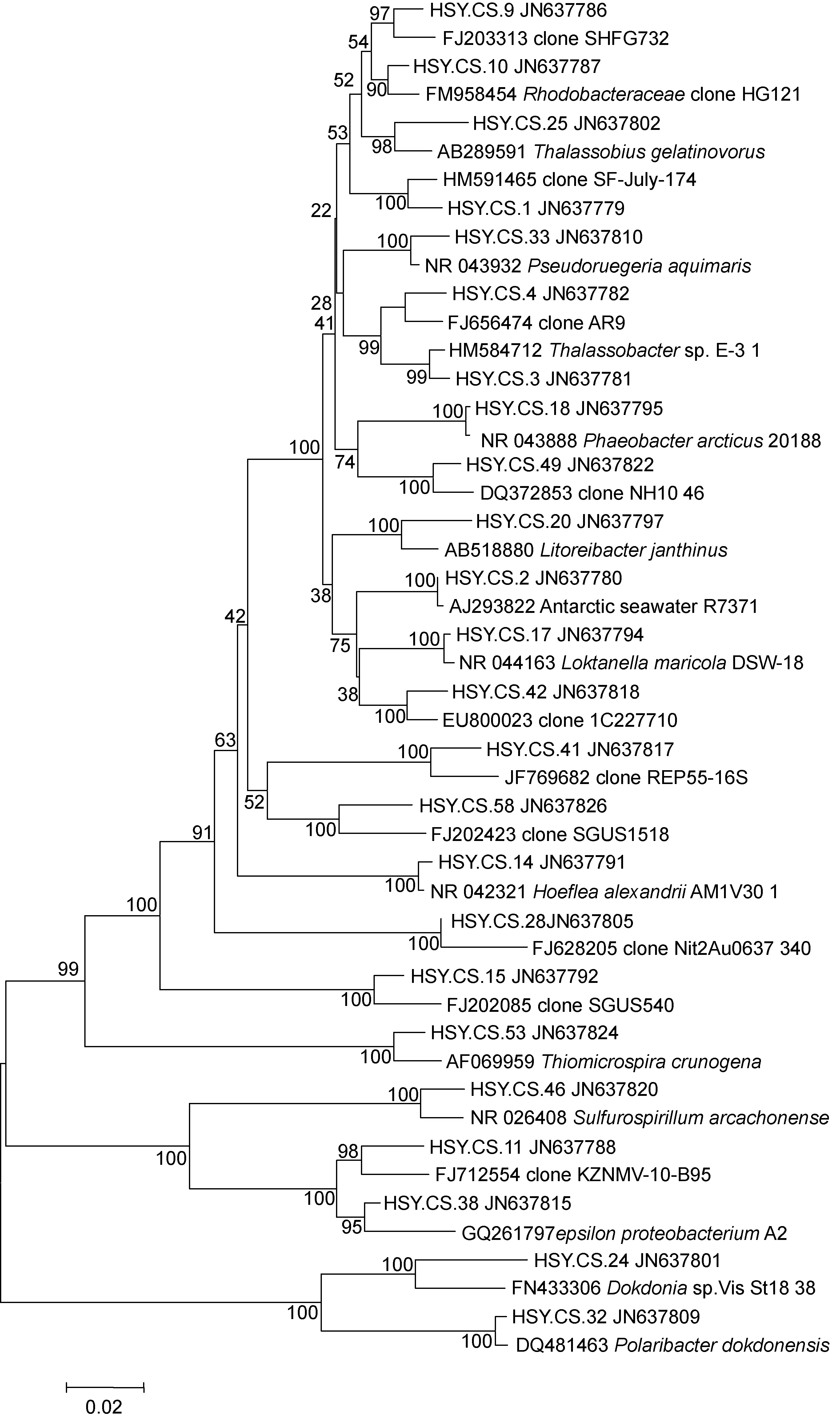
圖6 不銹鋼表面細(xì)菌系統(tǒng)發(fā)育分析Fig.6 Phylogenetic tree of the bacteria on surface of the stainless steel
在實(shí)海全浸初期不銹鋼316L表面還附著有一種重要的可以加速腐蝕的細(xì)菌Sulfurospirillum arcachonense, 這是一種微需氧的具有能動性的硫酸鹽還原菌, 是一種典型的金屬腐蝕菌, 在無氧條件下可以利用醋酸鹽生成氫和甲酸, 具有氧化酶, 過氧化酶和脲酶活性, 可以以元素硫作為電子受體, 生成 H2S(Finsteret al, 1997)。Thiomicrospira是不銹鋼表面存在的一種化能自養(yǎng)細(xì)菌, 它是一種能動的桿狀菌, 能降解含硫化合物, 如硫化物、硫代硫酸鹽以及元素硫,作為能量來源。它可以利用不銹鋼中的硫元素, 加速不銹鋼的腐蝕(Wirsenet al, 1998)。
Dokdoniasp.是廣泛存在于海洋中的一種沒有能動性的微嗜鹽的需氧異養(yǎng)菌, 屬于黃桿菌科, 它會附著在各種基質(zhì)的表面進(jìn)行生長(Lauraet al, 2007)。Hoeflea alexandrii也是存在于不銹鋼表面的一種好氧非共生菌, 可以依靠單極鞭毛運(yùn)動到達(dá)附著基質(zhì)表面,具有過氧化酶活性, 不能利用硝酸鹽, 但可以消耗生物膜內(nèi)其他微生物代謝產(chǎn)生的硝酸, 生成吲哚, 可以起到延緩不銹鋼腐蝕的作用(Luc?aet al, 2006)。
通過對已知細(xì)菌的分析發(fā)現(xiàn), 不銹鋼表面的細(xì)菌幾乎都是革蘭氏陰性菌, 其中60%以上的細(xì)菌具有能動性。作者對全浸海水15天不銹鋼表面細(xì)菌的種類研究發(fā)現(xiàn), 不銹鋼表面附著有大量的好氧細(xì)菌,其中包括一種抑制腐蝕的Hoeflea alexandrii菌, 這些細(xì)菌及其代謝產(chǎn)物的出現(xiàn)初步形成了一層生物膜,從而改變了界面的電化學(xué)性質(zhì), 起到抑制腐蝕的作用; 然而隨著生物膜厚度的增加, 氧氣的傳遞受到阻礙, 因此到達(dá)不銹鋼介質(zhì)表面的氧氣減少, 結(jié)果導(dǎo)致了厭氧細(xì)菌, 如Sulfurospirillu marcachonense的出現(xiàn),這些厭氧菌是重要的腐蝕性細(xì)菌, 從而會加速不銹鋼的腐蝕, 這可能是開路電位發(fā)生正移的一個重要原因。不銹鋼在天然海水中的耐腐蝕性先變大后變小,這與劉彬等(2012)研究結(jié)果相符。
4 結(jié)論
全浸15天的316L不銹鋼表面形成了豐富的由細(xì)菌及其代謝產(chǎn)物組成的生物膜, 并且根據(jù)SEM照片對附著細(xì)菌的形狀進(jìn)行初步觀察, 可以發(fā)現(xiàn)316L不銹鋼表面附著的細(xì)菌種類較多。全浸15天的316L不銹鋼表面生物膜具有豐富的細(xì)菌多樣性, 優(yōu)勢菌群為紅桿菌目, 并且還發(fā)現(xiàn)了一株對鋼鐵有腐蝕作用的硫酸鹽還原菌存在。
劉 彬, 段繼周, 侯保榮, 2012. 天然海水中微生物膜對316L不銹鋼腐蝕行為的研究. 中國腐蝕與防護(hù)學(xué)報(bào), 32(1):48—53
欒 鑫, 段繼周, 陳永偉等, 2013. 兩種船用防污涂層實(shí)海掛片表面細(xì)菌群落多樣性分析. 應(yīng)用與環(huán)境生物學(xué)報(bào), 19(3):471—477
黃宗國, 2008. 海洋污損生物及其防除(下冊). 北京: 海洋出版社, 187—218
Beech I B, Gaylarde C C, 1999. Recent advances in the study of biocorrosion-an overview. Revista de Microbiologia, 30:177—190
Dang H Y, Li T G, Chen M Net al, 2008. Cross-ocean distribution of rhodobacterales bacteria as primary surface colonizers in temperate coastal marine waters. Applied and Environmental Microbiology, 74(1): 52—60
Dickinson W H, Caccavo F, Lewandowski Z, 1996. The ennoblement of stainless steel by manganic oxide biofouling.Corrosion Science, 38(8): 1407—1422
Finster K, Liesack W, Tindall B J, 1997.Sulfurospirillum arcachonensesp. nov., a new microaerophilic sulfurreducing bacterium. International Journal of Systematic Bacteriology, 47(4): 1212—1217
Gomez-Consarnau1 L, Gonzalez J M, Coll-Llado M, 2007. Light stimulates growth of proteorhodopsin containing marine Flavobacteri. Nature, 445: 210—213
Jones P R, Cottrell M T, Kirchman D Let al, 2007. Bacterial community structure of biofilms on artificial surfaces in an estuary. Microbial Ecology, 53: 153—162
Jung-Hoon Y, So-Jung K, Soo-Young Let al, 2007.Loktanella maricolasp. nov., isolated from seawater of the East Sea in Korea. International Journal of Systematic and Evolutionary Microbiology, 57: 1799—1802
Lin W F, Yu Z S, Chen Xet al, 2013. Molecular characterization of natural biofilms from household taps with different materials: PVC, stainless steel, and cast iron in drinking water distribution system. Applied Microbiology and Biotechnology, 97: 8393—8401
Luc?a Palacios, David R Arahal, Beatriz Regueraet al, 2006. Hoeflea alexandriisp. nov., isolated from the toxic dinoflagellateAlexandrium minutumAL1V. International Journal of Systematic and Evolutionary Microbiology, 56: 1991—1995
Lyudmila A R, Naoto T, Galina M Fet al, 2011.Litoreibacteralbidusgen. nov., sp. nov. andLitoreibacter janthinussp. nov., members of the class Alphaproteobacteria isolated from the seashore. International Journal of Systematic and Evolutionary Microbiology, 61: 148—154
Motoda S, Suzuki Y, Shinohara Tet al, 1990. The effect of marinefouling on the ennoblement of electrode potential for stainless steels. Corrosion Science, 31: 515—520
Muramatsu Y K, Uchino Y, Kasai Het al, 2007.Ruegeria mobilissp. nov., a member of the Alphaproteobacteria isolated in Japan and Palau. International Journal of Systematic and Evolutionary Microbiology, 57: 1304—1309
Newman R C, Wong W P, Garner A, 1986. A mechanism of microbial pitting in stainless steel. Corrosion Science, 42(8):489—491
Palacios L, David R A, Reguera Bet al, 2006. Hoeflea alexandriisp. nov., isolated from the toxic dinoflagellateAlexandrium minutumAL1V. International Journal of Systematic and Evolutionary Microbiology, 56: 1991—1995
Washizu N, Katada Y, Kodama T, 2004. Role of H2O2in microbially influenced ennoblement of open circuit potentials for type 316L stainless steel in seawater. Corrosion Science, 46:1291—1300
Wirsen C O, Brinkhoff T, 1998. Comparison of a newThiomicrospirastrain from the mid-Atlantic ridge with known hydrothermal vent isolates. Applied and Enviromental Microbiology, 64(10): 4057—4059
Xu C M, Zhang Y H, Cheng G Get al, 2007. Localized corrosion behavior of 316L stainless steel in the presence of sulfate-reducing and iron-oxidizing bacteria. Materials Science and Engineering: A, 443(1—2), P 235—241
Xu C M, Zhang Y H, Cheng G Get al, 2008. Pitting corrosion behavior of 316L stainless steel in the media of sulphatereducing and iron-oxidizing bacteria. Materials Characterization, 59(3): P245—255
Yoon J H, Lee S Y, Kang S Jet al, 2007.Pseudoruegeria aquimarisgen. nov., sp. nov., isolated from seawater of the East Sea in Korea. International Journal of Systematic and Evolutionary Microbiology, 57: 542—547
Zhang D C, Li H R, Xin Y Het al, 2008.Phaeobacter arcticussp.nov., a psychrophilic bacterium isolated from the Arctic.International Journal of Systematic and Evolutionary Microbiology, 58: 1384—1387

