太平洋牡蠣(Crassostrea gigas)精液的超低溫保存研究*
韓龍江 黃 雯 劉清華① 紀利芹 張國范 李 軍① 溫海深
(1. 中國海洋大學水產學院 青島 266003; 2. 中國科學院海洋研究所 青島 266071;3. 中國科學院大學 北京 100049; 4. 海洋生態養殖技術國家地方聯合工程實驗室 青島 266071)
牡蠣精液冷凍保存已有幾十年的歷史(Hughes,1973; Zellet al, 1979; Bougrieret al, 1986; Douilletet al, 1994), 近年來, 國外有學者進行了一系列牡蠣種質保存相關方面的研究, 取得了比較不錯的效果, 部分成功應用到生產實踐中(Gwo, 1995; 張巖等, 2004;Adamset al, 2004, 2009; Tervitet al, 2005; Songet al,2009; Suquetet al, 2012)。但其降溫過程大多采用在液氮面以上一定高度停留一段時間的辦法控制降溫速率進行降溫, 其穩定性較差(Yanksonet al, 1991;李赟等, 2002; Usukiet al, 2002; Donget al, 2006;Salinas-Floreset al, 2008), 另外, 由于解凍后精液的運動率、受精率、孵化率較差(Donget al, 2007), 冷凍方法仍待優化。在我國, 太平洋牡蠣(Crassostrea gigas)主要分布于山東及遼寧地區, 是我國養殖十分廣泛的優良品種。近年來, 隨著養殖規模的不斷擴大,對太平洋牡蠣種質的需求也不斷提高(董曉偉等,2004; 張躍環等, 2012)。開展太平洋牡蠣精液的超低溫冷凍保存技術的研究, 建立健全我國太平洋牡蠣的種質庫, 對維持種質資源的穩定具有重要意義: 太平洋牡蠣精液超低溫保存可以使精液的長距離運輸得以實現, 有利于貝類的雜交、選育, 有利于太平洋牡蠣優良性狀的保持及其基因多樣性的保護。本實驗成功篩選出了穩定可靠的太平洋牡蠣精液的冷凍保存方法: 篩選了多種抗凍劑、稀釋液、添加劑和稀釋比例等影響冷凍精液活力的因素; 采用程序降溫儀來控制降溫速率; 借助計算機來輔助分析精液活力。效果穩定可靠, 尤其是通過將凍融后精液與卵子進行人工授精, 測定其受精率、孵化率來驗證了結果的可靠性。通過實驗, 測定冷凍后精子受精率、孵化率可達到90%以上, 與鮮精差異不顯著, 成功的應用于500個大規模家系的構建實驗等大型項目中, 證明該方法冷凍的太平洋牡蠣的精液可以滿足科研和生產的需要。
1 材料與方法
1.1 太平洋牡蠣的采集
實驗所用的太平洋牡蠣于性成熟季節(2013年7月)購自青島嶗東海珍品良種培育有限公司, 殼高9.0—11.2cm, 殼寬5.5—6.0cm, 數量120只。暫養于中國科學院海洋研究所海洋貝類增養殖與生物技術實驗室100L水族箱內, 暫養期間水溫16—18°C, 每天換水一次, 實驗時選擇性腺飽滿的雄性牡蠣, 解剖后取精液, 放入50mL離心管里, 置于4°C冰箱, 備用。
1.2 精液活力的檢測
檢測精液活力: 載玻片上滴加100μL海水, 吸取5μL精液與其混勻后迅速置于顯微鏡下觀察, 隨機取6個視野鏡檢, 通過計算機輔助精液分析(computerassisted sperm analysis, CASA)統計運動率, 得平均值,運動率高于90%的精液樣品帶回實驗室進行冷凍保存。精液運動率為一個視野內快速運動精子數目占全部精子數目的百分比。
1.3 抗凍保護液的配制
配制三種稀釋液: 無鈣HBSS (Hanks, 1975)和過濾海水(FSW), 以這三種稀釋液為基礎液, 分別稀釋甘油(GLY)、二甲亞砜(DMSO)、丙二醇(PG)、乙二醇(EG)、甲醇(MeOH)、二甲基乙酰胺(MDA)六種抗凍保護劑成6%、8%、10%、12%、14% (V/V)濃度, 于4°C冰箱內預冷備用。
1.4 實驗設計
1.4.1 抗凍保護劑種類對太平洋牡蠣精液冷凍保存的影響 將收集到50mL離心管的精液與預先配好的五種抗凍液[HBSS溶液為稀釋液, 將五種抗凍保護劑稀釋到濃度10% (V/V)并添加有0.45mol/L的海藻糖]按1︰4的比例混裝于2mL的凍存管中, 裝入程序降溫儀(Kryo-360-1.7, UK)中, 采用分步降溫程序B (0°C開始, –15°C /min降溫至–60°C, 平衡2min, 然后以–20°C /min降溫至–150°C, 平衡5min后將凍存管投入到液氮中)降溫, 完成后將凍存管分裝于凍存盒中保存, 37°C水浴解凍檢測凍精活力。
1.4.2 抗凍劑濃度對太平洋牡蠣精液冷凍保存效果的影響 以HBSS溶液為稀釋液, 將抗凍保護劑DMSO稀釋成的6%、8%、10%、12%和14%五種濃度梯度, 添加0.45mol/L的海藻糖后與精液按4︰1(抗凍液︰精液)的比例稀釋, 分裝于2mL的凍存管中,搖勻后置于4°C的冰箱中平衡20min, 然后裝入程序降溫儀(Kryo-360-1.7, UK), 按分步降溫程序B降溫,結束后分裝于凍存盒中保存, 37°C水浴解凍, 檢測凍精活力。
1.4.3 三種稀釋液對精液冷凍效果的影響 用DMSO作為抗凍保護劑, 分別用HBSS溶液、人工海水(ASW)、過濾海水(FSW)稀釋成10%的濃度, 添加0.45mol/L的海藻糖, 精液和抗凍液按1︰4比例加入到2mL凍存管中, 搖勻后置于4°C的冰箱中平衡20min, 然后裝入程序降溫儀(Kryo-360-1.7, UK), 按分步降溫程序B降溫, 結束后分裝于凍存盒中保存,37°C水浴解凍, 檢測凍精活力。
1.4.4 精液與抗凍液稀釋比例對太平洋牡蠣精液冷凍保存效果的影響 用HBSS溶液將DMSO稀釋成10%的濃度, 并添加0.45mol/L的海藻糖, 精液和抗凍液分別按1︰1、1︰2、1︰4、1︰6的稀釋比例加入到2mL凍存管中, 搖勻后置于4°C的冰箱中平衡20min, 然后裝入程序降溫儀(Kryo-360-1.7, UK), 按分步降溫程序B降溫, 結束后分裝于凍存盒中保存,37°C水浴解凍, 檢測凍精活力。
1.4.5 不同降溫程序對精液冷凍保存效果的影響 用DMSO作為抗凍保護劑, 用HBSS溶液稀釋成10%(V/V)的濃度, 添加0.45mol/L的海藻糖, 精液和抗凍液按1︰4比例加入到2mL凍存管中, 搖勻后置于4°C的冰箱中平衡20min, 然后裝入程序降溫儀(Kryo-360-1.7, UK)中分別按分步降溫程序A (0°C開始,–10°C/min降溫至 –60°C, 平衡2min, 然后以–20°C/min降溫至–150°C, 平衡5min后將凍存管投入到液氮中)、程序B (0°C開始, –15°C /min降溫至–60°C, 平衡2min, 然后以–20°C /min降溫至–150°C, 平衡5min后將凍存管投入到液氮中)、程序C (0°C開始,–20°C/min降溫至–60°C, 平衡2min, 然后以–20°C/min降溫至–150°C, 平衡5min后將凍存管投入到液氮中),分裝于凍存盒中, 37°C水浴解凍, 檢測凍精活力。
1.4.6 抗凍添加劑對精液冷凍效果的影響 用DMSO作為抗凍保護劑, 用HBSS溶液稀釋成10%(V/V)的濃度, 分別添加0.45mol/L的葡萄糖、蔗糖和海藻糖作為添加劑, 精液和抗凍液按1︰4比例加入到2mL凍存管中, 搖勻后置于4°C的冰箱中平衡20min, 然后裝入程序降溫儀(Kryo-360-1.7, UK)按分步降溫程序B降溫, 結束后分裝于凍存盒中保存,37°C水浴解凍, 檢測凍精活力。
1.4.7 受精率和孵化率的測定 分別取鮮精、DMSO作為抗凍保護劑, 用HBSS溶液稀釋成10%的濃度, 添加0.45mol/L的葡萄糖, 精液和抗凍液按1︰3比例加入到2mL凍存管中, 搖勻后置于4°C的冰箱中平衡20min, 裝入程序降溫儀凍存前和程序B凍存后的三組精液與新鮮解剖的卵子進行人工授精, 測定其受精率和孵化率, 具體操作為: 鮮精、程序冷凍前和程序冷凍后的精子與卵子按精卵比100︰1混合于20°C過濾海水(混合前卵子在過濾海水中活化30min, 精液在過濾海水中活化5min)。2h后取受精卵(100個以上)統計受精率; 授精后14h統計孵化率。受精率指開始分裂的牡蠣受精卵占總總卵量的百分比; 孵化率指發育至D形幼蟲的胚胎與受精卵的百分比。實驗設3個重復。
1.4.8 統計分析 數據采用Spss17.0統計軟件包中的單因素方差分析(ANOVA)和Duncan氏多重范圍比較進行分析,P<0.05表示有顯著差異, 所有結果均以平均值±標準差表示。
2 結果
2.1 抗凍劑種類對太平洋牡蠣精液冷凍保存效果的影響
不同的抗凍劑種類對精液的保存效果見圖1。由圖1可以看出, 在抗凍液濃度10% (V/V)的五種抗凍劑中, 10% DMSO+組精液運動率最高, 達到71.53%±1.00%, 顯著高于其它抗凍劑種類(P<0.05), 10GLY+次之(56.20%±5.77%), 以下依次為PG (32.13%±2.60%)、EG (27.93%±2.32%)、DMA (22.73%±3.61%)。
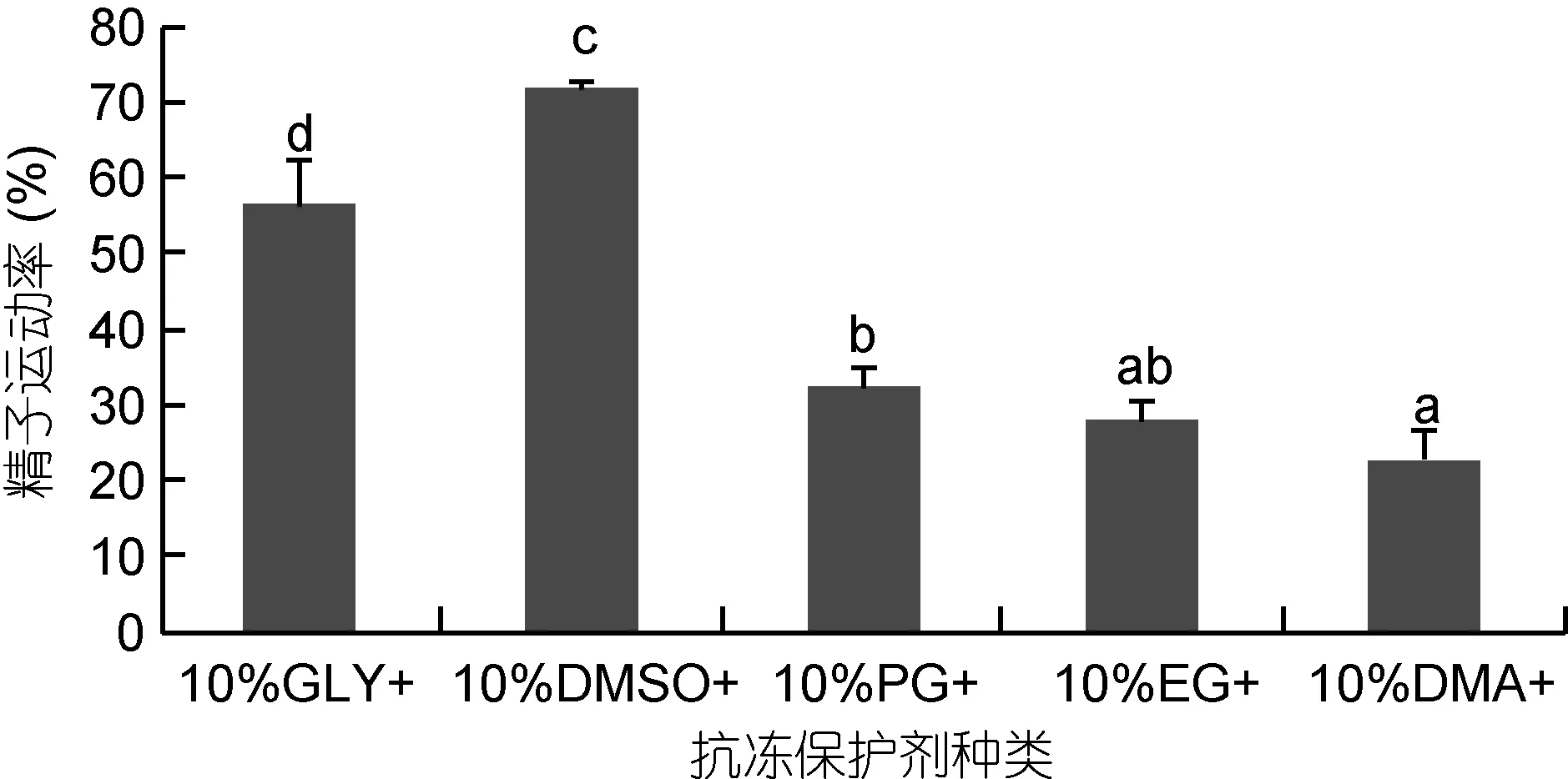
圖1 抗凍劑種類對太平洋牡蠣精液冷凍保存效果的影響Fig.1 The effect of different antifreeze protectants on C. gigas sperm cryopreservation
2.2 抗凍劑濃度對太平洋牡蠣精液保存效果的影響
不同體積分數DMSO抗凍保護液的保存效果見圖2。由圖2可以看出, 在6%、8%、10%、12%和14%五種濃度梯度中, 不同體積分數的DMSO處理組, 精液運動率明顯不同, 當DMSO濃度為6%時,超低溫保存精液運動率為43.75%±3.43%, 濃度為8%時, 精液運動率為47.77%±2.45%, 10%濃度下凍存精液的運動率達到最高值71.53%±1.00%, 顯著高于與其它濃度下的精液運動率(P<0.05), 但當濃度大于10%時, 凍存精液的運動率開始明顯下降, 當濃度為12%時, 精液運動率為60.47%±1.80%, 當濃度為14%時, 精液運動率為42.83%±2.79%。隨著DMSO濃度的升高, 精液運動率呈現先升高后降低的趨勢。
2.3 稀釋液種類對太平洋牡蠣精液保存效果的影響
不同稀釋液對精液冷凍的影響見圖3。由圖3可以看出, 以人工海水(ASW)、過濾海水(FSW)、HBSS溶液為稀釋液冷凍保存太平洋牡蠣精液, 不同稀釋液中的精液存活率差異顯著(P<0.05); 其中, 以HBSS溶液為稀釋液的精液存活率最高, 達到71.53%±1.00%, 其次是過濾海水47.43%±2.97%, 最后是人造海水, 僅為24.90%±3.35%)。
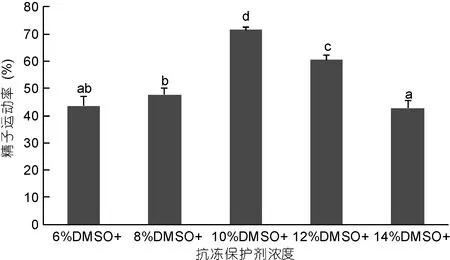
圖2 抗凍劑濃度對太平洋牡蠣精液保存效果的影響Fig.2 The effect of different antifreeze protectants concentration on C. gigas sperm preservation
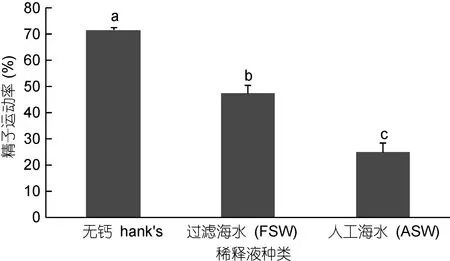
圖3 稀釋液種類對太平洋牡蠣精液冷凍保存效果的影響Fig.3 The effect of different diluent on C. gigas sperm cryopreservation
2.4 不同稀釋比例對太平洋牡蠣精液保存效果的影響
不同稀釋比例對精液運動率的影響見圖4。由圖4可知, 精液和抗凍液按1︰1、1︰2、1︰4、1︰6四種稀釋比例中, 隨著精液濃度的降低, 太平洋牡蠣精液的運動率呈現先上升后下降的趨勢, 各不同稀釋比例之間差異顯著: 在1︰1的稀釋比例時, 精液運動率達到22.93%%±3.27%; 在1︰2的稀釋比例時,精液運動率達到49.60%±3.60%; 在1︰4的稀釋比例時, 精液運動率達到最大值71.53%±1.00%, 與其它各組差異顯著(P<0.05); 在1︰6的稀釋比例時, 精液運動率達到59.60%±2.44%。
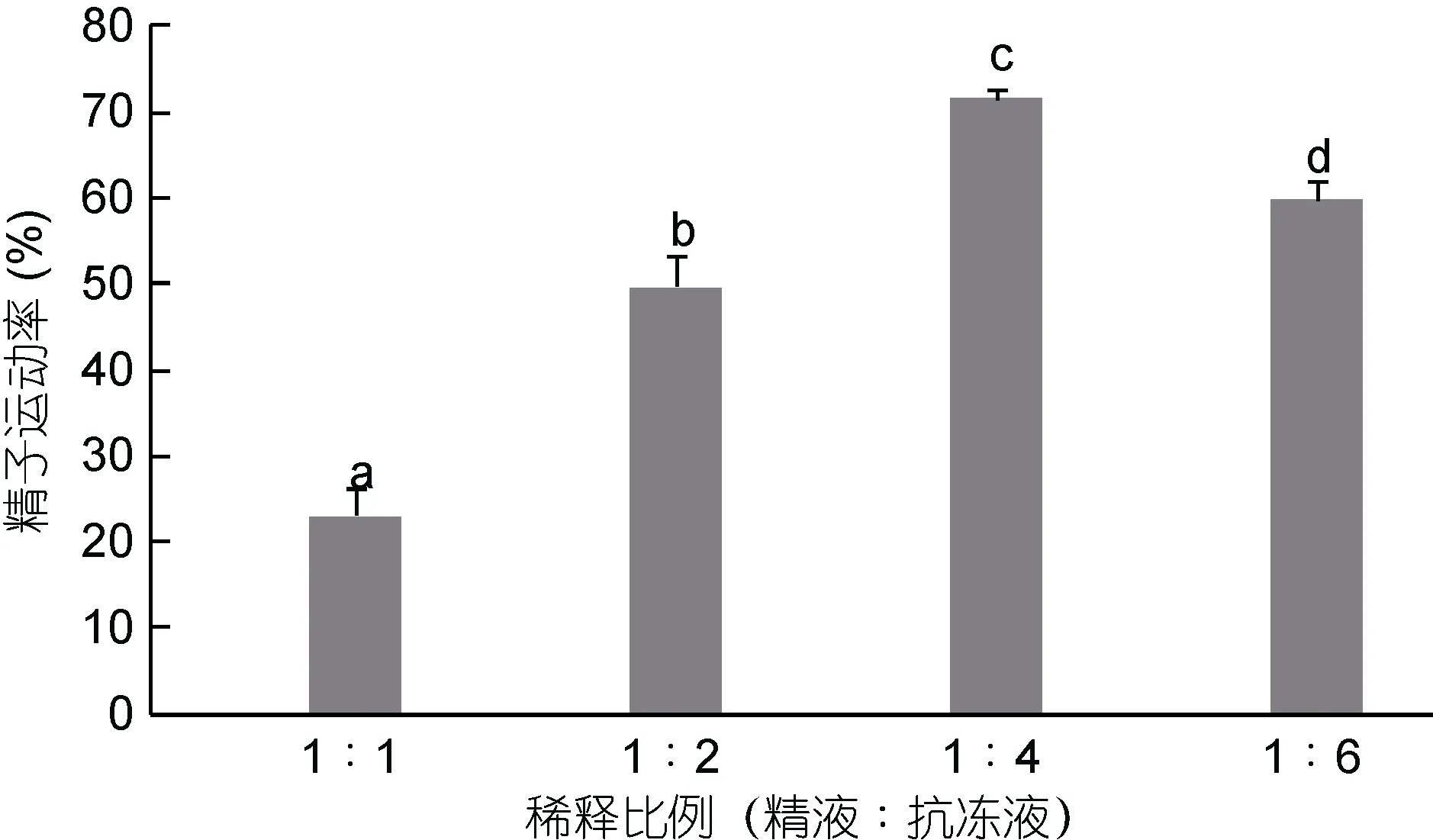
圖4 不同稀釋比例對太平洋牡蠣精液冷凍保存效果的影響Fig.4 The effect of different diluent ratio on C. gigas sperm cryopreservation
2.5 不同添加劑對太平洋牡蠣精液保存效果的影響
不同添加劑對太平洋牡蠣精液冷凍保存效果見圖5。由圖5可知, 添加0.45mol/L的葡萄糖、蔗糖、海藻糖作為添加劑的各處理組中, 含0.45mol/L海藻糖組精液運動率最高, 達到(71.53%±1.00%), 顯著高于蔗糖組(56.47%±5.22%)、葡萄糖組(49.57%±5.14%)的精液運動率。
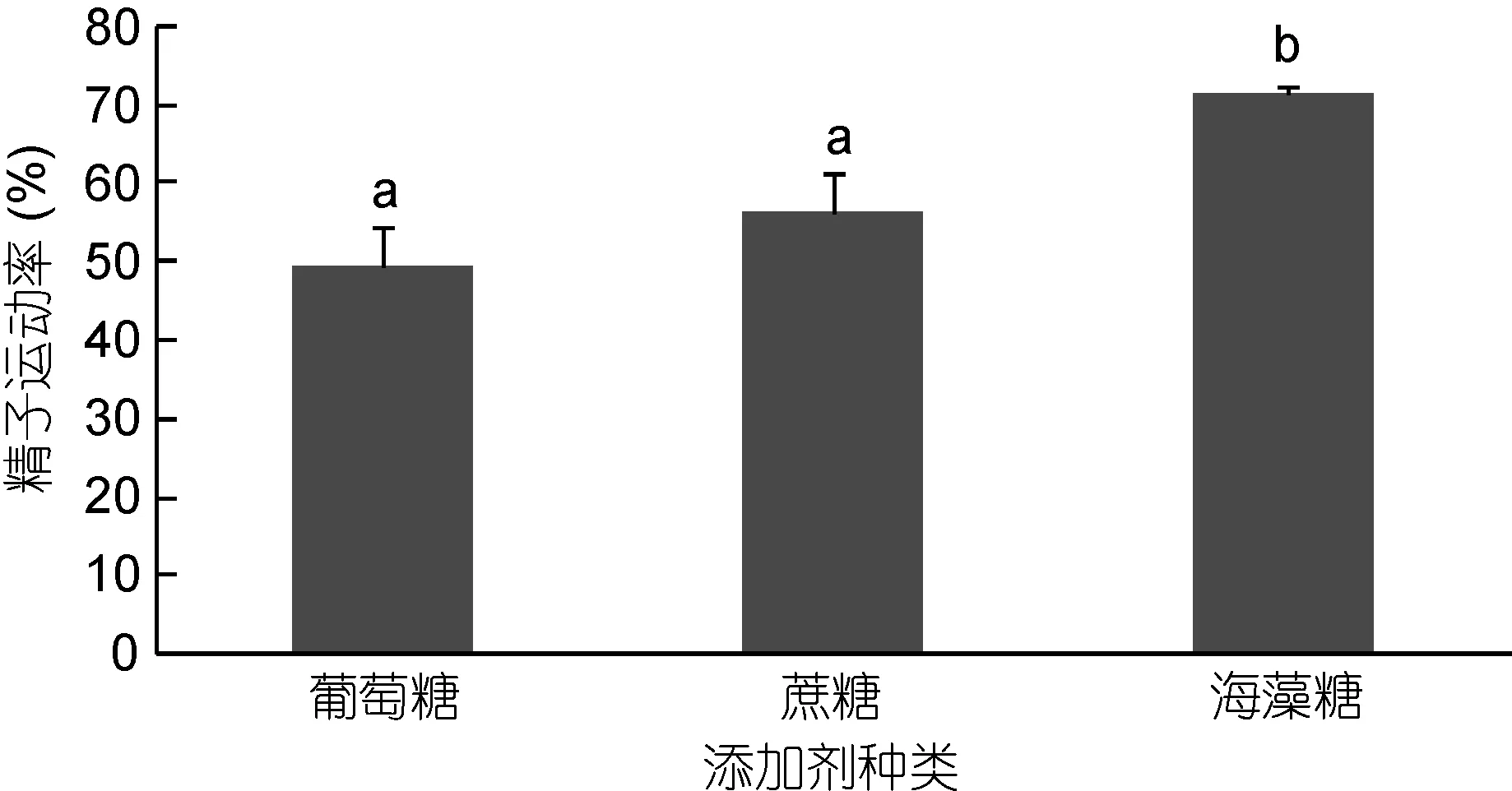
圖5 不同添加劑對太平洋牡蠣精液冷凍保存效果的影響Fig.5 The effect of different additives on C. gigas sperm cryopreservation
2.6 不同降溫程序對太平洋牡蠣精液保存效果的影響
不同降溫程序對太平洋牡蠣精液冷凍保存效果見圖6。由圖6可知, 采用分步降溫程序A、分步降溫程序B、分步降溫程序C三種降溫程序冷凍保存太平洋牡蠣精液, 程序B精液運動率最高(71.53%±1.00%),與程序A (68.17%±4.68%)差異不顯著(P>0.05), 與程序C (53.93%±7.41%)差異顯著(P<0.05)。
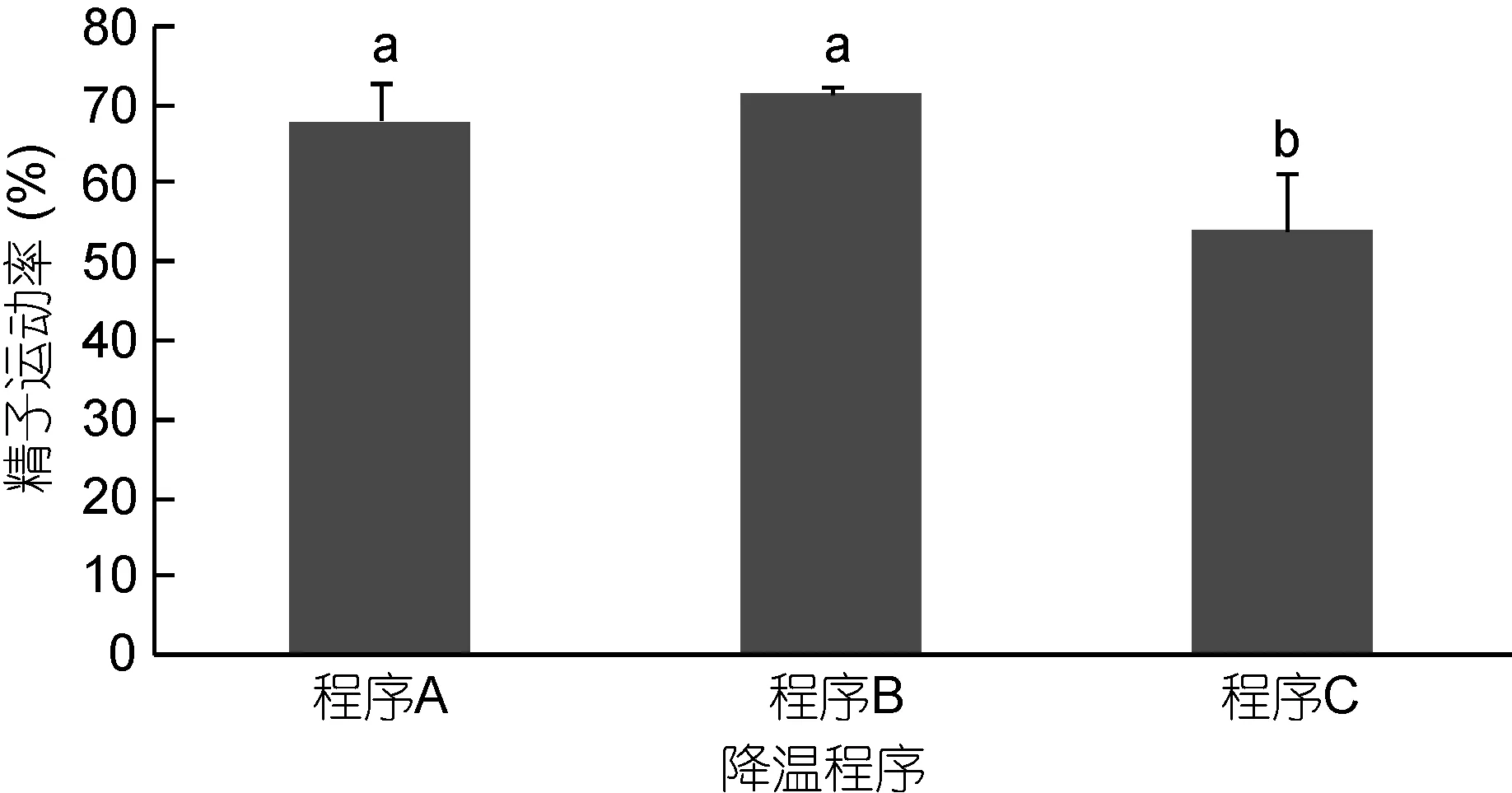
圖6 不同降溫程序對太平洋牡蠣精液冷凍保存效果的影響Fig.6 The effect of different cooling process on C. gigas sperm cryopreservation
2.7 太平洋牡蠣精液超低溫保存對受精率和孵化率的影響
精液超低溫保存對精液受精率和孵化率的影響見圖7。由圖7可知, 鮮精、凍存前和凍存后三組精液與新鮮解剖的卵子進行受精實驗(鮮精做對照), 結果表明: 經超低溫保存的精液與未經超低溫保存的精液相比, 受精率和孵化率沒有明顯差異(P>0.05)。表明經超低溫保存的精液仍具有正常的受精能力。鮮精、凍存前和凍存后精液受精率達到95%左右, 各組之間差異不顯著(P>0.05), 其中冷凍前精液受精率最高, 達到95.96%±2.15%, 其次是冷凍后精液, 達到95.04%±1.99%, 鮮精受精率略低(94.90%±0.95%);鮮精、冷凍前精液和冷凍后精液的孵化率達到90%左右, 各組之間差異不顯著(P<0.05), 其中冷凍后精液孵化率最高, 達到93.33%±1.33%, 其次是冷凍前精液,達到92.67%±14.83%, 鮮精孵化率略低(88.89%±15.16%)。授精能力和孵化率與鮮精無差異(P<0.05)。
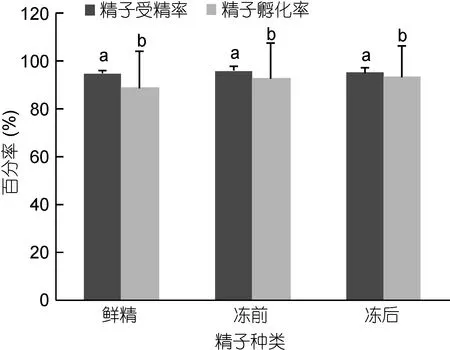
圖7 太平洋牡蠣精液超低溫保存對受精率和孵化率的影響Fig.7 The effect of C. gigas sperm cryopreservation on fertilization rate and hatching rate
3 討論
3.1 不同抗凍劑種類對太平洋牡蠣精液保存效果的影響
抗凍保護劑主要通過改變精液細胞耐滲透壓及細胞內離子濃度, 保護精液免受溫度變化過程中的損傷(Donget al, 2007)。不同的抗凍保護劑由于其滲透能力、水活性等各不相同, 對精液冷凍保存效果亦有差異。貝類精液保存的抗凍保護劑常用的有GLY、DMSO、PG、EG、METH、MDA等(Adamset al, 2004;孫振興等, 2005)。DMSO具有分子小, 毒性低, 易滲入細胞, 分布均勻等特征。Dong等(2007)發現2.5%—15%的DMSO可以適度改進太平洋牡蠣精液的運動率; 余祥勇等(2005)的研究發現體積分數10%—12%的DMSO可對馬氏珠母貝(Pinctada martensi)的精液有較好的抗凍保護作用; DMSO對蝦夷扇貝(Patinopecteny essoensis)精液的保護作用明顯高于GLY和MET(楊培民等, 2007, 2008)。 本研究中, 采用10% DMSO的冷凍保存太平洋牡蠣精液效果最好:DMSO組70%以上精子存活, 表明在其它因素一定的條件下, DMSO是太平洋牡蠣最優抗凍保護劑, 這是由DMSO作為抗凍保護劑所具有的滲透速度快、滲透力強、親水性好、毒性小的特性所決定的。本實驗結果發現, 在太平洋牡蠣精液冷凍保存中選用DMSO作為冷凍保護劑效果最好。
3.2 不同抗凍劑濃度對太平洋牡蠣精液保存效果的影響
不同貝類精液的最適抗凍保護劑濃度是不同的。抗凍液通過增加細胞質的粘滯度和降低冰點等作用起到對精液的低溫保護, 隨著抗凍液濃度的增加, 精液的保護作用加強; 但是由于抗凍液本身所具有的毒性又是其使用量的限制因子(Nascimentoet al,2005)。例如櫛孔扇貝(Chlamys farreri)精液在5%—10% DMSO中具有很高活力, 但濃度升高時精液活力大幅度下降(李純等, 2000)。有研究表明, 不同種類、不同濃度的冷凍保護劑對各個發育期胚胎的毒性不同(Usukiet al, 2002)。本研究表明, 凍存的太平洋牡蠣精液運動率隨著濃度的上升呈現先上升后下降的趨勢, 低濃度的DMSO由于其滲透作用差, 因而精液運動率低; 高濃度下DMSO隨著濃度的增大毒害作用明顯增大。DMSO對太平洋牡蠣精液既有抗凍保護作用又具一定的毒性, 需要篩選出一個適宜濃度,既能起到良好的抗凍作用, 又不會導致精液損傷。結果顯示, 濃度為10%的DMSO對精液冷凍的保護作用最好。
3.3 不同稀釋液對太平洋牡蠣精液保存效果的影響
稀釋液是保存精液的基礎環境, 不同物種所使用的稀釋液不同。稀釋液是否合適, 不僅影響冷凍保存的效果, 也會影響受精率、孵化率以及胚胎發育等。稀釋液可分為天然的和人工配制的兩種, 貝類精液冷凍保存采用的天然稀釋液一般為過濾海水, 這是由于多數貝類受精過程是在海水中進行, 海水符合大部分精液滲透壓、pH的要求(丁兆坤等, 2013)。但海水的理化性質隨水域、季節甚至天氣變化而變化,又考慮到精液原生質的pH和滲透壓通常比海水低,人工配制的稀釋液目前應用日益廣泛, HBSS溶液和人工海水作為稀釋液, 在很多貝類物種取得了有較好的保存效果(Yanget al, 2012)。本實驗以過濾海水、HBSS溶液和人工海水為稀釋液冷凍保存太平洋牡蠣精液, 在篩選稀釋液的過程中發現, 以海水為稀釋液的凍存精液活力普遍低, HBSS溶液精液運動率明顯高于其它兩種稀釋液。這是由于太平洋牡蠣作為變滲動物, 其精液在高鹽水域、高滲的外部環境中會對精液造成脫水等損害, 使精液活力降低。HBSS溶液與過濾海水、人工海水為稀釋液冷凍保存太平洋牡蠣精液差異顯著, HBSS溶液對精液的保存效果明顯好于其它兩種稀釋液, 表明HBSS溶液為太平洋牡蠣精液冷凍保存最優稀釋液。
3.4 不同稀釋比例對太平洋牡蠣精液保存效果的影響
精液在抗凍液中的濃度對精液冷凍保存具有顯著的影響, 不同物種間精液濃度不同。由于太平洋牡蠣解剖取精液, 精液濃度高, 因此篩選一種適宜的稀釋比例既能夠使其充分滲透保護細胞, 又能夠盡可能多的保存精液。本研究結果表明, 當解剖精液與抗凍液按1︰4的比例稀釋時, 精液冷凍取得最好的結果, 研究發現, 1︰4的比例下, 太平洋牡蠣精液既能充分滲透, 又不會因精液濃度過稀致毒死亡。因此,該比例為太平洋牡蠣最佳稀釋比例。
3.5 不同添加劑對太平洋牡蠣精液保存效果的影響
添加劑又稱非滲透性抗凍劑, 多為糖類或蛋白,特征是分子量較大, 不容易透過細胞膜, 比較常見的有葡萄糖、海藻糖、聚乙烯比咯烷酮、抗凍蛋白等。其作用主要是通過提高精子細胞外的滲透壓以減少冰晶的形成(Salinas-Floreset al, 2008)。貝類精液凍存中常會添加海藻糖、葡萄糖、蔗糖等添加劑, 有研究發現, 海藻糖對香港牡蠣(Crassostrea hongkongensis)精液凍存有正面作用(丁兆坤等, 2013)。因此, 本研究在抗凍劑中添加海藻糖、蔗糖、葡萄糖, 以探究三種不同添加劑對牡蠣精液凍存效果的影響, 結果發現海藻糖顯著提高精液冷凍保存, 可見在太平洋牡蠣精液的超低溫冷凍保存中, 添加海藻糖凍存效果好。
3.6 不同降溫速率對太平洋牡蠣精液保存效果的影響
降溫速率對太平洋牡蠣精液超低溫保存具有顯著影響(Choiet al, 2003)。不同物種之間精液大小、細胞膜的滲透性、體積大小、生理特性及生態環境的不同, 致使其精液的抗逆性也不盡相同。過慢或過快的冷卻速率都會導致細胞的損傷: 當降溫速度過慢時,細胞會長期處于高滲環境失去水分, 產生滲透休克帶來傷害; 當降溫速率過快時, 細胞內水分來不及滲出, 胞內容易形成冰晶, 刺破細胞膜和細胞器致細胞破損死亡(張軒杰, 1987)。適宜的降溫速率既能避免細胞長時間處于高滲環境中又能使細胞適當脫水,提高滲透壓, 有效防止冰晶對精液細胞造成的損傷(Ieropoliet al, 2004)。降溫速率控制多采用液氮面上一定距離停留一定時間來達到, 該方法操作簡便, 費用低廉, 應用十分廣泛, 但是由于液氮容器規格的不同, 該法無法取得精準的降溫速率, 數據間的可比性差, 冷凍保存精液效果往往不理想。通過程序降溫儀控制溫度的變化, 溫度控制精確, 可以有效地減少冰晶對細胞的損傷, 并且試驗重復性。本實驗采用程序降溫儀控制降溫速率表明, 在冰晶易生區(0—–40°C), 當降溫速率在-15°C /min時, 凍精活力最高, 而–20°C /min的降溫速率對凍融精液運動率影響較大, –10°C /min的降溫速率與–15°C /min的降溫速率差異不大, 結果表明–15—–10°C /min的降溫速率均為太平洋牡蠣精液的適宜降溫速率。
3.7 太平洋牡蠣精液超低溫冷凍對受精率和孵化率的影響
判定精液冷凍保存效果最重要的一個因素是通過授精實驗檢測其受精率、孵化率: 楊培民等(2008)發現, 冷凍90天內蝦夷扇貝精液活力沒有發生顯著變化, 扇貝與櫛孔扇貝之間無論是正交和反交均能正常授精, 與各自交組無明顯差別。本試驗證實了太平洋牡蠣的凍精、凍前和鮮精與牡蠣卵子人工授精,受精率和孵化率間無顯著差異, 均能發育至D形幼蟲。但是太平洋牡蠣精液的超低溫保存導致精子運動能力的下降, 超微結構分析表明, 精液細胞膜和細胞器有一定損傷(結果待發表)。因此, 對太平洋牡蠣精液冷凍保存細胞膜及DNA的損傷需進一步研究(Paniagua-Chávezet al, 2006)。
丁兆坤, 朱豪磊, 楊春玲等, 2013. 不同稀釋液對香港牡蠣精子冷凍的保存效果. 水生態學雜志, 34(3): 67—74
李 純, 李 軍, 薛欽昭, 2000. 櫛孔扇貝精子的超低溫保存研究. 海洋水產研究, 21(1): 57—62
李 赟, 王品虹, 賀桂珍等, 2002. 太平洋牡蠣精液的超低溫保存. 青島海洋大學學報(自然科學版), 32(2): 207—211
楊培民, 楊愛國, 劉志鴻等, 2007. 蝦夷扇貝精子的冷凍保存及其雜交試驗應用研究. 上海水產大學學報, 16(4): 351—356
楊培民, 楊愛國, 劉志鴻等, 2008. 蝦夷扇貝精子形態結構和超低溫冷凍損傷的電鏡觀察. 海洋水產研究, 29(1): 98—102
余祥勇, 王梅芳, 陳鋼榮等, 2005. 馬氏珠母貝精子低溫保存主要影響因素的研究. 華南農業大學學報, 26(3): 96—99
張 巖, 陳四清, 于東祥等, 2004. 海洋貝類配子及胚胎的低溫冷凍保存. 海洋水產研究, 25(6): 73—78
張軒杰, 1987. 魚類精液超低溫冷凍保存研究進展. 水產學報,9(3): 259—267
張躍環, 王昭萍, 閆喜武等, 2012. 太平洋牡蠣與近江牡蠣的種間雜交. 水產學報, 36(8): 1215—1224
董曉偉, 姜國良, 李立德等, 2004. 牡蠣綜合利用的研究進展.海洋科學, 28(4): 62—65
Adams S L, Smith J F, Roberts R Det al, 2004. Cryopreservation of sperm of the Pacific oyster (Crassostrea gigas):development of a practical method for commercial spat production. Aquaculture, 242: 271—282
Adams S L, Tervit H R, McGowan L Tet al, 2009. Towards cryopreservation of GreenshellTMmussel (Perna canaliculus)oocytes. Cryobiology, 58: 69—74
Bougrier S, Rabenomanana L D, 1986. Cryopreservation of spermatozoa of the Japanese oyster,Crassostrea gigas.Aquaculture, 58: 277—280
Choi Y H, Chang Y J, 2003. The influence of cooling rate,developmental stage, and the addition of sugar on the cryopreservation of larvae of the pearl oysterPinctada fucata martensii. Cryobiology, 46: 190—193
Dong Q, Huang C, Eudeline Bet al, 2006. Systematic factor optimization for sperm cryopreservation of tetraploid Pacific oysters,Crassostrea gigas. Theriogenology, 66: 387—403
Dong Q, Huang C, Eudeline Bet al, 2007. Cryoprotectant optimization for sperm of diploid Pacific oysters by use of commercial dairy sperm freezing facilities. Aquaculture, 271:537—545
Douillet P A, Langdon C J, 1994. Use of a probiotic for the culture of larvae of the Pacific oyster (Crassostrea gigasThunberg). Aquaculture, 119: 25—40
Gwo J C, 1995. Cryopreservation of oyster (Crassostrea gigas)embryos. Theriogenology, 43: 1163—1174
Hanks J H, 1975. Hanks' balanced salt solution and pH control.Methods in Cell Science, 1: 3—4
Hughes J B, 1973. An examination of eggs challenged with cryopreserved spermatozoa of the American oyster,Crassostrea virginica. Cryobiology, 10: 342—344
Ieropoli S, Masullo P, Santo M D Eet al, 2004. Effects of extender composition, cooling rate and freezing on the fertilisation viability of spermatozoa of the Pacific oyster(Crassostrea gigas). Cryobiology, 49: 250—257
Nascimento I A, Leite M B N L, Sampaio de Araújo M Met al,2005. Selection of cryoprotectants based on their toxic effects on oyster gametes and embryos. Cryobiology, 51:113—117
Paniagua-Chávez C G, Jenkins J, Segovia Met al, 2006.Assessment of gamete quality for the eastern oyster(Crassostrea virginica) by use of fluorescent dyes. Cryobiology,53: 128—138
Salinas-Flores L, Adams S L, Lim M H, 2008. Determination of the membrane permeability characteristics of Pacific oyster,Crassostrea gigas, oocytes and development of optimized methods to add and remove ethylene glycol. Cryobiology, 56:43—52
Song Y P, Suquet M, Quéau Iet al, 2009. Setting of a procedure for experimental fertilisation of Pacific oyster (Crassostrea gigas) oocytes. Aquaculture, 287: 311—314
Suquet M, Le Mercier A, Rimond Fet al, 2012. Setting tools for the early assessment of the quality of thawed Pacific oyster(Crassostrea gigas) D-larvae. Theriogenology, 78: 462—467
Tervit H R, Adams S L, Roberts R Det al, 2005. Successful cryopreservation of Pacific oyster (Crassostrea gigas)oocytes. Cryobiology, 51: 142—151
Yankson K, Moyse J, 1991. Cryopreservation of the spermatozoa ofCrassostrea tulipaand three other oysters. Aquaculture,97: 259—267
Zell S R, Bamford M H, Hidu H, 1979. Cryopreservation of spermatozoa of the American oyster,Crassostrea virginicaGmelin. Cryobiology, 16: 448—460

