金槍魚(Katsuwonus pelamis)碎肉蛋白降壓肽的酶解制備及活性研究*
張 朋 賀卯蘇 遲長鳳① 王 斌
(1. 浙江海洋學院海洋科學與技術學院 國家海洋設施養殖工程技術研究中心 舟山 316022;2. 浙江海洋學院食品與醫藥學院 浙江省海洋生物醫用制品重點工程技術研究中心 舟山 316022)
血管緊張素轉換酶(ACE)是一種分子量為15kDa膜結合糖蛋白, 當人體循環或者局部組織中ACE活性過高, 會促使血管緊張素I (十肽, 由腎素轉化而來)的肽鏈C末端的組氨酸和亮氨酸殘基水解形成具有增壓作用的血管緊張素II (八肽), 同時促進具有促血管舒張作用的緩激肽P物質的水解, 導致血壓升高。因此, 尋找合適物質, 抑制體內ACE的活性, 即可達到降低血壓的目的。目前, 血管緊張素轉化酶抑制劑(ACEI)是一類發展迅速的抗高血壓藥物, 如含巰基(–SH)或硫基(–SR)類的卡托普利(Captopril), 含羧基(–COOH)類的依那普利(Enalapril), 以及含次膦酸基(–POO–)類的福辛普利(Fosinopril)等。此類化學合成藥物在應用過程中常引起患者咳嗽、味覺異常、粒細胞減少、皮疹、發熱等不良反應, 給患者帶來較強的不適感。與化學合成的ACEI相比較, 通過酶解食源性蛋白質獲得的ACE抑制活性肽(ACEP)具有顯著優點, 主要體現在: (1) 安全性高, 無毒副作用; (2) 原料來源廣, 制備條件溫和, 易于產業化; (3) 降壓效果專一, 易于消化吸收。因此, 選擇合適的蛋白酶在體外降解蛋白資源, 研究和開發出具有降血壓作用的活性肽食品或藥物, 成為研究的熱點(Liuet al, 2013)。
目前, 已經成功地從多種水產資源中獲得了ACEP。如徐懷德等(2008)利用堿性蛋白酶水解甲魚蛋白獲得具有ACE抑制作用的酶解物, 其對ACE的體外抑制率為99.96%。于婭等(2004)以牡蠣為原料制備的短肽在0.4 mg/mL時的ACE抑制率為51.4%。戴志遠等(2009)利用酶解和Sephadex G-50柱層析從河蚌酶解物中得到2個分子質量分別為14.1 (MPP1)和12.7 kDa (MPP2)的組分, 其對ACE抑制作用的IC50分別為0.88和0.32 mg/mL。Fujita等(1999)利用嗜熱菌蛋白酶水解鯉魚得到6種降壓肽, 分別為IY、IKP、LKP、IWH、LKPNM和IWHHT, 均能明顯降低原發性高血壓大鼠的血壓, ACE抑制活性的IC50值分別為2.31、6.9、0.32、3.5、2.4和5.8μmol/L。Enari等(2008)酶解鮭魚蛋白獲得降壓肽IW, ACE抑制活性檢測顯示其IC50值為1.2μmol/L。Jae等(2004)利用胃蛋白酶酶解鱈魚蛋白, 利用色譜技術制備降壓肽FGASTRGA, ACE抑制活性檢測顯示其IC50值為14.7μmol/L。Liu等(2013)利用胃蛋白酶和木瓜蛋白酶水解水母蛋白, 利用色譜技術制備降壓肽QPGPT和GDIGY, ACE抑制活性檢測顯示其IC50值分別為80.67和32.56μmol/L。Lee等(2014)利用胰蛋白酶酶解, 色譜制備, 從大馬哈魚魚皮酶解物中制備降壓肽GLPLNLP, ACE抑制活性檢測顯示其IC50值為18.7μmol/L。
金槍魚(Katsuwonus pelamis)是世界遠洋漁業的重要作業魚種之一, 年產量超過600萬噸, 占公海漁業總產量70%以上(羅紅宇等, 2013; Shyniet al,2014)。在金槍魚加工過程中產生的碎肉、魚頭、魚皮和魚骨等下腳料約占總重量的50%—70%。研究發現金槍魚碎肉中粗蛋白含量很高, 是良好的蛋白質來源(杜帥等, 2013; 譚洪亮等, 2014)。然而, 我國金槍魚下腳料的加工利用不盡如人意, 90%以上仍然作為飼料原料或初級飼料利用, 造成了金槍魚資源的大量浪費, 也給生態環境帶來了較大壓力(杜帥等,2013)。因此, 高效的利用金槍魚下腳料資源具有重要的意義。因此, 本實驗以金槍魚碎肉蛋白為原料進行ACEP的研發, 不僅會為高血壓疾病的治療提供候選藥物, 還將為金槍魚下腳料的綜合利用提供一條可行的途徑。
1 材料與方法
1.1 樣品、試劑與儀器
金槍魚(Katsuwonus pelamis)碎肉由寧波豐盛食品有限公司提供。Sephadex G-25購于安發瑪西亞生物技術公司, 堿性蛋白酶購于上海源聚生物科技有限公司, 色譜純乙腈購于賽默飛世爾科技(中國)有限公司, 其他試劑為分析純, 購于上海國藥集團化學試劑有限公司。
Agilent 1260高效液相色譜儀(美國安捷倫公司);U-2800紫外可見分光光度計(日本日立集團); Anke TDL-40B離心機(上海安亭科技儀器廠); HD 21C-A核酸蛋白檢測儀(上海康華生化儀器制造有限公司);DS-1高速組織搗碎機(上海精密儀器儀表有限公司);SC-15超級恒溫槽(寧波江南儀器廠)。
1.2 實驗方法
1.2.1 金槍魚碎肉酶解物的制備 稱取金槍魚碎肉100g, 加入pH 10.0的甘氨酸 –NaOH緩沖液500 mL,于組織搗碎機內均質5 min, 用1mol/L HCl和NaOH將該混和物調pH至設定數值, 得混和液。將混合液溫度升至預定溫度攪拌預熱, 并于攪拌狀態下保溫20 min; 然后加入預定量的堿性蛋白酶(酶活力≥1.9×104U/g), 在設定的時間下完成酶解之后, 放入95—100°C水浴15 min, 對酶滅活, 滅活液在4°C、4500 r/min離心30 min, 取上清液真空濃縮后冷凍干燥, 得酶解物(TPAP), 并于–20°C低溫保存。
根據正交試驗確定堿性蛋白酶水解金槍魚碎肉蛋白的工藝條件。L9(34)正交試驗設計因素和水平見表1。
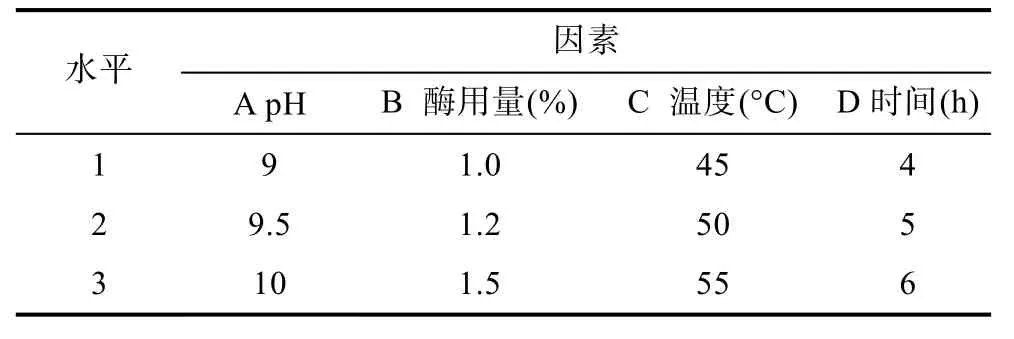
表1 正交實驗中酶解條件的因素水平表Tab.1 The factors and levels of enzymatic hydrolysis conditions
1.2.2 D101大孔吸附樹脂對金槍魚碎肉蛋白酶解物的脫鹽工藝研究
(1) D101大孔吸附樹脂對TPAP的靜態吸附及解析實驗 取 2.5 g預先處理的D101大孔樹脂加入到250 mL具塞錐形瓶中, 用無水乙醇充分溶脹樹脂,去離子水洗凈無水乙醇, 再加入質量濃度為10 mg/mL的TPAP溶液150mL, 將錐形瓶放入25°C恒溫搖床振蕩12 h, 按照設定時間取樣。選擇水、30%乙醇、50%乙醇、75%乙醇和無水乙醇作為洗脫劑, 對已吸附TPAP并達到飽和的D101大孔樹脂解吸24 h, 洗脫, 按下式計算樹脂的吸附率、吸附量和解吸率。
吸附率(%) = [(原液濃度–吸附液濃度)/原液濃度]×100
吸附量(mg/g) = (原液濃度–吸附液濃度)×溶液體積/干樹脂質量
解吸率(%) = {(解吸液濃度×解吸液體積)/[(原液濃度–吸附液濃度)×吸附液體積]}×100
(2) D101大孔吸附樹脂對TPAP的動態吸附及解吸實驗 在室溫條件下, ① 質量濃度為10 mg/mL的TPAP分別以0.8 BV/h、1.5 BV/h、3 BV/h的流速經過層析柱; ② 質量濃度為 5 mg/mL、10 mg/mL和20 mg/mL的TPAP分別以1.5 BV/h的流速經過層析柱, 用紫外檢測流出液的A220, 以A220= 0.05為透過點, 比較不同流速和濃度的穿透體積和吸附量。
1.2.3 超濾分級 TPAP用截留分子量為3 kDa和1 kDa的超濾膜超濾分級, 得三個組分: TPAP-I (MW> 3kDa)、TPAP-II (3kDa > MW >1kDa)和TPAP-III(MW < 1 kDa)。
1.2.4 Sephadex G-25凝膠過濾層析 取500.0 mg的TPAP-III溶于5 mL雙蒸水中, 加入到預先平衡的Sephadex G-25凝膠柱(2.6×80cm)上, 用蒸餾水以1 mL/min的速度洗脫, 每5 min收集一管, 并于220 nm檢測吸光度, 按峰合并, 得5個組分(TPAP-III-1—5)。
1.2.5 TPAP-III-4的反相高效液相色譜(RP-HPLC)分析 TPAP-III-4經RP-HPLC分析為一個峰。RPHPLC條件為: 色譜柱Zorbax, SB C-18 (4.6×250mm,5μm, Agilent, USA); 流速1 mL/min; 檢測波長220 nm;流動相: 乙腈/水梯度洗脫; 柱溫25°C。
1.2.6 ACE抑制率試驗 紫外分光光度法參照Cushmand(1971)和經Toriki(1993)改進的方法檢測金槍魚碎肉蛋白酶解物、超濾分段部位、Sephadex G-25分段部位的ACE抑制率。
量取0.25 mL反應液(K3PO4100 mmol/L, pH 8.3;NaCl 300 mmol/L; 馬脲酰組氨酰亮氨酸(HHL)5 mmol/L)加入到試管中, 依次加入1 mL樣品溶液(對照組加雙蒸水), 0.15 mL ACE溶液(5 mmol/L)于反應液中, 37°C水浴保溫30 min。加入1 mol/L的HCl 0.25 mL, 充分攪拌以終止反應。加入1.5 mL乙酸乙酯, 充分攪拌萃取反應生成的馬尿酸, 收集上清液。將上清液于100°C水浴加熱約20 min, 以蒸發掉乙酸乙酯, 然后加入3 mL蒸餾水, 充分振蕩, 228 nm下測其吸光值。根據各酶解液反應值與空白樣品對照, 計算所得樣品的ACE抑制率。計算公式為:
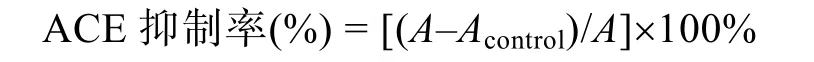
式中,A為添加1mL樣品時的吸光值;Acontrol為1mL蒸餾水代替1mL樣品時的吸光值。
2 結果與分析
2.1 金槍魚碎肉蛋白酶解物的制備工藝研究
影響蛋白酶解效果的因素主要有pH、反應溫度、酶和底物濃度比(E/S)、酶解時間、底物濃度等, 并且不同因素之間還存在交互作用(Pihlanto-lepp?l?, 2001;Ranathungaet al, 2006)。本實驗在預實驗的基礎上,以pH、酶用量、酶解溫度、酶解時間為考察因素, 每個因素各取3個水平, 并以ACE抑制率為考察指標進行L9(34)正交試驗, 結果見表2。
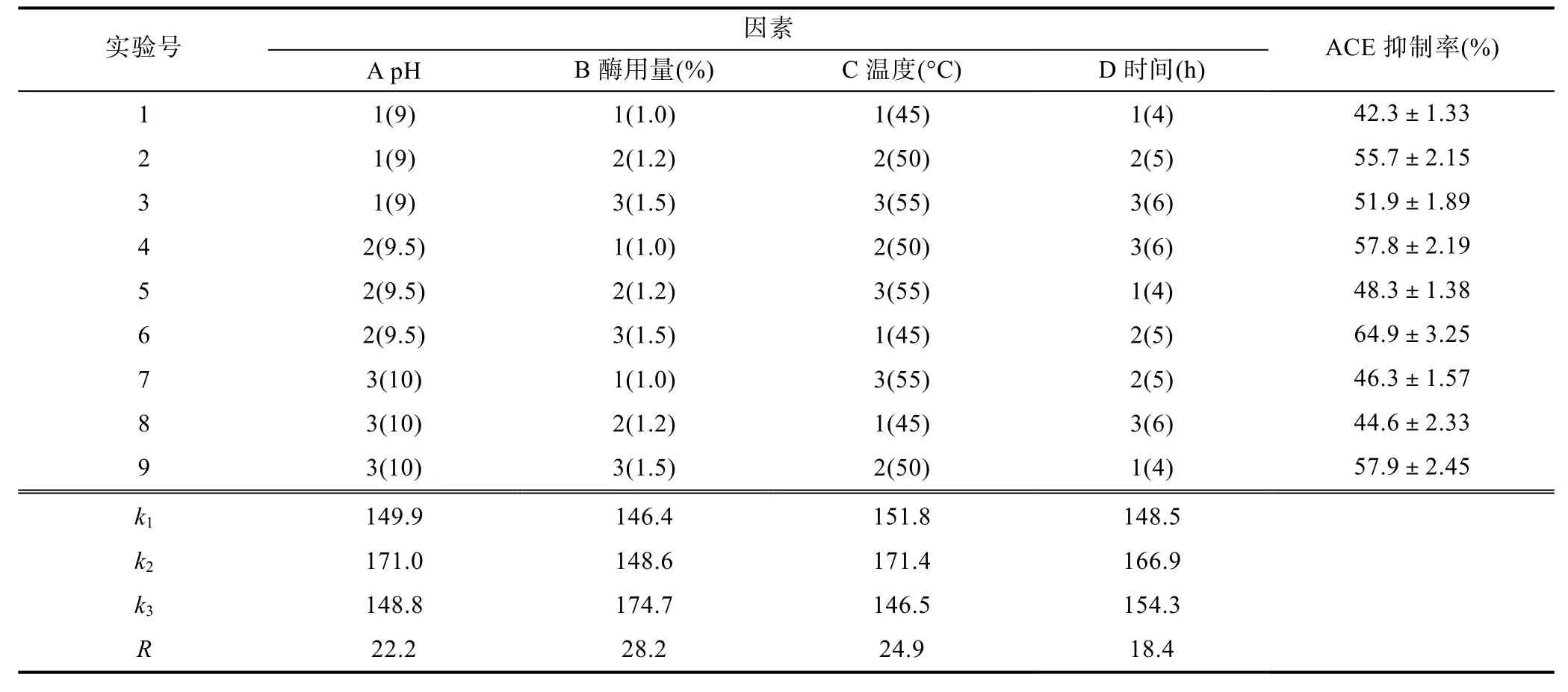
表2 堿性蛋白酶酶解金槍魚碎肉蛋白制備降壓肽的正交實驗結果(n=3, c=10mg/mL)Tab.2 Orthogonal array design matrix L9(34) and experimental results for optimized the enzymolysis conditions of alcalase(n=3, c=10mg/mL)
從極差R值可以看出, 各因素對堿性蛋白酶酶解金槍魚碎肉蛋白的影響程度依次為B>C>A>D, 即酶用量是優化條件中影響最大的因素, 酶解時間的影響最小, 最佳酶解工藝條件為A2B3C2D2, 即pH 9.5,酶用量1.5%, 酶解溫度50°C, 酶解時間5 h。按A2B3C2D2條件進行3次平行試驗, 酶解物在10 mg/mL的濃度下的ACE抑制率達到71.43%±5.19%。
2.2 金槍魚碎肉蛋白酶解物的脫鹽工藝研究
2.2.1 大孔吸附樹脂對金槍魚碎肉蛋白酶解物的靜態吸附能力 D101大孔吸附樹脂對金槍魚碎肉蛋白酶解物靜態的吸附率和吸附量隨時間的變化規律如圖1和圖2所示。結果表明: 靜態吸附過程中, 2h內的吸附率和吸附量增加非常迅速, 而2h后吸附率和吸附量增加明顯趨緩, 吸附平衡時的吸附率為88.11%±4.25%, 吸附量為(228.5±8.5)mg/g。
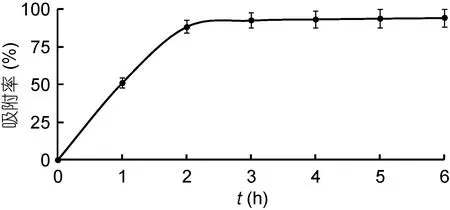
圖1 D101大孔吸附樹脂對金槍魚碎肉蛋白酶解物吸附率隨時間的變化(n=3)Fig.1 Absorption rate of D101 macroporous adsorption resin at varying time (n=3)
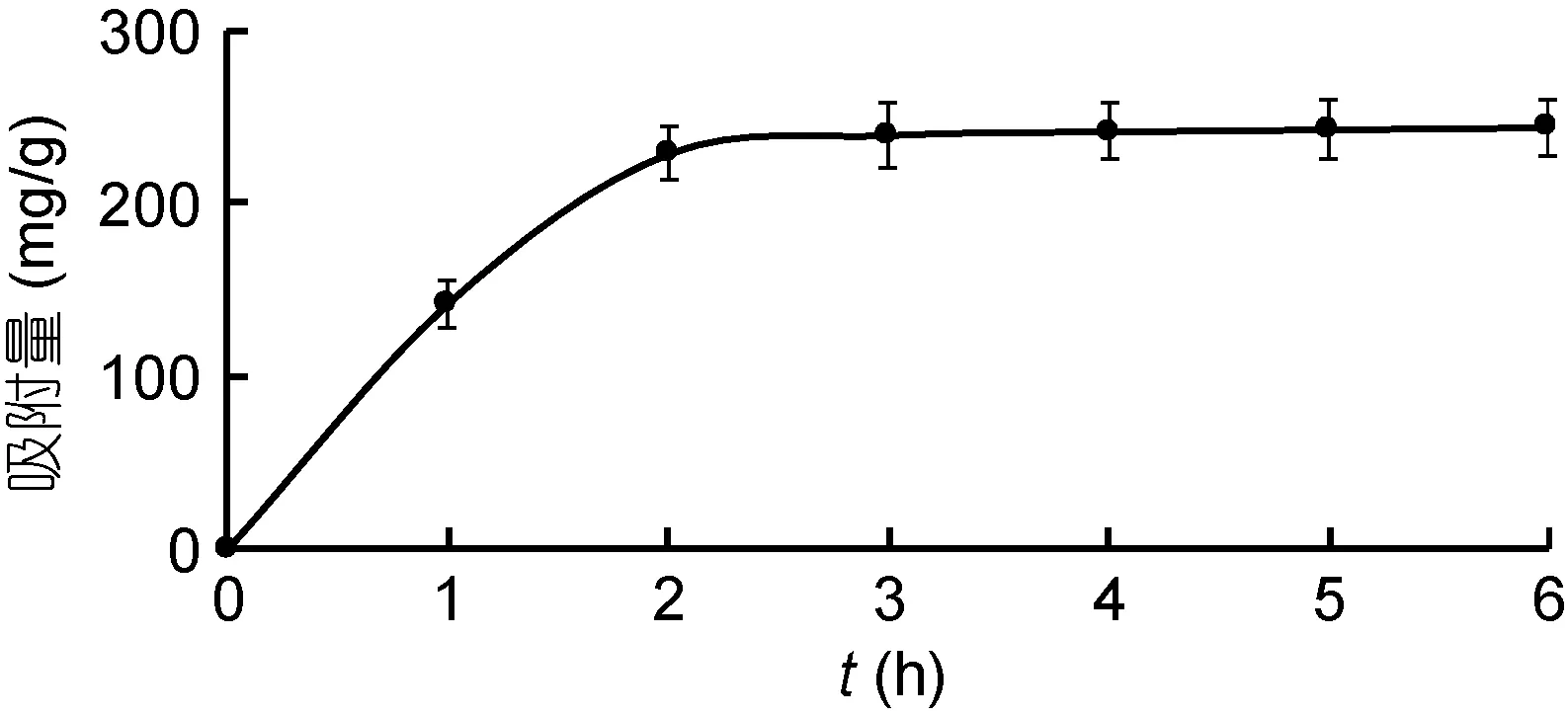
圖2 D101大孔吸附樹脂對金槍魚碎肉蛋白酶解物吸附量隨時間的變化(n=3)Fig.2 Absorption capacity of D101 macroporous adsorption resin at varying time (n=3)
2.2.2 D101大孔吸附樹脂對金槍魚碎肉蛋白酶解物的靜態解析 表3結果表明: 所選解析液中,水的解吸率最低, 只有15.27%±1.23%; 而乙醇/水的解吸率隨乙醇體積分數的增加而逐漸增大, 75%乙醇的解吸率可達到87.44%±3.29%, 但當采用無水乙醇時, 解吸率較75%乙醇有所下降, 為82.83%±4.38%。原因可能是部分分子量較大的金槍魚碎肉蛋白酶解物在無水乙醇中溶解性較差, 導致解吸率下降。

表3 不同解吸劑對金槍魚碎肉蛋白酶解物的解吸效果(n=3)Tab.3 Effect of different eluents on desorbing protein hydrolysate of tuna ground meat from D101 macroporous adsorption resin (n=3)
2.2.3 流速對D101大孔吸附樹脂動態吸附性能的影響 流速主要影響溶質向樹脂表面的擴散, 從而決定了固定床動態吸附效率。不同流速對D101大孔吸附樹脂的穿透點體積和吸附量影響如表4所示。結果表明: 酶解物流速從0.8 BV/h、1.5 BV/h增加到3.0 BV/h時, 穿透點體積從(28.33±1.13)mL、(24.57±2.17)mL下降到(19.45±1.36)mL, 減小了31.3%; D101大孔吸附樹脂對酶解物的吸附量也從(7.31±0.41)mg/g、(6.41±0.25)mg/g下降到(4.17±0.32)mg/g, 下降了43.0%。
實驗結果表明: 隨著酶解物流速的增加, 吸附速率也逐漸增大, 穿透點明顯提前, 但D101樹脂對酶解物的吸附量明顯降低。因此, 金槍魚碎肉蛋白酶解物經過D101大孔吸附樹脂的流速確定為1.5 BV/h。

表4 不同流速時金槍魚碎肉蛋白酶解物溶液的穿透點體積和吸附量(n=3)Tab.4 Volume of breakthrough point and adsorption capacity at different flow rates (n=3)
2.2.4 質量濃度對大孔吸附樹脂動態吸附性能的影響 金槍魚碎肉蛋白酶解物溶液質量濃度(5, 10,20mg/mL)對D101大孔吸附樹脂穿透點體積和吸附量的影響如表5所示: 隨著酶解物質量濃度的增加,穿透點體積從(26.75±1.59)mL、(20.47±1.24)mL變化為(15.32±1.08)mL, 說明D101吸附樹脂隨著樣品質量濃度的增加, 吸附達到飽和的時間逐漸縮短, 樹脂易于達到飽和。樹脂對高濃度的酶解物具有高的吸附量, 酶解物濃度10mg/mL比5mg/mL時的吸附量增加了4.10 mg/g; 而20 mg/mL時的吸附量比10 mg/mL時增加了2.34 mg/g, 隨著酶解物質量濃度的增加, 樹脂的吸附量逐漸達到最大值。因此, 確定酶解物經過D101大孔吸附樹脂的質量濃度為10 mg/mL。

表5 不同質量濃度金槍魚碎肉蛋白酶解物溶液的穿透點體積和吸附量(n=3)Tab.5 Volume of breakthrough point and adsorption capacity at different concentrations of protein hydrolysate of tuna ground meat (n=3)
2.2.5 金槍魚碎肉蛋白酶解物脫鹽制備及ACE抑制率 根據上述結果, 確定金槍魚碎肉蛋白酶解物脫鹽的工藝條件為: 上樣質量濃度10mg/mL、上樣流速1.5 BV/h、解吸劑75%乙醇。在該工藝條件下對金槍魚碎肉蛋白酶解物進行脫鹽, 收集的洗脫液經真空濃縮和冷凍干燥后得到酶解物, 得率為65.35%±3.05%。結果表明, 脫鹽后的金槍魚碎肉蛋白酶解物在10 mg/mL濃度下的ACE抑制活性從71.43%±5.19%增加到81.76%±4.38%, 脫鹽效果良好。
2.3 金槍魚碎肉蛋白酶解物的超濾分級
金槍魚碎肉蛋白酶解物(TPAP)用截留分子量為3 kDa和1 kDa的超濾膜超濾分級, 得三個組分: TPAP-I(MW > 3kDa)、TPAP-II (3kDa > MW >1kDa)和TPAPIII (MW < 1kDa)。如圖3所示: 在5 mg/mL濃度下,TPAP-I、TPAP-II和TPAP-III的ACE抑制率分別為65.38%±3.53%、85.81%%±2.85%和96.33%±3.07%。TPAP-III的活性高于總酶解物及其他超濾分段部位。
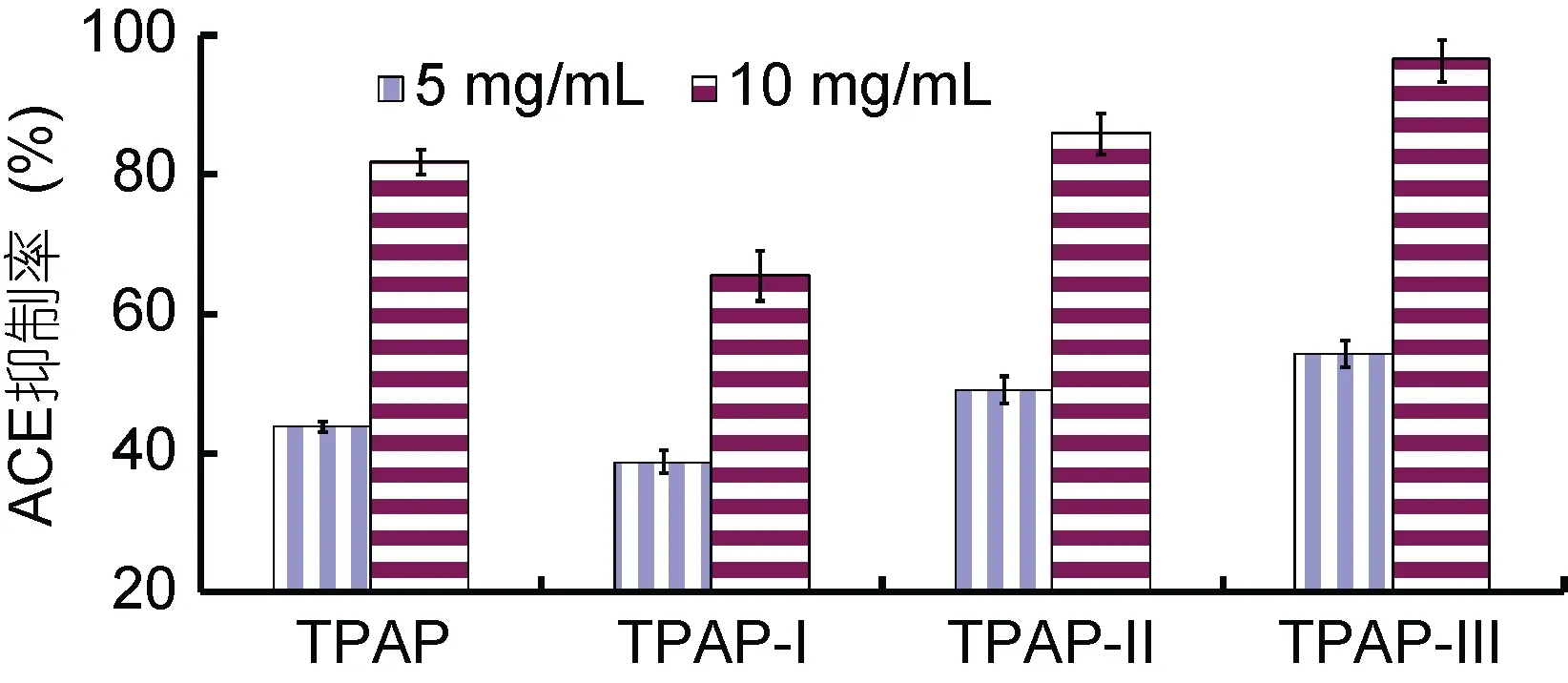
圖3 金槍魚碎肉蛋白酶解物及其超濾分級部分的ACE抑制率(n=3)Fig.3 ACE inhibition ratio of TPAP and its fractions by ultrafiltration (n=3)
據報道, 蛋白酶解物的生物活性與其分子量具有密切關系, 小分子量的多肽易于與靶點結合或通過血腦屏障而發揮其生物活性(Pihlanto-Lepp?l?, 2001;Ranathungaet al, 2006; Wanget al, 2012)。因此, TPAPIII的高活性與所含大量的低分子量多肽關系密切。
2.4 TPAP-III的Sephadex G-25凝膠過濾層析
圖4表明: TPAP-III經Sephadex G-25凝膠過濾層析后得5個洗脫組分: TPAP-III-1、TPAP-III-2、TPAP-III-3、TPAP-III-4和TPAP-III-5。5個組分的ACE抑制率如圖5所示: 在3 mg/mL和5 mg/mL濃度下, TPAP-III-4均顯示出最強的ACE抑制率, 分別為43.4%±1.75%和73.25%±1.83%。
2.5 TPAP-III-4的純度檢測和氨基酸序列分析
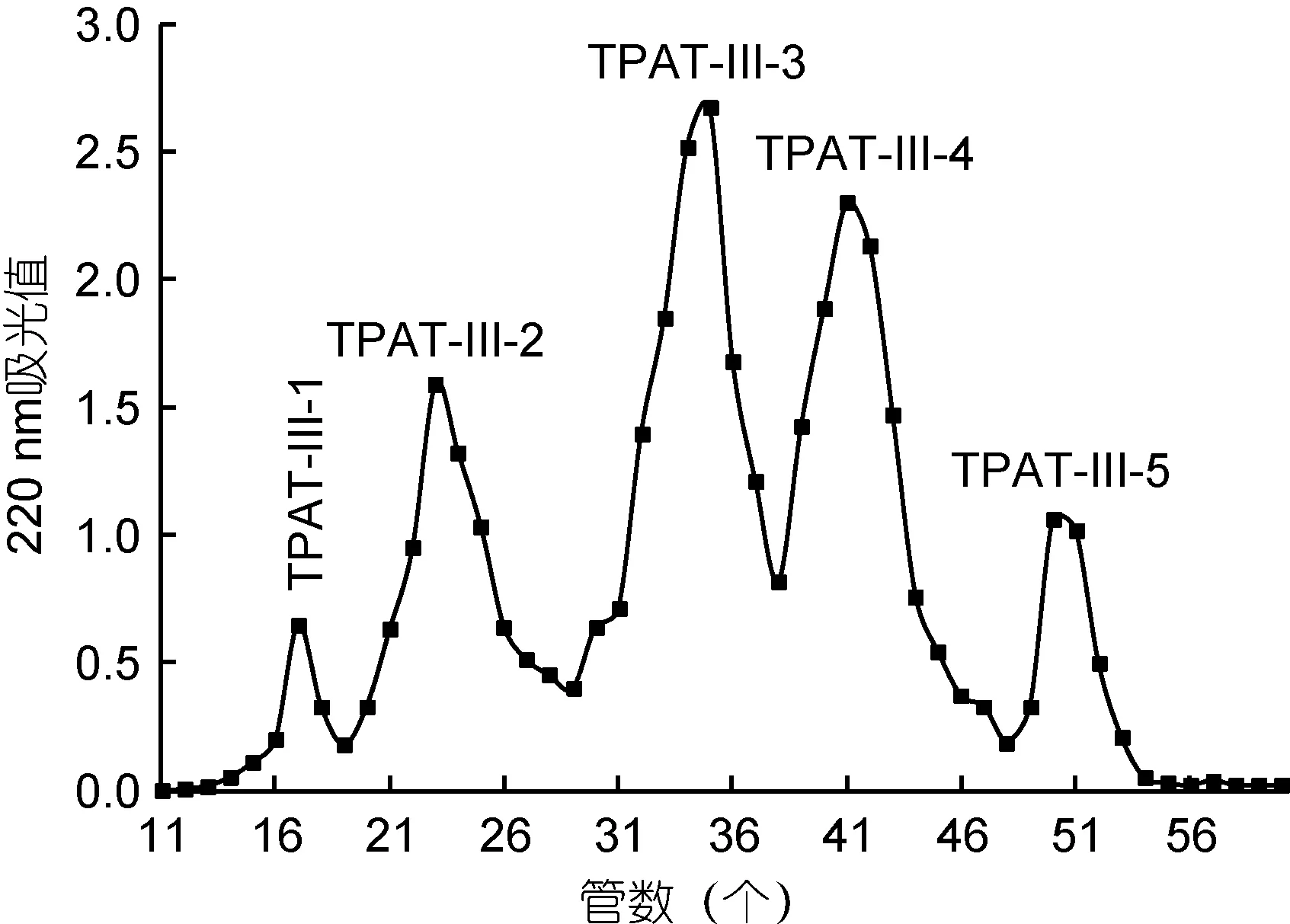
圖4 TPAP-III的Sephadex G-25凝膠過濾層析Fig.4 Gel filtration chromatography of TPAP-III on a Sephadex G-15 column
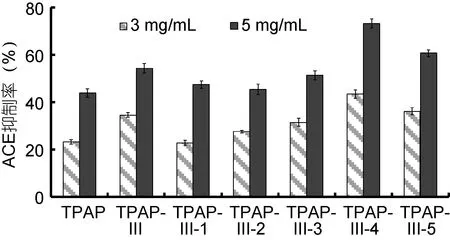
圖5 TPAP-III的Sephadex G-25凝膠過濾層析分段部位的ACE抑制率(n=3)Fig.5 ACE inhibition ratio of fractions from TPAP-III
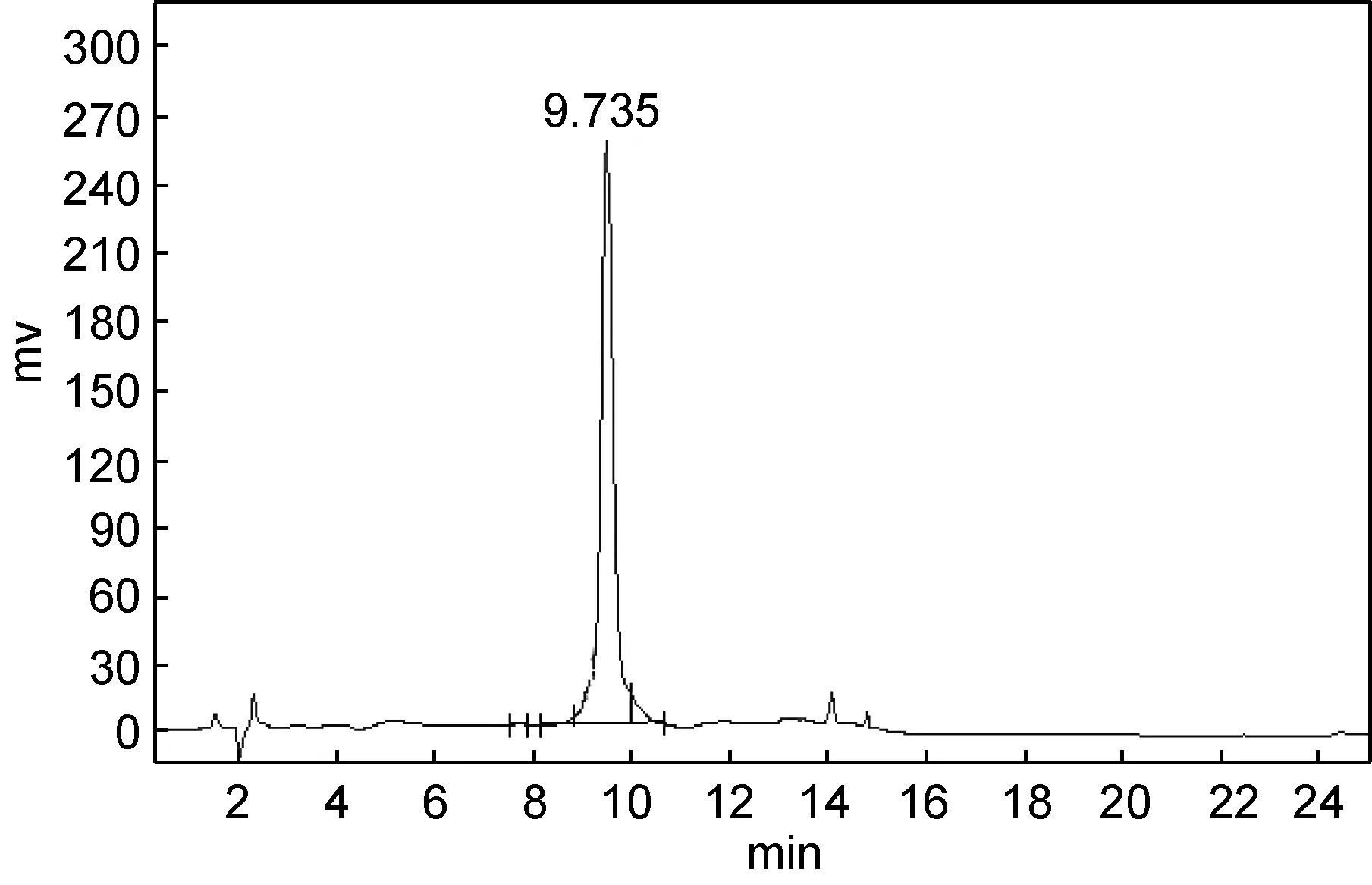
圖6 TPAP-III-4的RP-HPLC圖Fig.6 RP-HPLC chromatogram of TPAP-III-4
TPAP-III-4經RP-HPLC檢測基本為單一峰(圖6),純度達到氨基酸序列分析的要求。利用Edman降解法經蛋白質序列分析儀測定TPAP-III-4的序列為Phe-Gly-Gly-Val (FGGV), ESI-MS檢測給出分子離子峰m/z379.50 [M+H]+(圖7), 與理論分子量378.42Da相吻合。
3 結論
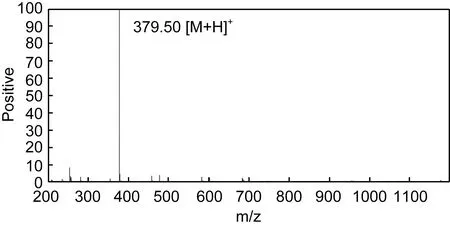
圖7 TPAP-III-4質譜圖Fig.7 Mass spectrogram of TPAP-III-4
本實驗以ACE抑制率為指標, 采用堿性蛋白酶從金槍魚碎肉蛋白中制備降壓肽, 極差R分析表明:酶用量是優化條件中影響最大的因素, 酶解時間的影響最小, 最佳酶解工藝條件為: 酶用量1.5%, pH 9.5, 酶解溫度50°C, 酶解時間5h。利用D101大孔吸附樹脂對酶解物進行脫鹽處理的工藝條件為: 上樣質量濃度10 mg/mL、流速1.5 BV/h、解吸劑75%乙醇。
脫鹽酶解物經過超濾和凝膠滲透色譜分離純化,得到ACE抑制率較好的單體降壓肽Phe-Gly-Gly-Val(FGGV)。已有的研究證明寡肽相對于蛋白質或單一氨基酸具有更強的生物活性和更易在體內吸收的優點(Wanget al, 2012, 2013; Luoet al, 2013; Chiet al,2014)。Phe-Gly-Gly-Val (FGGV)為四肽化合物, 分子量小, 易于在人體內吸收, 從而更容易發揮較強的降壓功效。另外, Cheung等(2009)發現活性較強的ACE抑制肽C端氨基酸一般為具環狀結構的芳香族氨基酸(如色氨酸、酪氨酸、苯丙氨酸等)或脯氨酸; N端為長鏈或具支鏈的疏水氨基酸(如纈氨酸、亮氨酸、異亮氨酸等)或堿性氨基酸可以提高肽的抑制活性。綜上分析可推知, Phe-Gly-Gly-Val (FGGV)具有強的ACE抑制活性是由于其分子量小、含有活性氨基酸及其氨基酸排列順序等因素綜合影響的結果。
于 婭, 楊瑞金, 王 璋, 2004. 牡蠣短肽的制備及ACE抑制活性. 無錫輕工大學學報, 23(2): 49—53
杜 帥, 宋 茹, 鄭 斌等, 2013. 風味蛋白酶水解金槍魚(Eleotridae)碎肉蛋白的動力學模型研究. 海洋與湖沼,44(4): 1073—1077
羅紅宇, 杜 帥, 鄭 斌等, 2013. 雙酶分步水解金槍魚(Eleotridae)碎肉制備高F值酶解液的工藝研究. 海洋與湖沼, 44(4): 906—912
徐懷德, 殷金蓮, 馮麗丹等, 2008. 甲魚蛋白酶解物體外ACE抑制和抗氧化活性研究. 中國食品學報, 8(2): 58—64
譚洪亮, 郁 迪, 王 斌等, 2014. 金槍魚魚骨膠原肽的制備及抗氧化活性研究. 水產學報, 38(1): 143—148
戴志遠, 朱鳳仙, 張燕平等, 2009. 河蚌酶解降壓肽的初步分離及性質研究. 中國食品學報, 9(4): 76—81
Cheung I W, Nakayama S, Hsu M Net al, 2009. Angiotensin-I converting enzyme inhibitory activity of hydrolysates from oat (Avena sativa) proteins by in silico and in vitro analyses.J Agric Food Chem, 57(19): 9234—9242
Chi C F, Wang B, Deng Y Yet al, 2014. Isolation and characterization of three antioxidant pentapeptides from protein hydrolysate of monkfish (Lophius litulon) muscle.Food Res Int, 55: 222—228
Cushmand W, 1971. Spectrophotometric assay and properties of the angiotens inconverting enzyme of rabbit lung. Biochem Pharmacol, 20(2): 1673—1675
Enari H, Takahashi Y, Kawarasaki Met al, 2008. Identification of angiotensin I-converting enzyme inhibitory petides derived from salmon muscle and their antihypertensive effect. Fish Sci, 74(4): 911—920
Fujita H, Yoshikawa M, 1999. LKPNM: a prodrugtype ACE-in-ihibitory peptide derived from fish protein.Immunopharmacology, 44(1/2): 123—127
Jae Y J, Pyo J P, Ji Y Ket al, 2004. A novel angiotensin I converting enzyme inhibitory peptide from Alaska pollack(Theragra chalcogramma) frame protein hydrlysate. J Agric Food Chem, 52(26): 7842—7845
Lee J K, Jeon J K, Byun H G, 2014. Antihypertensive effect of novel angiotensin I converting enzyme inhibitory peptide from chum salmon (Oncorhynchus keta) skin in spontaneously hypertensive rats. J Funct Foods, 7: 381—389
Liu X, Zhang M, Jia Aet al, 2013. Purification and characterization of angiotensin I converting enzyme inhibitory peptides from jellyfishRhopilema esculentum. Food Res Int,50(1): 339—343
Luo H Y, Wang B, Li Z Ret al, 2013. Preparation and evaluation of antioxidant peptide from papain hydrolysate ofSphyrna lewinimuscle protein. LWT-Food Sci Technol, 51: 281—288
Pihlanto-lepp?l? A, 2001. Bioactive peptides derived from bovine whey proteins: opioid and ace-inhibitory peptides. Trends Food Sci Tech, 11(9/10): 347—356
Ranathunga S, Rajapakse N, Kim S K, 2006. Purification and characterization of antioxidative peptide derived from muscle of conger eel (Conger myriaster). Eur Food Res Technol, 222(3/4): 310—315
Shyni K, Hema G S, Ninan Get al, 2014. Isolation and characterization of gelatin from the skins of skipjack tuna(Katsuwonus pelamis), dog shark (Scoliodon sorrakowah),and rohu (Labeo rohita). Food Hydrocolloid, 39: 68—76
Toriki H, 1993. Inhibition of angiotens inconverting enzyme byBacillus iicheniformisalkaline protease hydrolyzates derived from sardine muscle. Biosci Biotech Bioch, 67(1):921—924
Wang B, Li Z R, Chi C Fet al, 2012. Preparation and evaluation of antioxidant peptides from ethanol-soluble proteins hydrolysate ofSphyrna lewinimuscle. Peptides, 36: 240—250
Wang B, Li L, Chi C Fet al, 2013. Purification and characterisation of a novel antioxidant peptide derived from blue mussel (Mytilus edulis) protein hydrolysate. Food Chem, 138: 1713—1719

